酶解制备猪小肠粘膜蛋白粉工艺条件优化
2018-04-26葛庆丰丁祺祺杨祥凡尹永祺贾铁平吴满刚
葛庆丰,丁祺祺,陈 胜,杨祥凡,尹永祺,贾铁平,吴满刚,于 海,*
(1.扬州大学食品科学与工程学院,江苏扬州 225127;2.江苏省淮扬菜产业化工程中心,江苏扬州 225127;3.江苏万力生物科技有限公司,江苏东台 224200)
猪肠膜蛋白(dried porcine soluble,DPS)是一种营养性动物蛋白原料,由猪肠膜水解制得[1]。DPS具有小肽及游离氨基酸含量丰富、动物吸收利用率高及适口性好等营养特性,研究发现,日粮中添加DPS粉可显著提高仔猪日增重、减少断奶应激并降低死亡率[2]。因此,目前DPS粉已被广泛用于动物生产中,尤其是仔猪断奶及保育阶段日粮生产[3]。
由于化学水解法难以控制猪肠膜水解程度、易破坏氨基酸结构且需去除酸碱溶剂,而酶解猪肠膜法不仅可保持原料蛋白营养价值而释放出不同链长的生物活性肽,同时生产成本及污染程度低,其已成为DPS粉制备工艺中的研究热点[4-7]。舒夏娃采用双酶分段水解工艺,得到水解肠粘膜最佳工艺参数,制备出低分子肽含量较高的肠粘膜蛋白粉产品[8]。王春维等[9]初步研究了木瓜蛋白酶和胰蛋白酶对猪肠粘膜水解效果,实验结果表明木瓜蛋白酶优于胰蛋白酶,酶解工艺条件为:水解时间7 h,温度60 ℃,酶加量2%。目前国内外猪肠膜的研究开发较少,对酶解制备工艺优化方面没有进行深入探讨。
在我国众多肝素生产企业中,肠粘膜提取肝素后的下脚料一般作为废弃物随污水直接排放[10],不仅造成蛋白资源的大量浪费,而且由于传统的生产工艺,会产生腥臭、污水,污染环境[11]。近几年来,选用生物价值不高的副产物及食品工业的废水、废物为原料,制备一系列功能各异的生物活性物质已经成为食品领域的研究趋势。肠粘膜作为肠衣生产加工过程中的副产物,富含蛋白质,蛋白质总量高达60%,具有极高的研究价值[9]。因此,本实验以天然肠衣加工副产物肠粘膜为原料,以产品可溶性蛋白含量为指标,通过响应面分析法优化肠粘膜蛋白粉的制备工艺参数,筛选适合用于酶解肠粘膜的蛋白酶,旨在实现动物副产资源的循环利用,从源头减量排放减少环境污染,节约饲料生产成本,推动肠粘膜蛋白粉在国内饲料中的广泛应用,产生巨大经济和社会效益。
1 材料与方法
1.1 材料与仪器
肠粘膜(肠衣加工过程中的废弃物) 江苏联众肠衣有限公司;木瓜蛋白酶(酶活>1000 U/mg),胰蛋白酶(酶活>250 U/mg),胃蛋白酶(酶活>3000 U/mg) 上海蓝季生物有限公司;邻苯二甲醛、甲醇、十二烷基硫酸铵(SDS)、β-巯基乙醇、磷酸二氢钠、四硼酸钠、磷酸氢二钠 国药集团化学试剂有限公司,所有试剂均为国产分析纯试剂。
INFINITE 200 PRO酶标仪 瑞士Tecan集团有限公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司;SX-500自动蒸汽消毒柜 日本TOMY公司;W201恒温水浴锅 上海申胜生物技术有限公司;BCD-215DF电冰箱 青岛海尔股份有限公司;Sorvall ST 16R高速冷冻离心机 德国Thermo Fisher科技有限公司。
1.2 实验方法
1.2.1 肠粘膜蛋白粉的制备 称取一定质量肠粘膜溶于缓冲液中,1×104r/min匀浆10 s,根据不同蛋白酶最适水解条件对肠粘膜进行水解,水解结束后沸水浴灭活5 min,4000 r/min离心15 min,取上清液冷冻干燥,最后在干燥皿中保存肠粘膜蛋白粉。
1.2.2 可溶性蛋白含量测定 用福林-酚法测定肠粘膜可溶性蛋白含量[12]。
1.2.2.1 标准曲线的制作 配制标准蛋白质溶液:称取250 μg牛血清蛋白,溶于1 mL蒸馏水中,配成250 μg/mL的牛血清蛋白溶液。分别吸取0.0、0.2、0.4、0.6、0.8、1.0 mL标准蛋白液于带塞试管中,再分别加入蒸馏水到1 mL。每个试管各加5.0 mL试剂甲,混匀后室温放置10 min,加入0.5 mL试剂乙,立即混匀,室温反应30 min,在600 nm处测吸光值,以OD600为纵坐标,蛋白含量为横坐标,绘制标准曲线,得到回归方程:y=1.2602x+0.8106,R2=0.9985。
1.2.2.2 可溶性蛋白含量的计算 取0.5 mL酶解液,按照标准曲线制作步骤操作,由回归方程计算得到对应的牛血清蛋白的数量从而得到可溶性蛋白含量。
样品中蛋白含量(%)=[X(μg/mL)×样品总体积(mL)×100]/[样品重量(g)×106]
1.2.3 蛋白酶筛选 选择木瓜蛋白酶,胰蛋白酶和胃蛋白酶对肠粘膜进行水解,以可溶性蛋白含量为评价指标筛选合适蛋白酶,具体水解条件如表1所示。

表1 蛋白酶的选择Table 1 The choice of protease
1.2.4 水解工艺优化
1.2.4.1 单因素实验 在筛选出最适蛋白酶基础上,保持其他条件不变,分别研究水解时间、蛋白酶添加量和液固比对酶解液中可溶性蛋白质含量的影响。
水解时间:固定液固比为3 mL/g,蛋白酶添加量为5000 U/g蛋白,分别水解3、4、5、6、7、8 h,测定可溶性蛋白含量。
蛋白酶添加量:固定液固比为3 mL/g,水解时间为6 h,蛋白酶添加量分别为1000、2000、3000、4000、5000、6000 U/g蛋白,测定可溶性蛋白含量。
液固比:固定水解时间6 h,蛋白酶添加量为5000 U/g蛋白,液固比分别为1、2、3、4、5、6 mL/g,测定可溶性蛋白含量。
1.2.4.2 响应面实验 在单因素实验的基础上,采用3因素3水平的Box-Behnken[13-14]设计,考察水解时间、酶添加量和液固比3个因素对可溶性蛋白质含量的影响,实验因素水平见表2,以可溶性蛋白质含量为响应值,通过响应曲面法优化酶解条件,采用Design-expert 8.0.6对实验数据进行回归分析,建立二次线性回归方程,预测最佳工艺参数[15-17]。

表2 Box-Behnken实验设计因素水平表Table 2 Variables and their levels and actualvalues employed in Box-Behnken design
1.3 数据分析
各指标测定重复3次,结果以“平均值±标准差”表示。使用SigmaPlot软件绘制散点图,使用DPS软件进行显著性分析和标准差分析,运用Design-Expert 8.0.6软件设计并进行响应面实验数据分析。
2 结果与讨论
2.1 蛋白酶的筛选
蛋白酶具有特异性、专一性的特点,因此不同蛋白酶对肠粘膜的水解效果不同[18]。由图1可以看出,木瓜蛋白酶制备得到的肠粘膜蛋白粉可溶性蛋白含量为7.37%±0.06%显著高于(p<0.05)胰蛋白酶和胃蛋白酶;木瓜蛋白酶属于半胱氨酰基蛋白酶,能够降解胶原纤维和结缔组织蛋白质,将肌动蛋白和胶原蛋白降解成为小分子的多肽[19],其在肉类食品中的应用十分广泛[20]。因此选用木瓜蛋白酶进行后续实验。
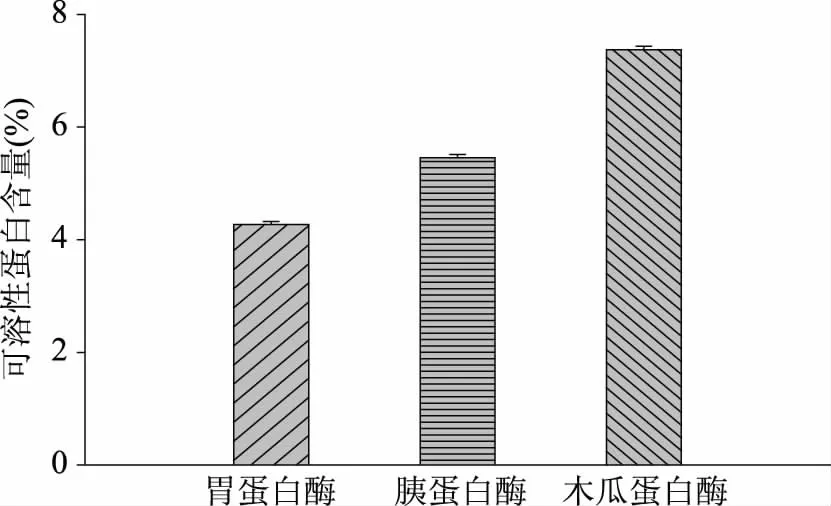
图1 不同蛋白酶对可溶性蛋白含量的影响Flg.1 Effects of different protease on soluble protein content
2.2 木瓜蛋白酶酶解单因素实验
2.2.1 水解时间对可溶性蛋白含量的影响 如图2所示,随着水解时间的延长,酶解液中可溶性蛋白含量逐渐增加,水解7 h时,其可溶性蛋白含量最高为15.20%±0.04%,随后缓慢降低。这是因为水解初期阶段,底物和蛋白酶充分酶解,酶解产物的可溶性蛋白含量增加;随水解时间延长,酶解液中肽键进一步断裂,导致可溶性蛋白含量降低。贾韶千等[21]以DPPH自由基清除率为指标研究水解时间对黄鳝鱼多肽水解效果的影响,发现水解时间延长,水解反应中的一些肽段被再次水解,导致水解效果降低。选择水解时间7 h作为最适水解时间。

图2 水解时间对肠粘膜可溶性蛋白含量的影响Flg.2 Effects of hydrolysis time on the soluble protein content of intestinal mucosa
2.2.2 酶添加量对可溶性蛋白含量的影响 如图3所示,随着木瓜蛋白酶添加量的增加,肠粘膜可溶性蛋白含量增加,这是因为酶添加量越多,底物反应越彻底,酶添加量为5000 U/g蛋白时,可溶性蛋白含量最大为15.59%±0.05%。继续添加蛋白酶时,底物已经充分水解,可溶性蛋白含量反而下降,可能因为是继续增加酶添加量,导致酶自身水解,酶活力降低,进而影响可溶性蛋白含量[22]。程水明等[23]在木瓜蛋白酶酶解海蜇脑蛋白工艺的优化一文中指出,酶添加量过高时,由于酶本身的相互水解作用加强,会抑制酶对底物的水解;当酶添加量较小时,主要为酶控反应,随着酶添加量的增加,水解效果会越好。因此选择酶添加量5000 U/g进行响应面实验。
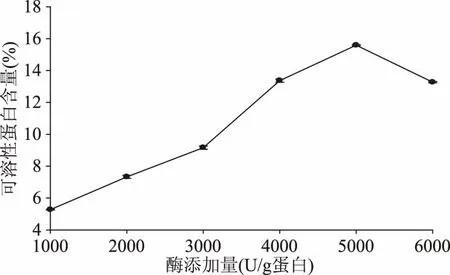
图3 酶添加量对肠粘膜可溶性蛋白含量的影响Flg.3 Effects of enzyme addition on soluble protein content of intestinal mucosa
2.2.3 液固比对可溶性蛋白含量的影响 如图4所示,随着液固比的增加,肠粘膜可溶性蛋白含量增加,这是因为底物浓度较低时,只有一部分酶与底物结合,随着底物浓度增加,酶与底物充分反应,中间产物增多;当液固比较大时,使得蛋白酶有效浓度降低,从而不利于蛋白水解。赵世光等[24]研究液固比酶法制备芝麻多肽的影响,发现多肽产率达到最高值时继续增加液固比后,多肽产率增幅不明显。液固比能反应溶质在溶剂中的溶解状况,液固比较小时,反应体系黏度大,不利于蛋白酶与肠粘膜蛋白组分的接触,水解反应受到抑制,水解效果不佳;液固比较大时,降低了体系的黏度,促进了酶与蛋白之间的作用,可溶性蛋白含量增加。因此最适液固比为4 mL/g。
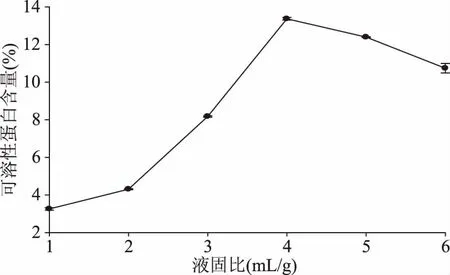
图4 液固比对肠粘膜可溶性蛋白含量的影响Flg.4 Effects of liquid quality on soluble protein content of intestinal mucosa
2.3 酶解条件响应面实验
2.3.1 响应面模型的建立与方差分析 根据单因素实验结果,选择水解时间、酶添加量、液固比3个因素为变量,可溶性蛋白含量为响应值,设计3因素3水平的响应面实验。
Box-Behnken实验设计组合及结果见表3。利用Design Expert 8.0.6软件进行二次多元回归拟合,得到描述酶解液中可溶性蛋白含量(Y)与自变量酶解时间(A)、酶添加量(B)和液固比(C)的二次多项回归拟合方程:
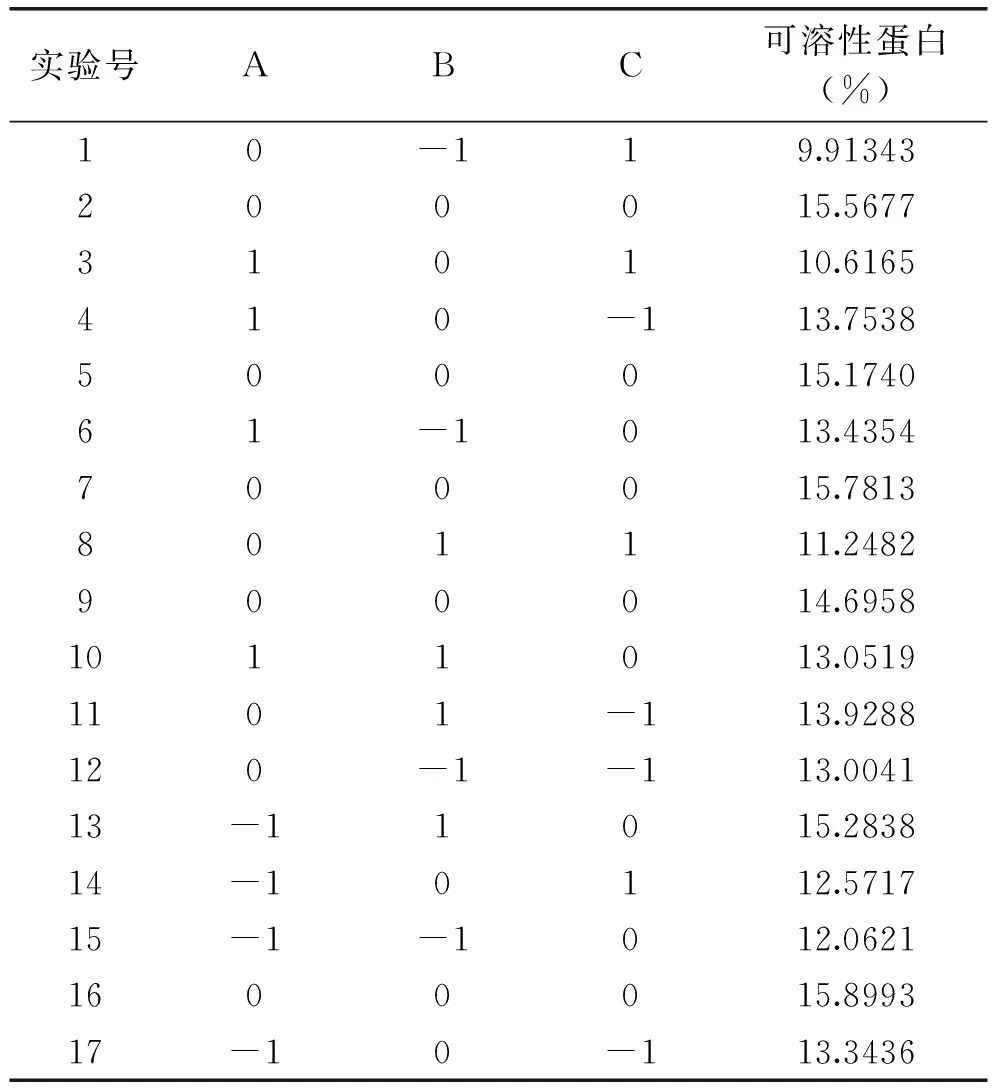
表3 响应面实验设计与结果Table 3 Response surface test design and results
Y=15.42-0.30A+0.64B-1.21C-.090AB-0.59AC+0.10BC-0.71A2-1.26B2-2.14C2。
由表4可知,B、AB、AC、A2、B2和C2项的F检验呈显著性,模型的p值显著,且失拟项不显著,说明方程的拟合是充分的,相关系数R2=0.9714,说明预测值与实测值之间具有较高的相关性,所以此模型能够描述木瓜蛋白酶酶解条件对肠粘膜的水解变化规律,能较好的优化实验方案。

表4 回归模型方差分析Table 4 Regression model variance analysis
2.3.2 响应曲面分析及优化 根据响应面数据回归分析所得的二次回归方程,作出响应面图和等高线图,可在实验范围内分析各变量之间的变化关系(图5~图7)。
图5为固定液固比4 mL/g,酶添加量和水解时间对肠粘膜可溶性蛋白含量的影响。由图所示,随着酶添加量的增加和水解时间的延长,可溶性蛋白的含量升高,其中,酶添加量对可溶性蛋白含量的影响较大。酶添加量在-0.5~1水平,水解时间在-1~0.5水平范围内,可溶性蛋白含量可获得最大值。

图5 酶添加量和水解时间对肠粘膜可溶性蛋白影响的等值线图和3D响应曲面图Flg.5 The contour map and 3D response surface map of the soluble protein of intestinal mucosa were affected by enzyme addition and hydrolysis time
图6为固定水解时间7 h,液固比和酶添加量对可溶性蛋白含量的影响。由图所示,随着液固比和酶添加量的增加,可溶性蛋白的含量先升高后下降,其中,液固比对可溶性蛋白含量的影响较大。液固比在-1~0.5水平,可溶性蛋白含量随液固比增大而迅速增加,之后可溶性蛋白曲面缓慢下降。由等值线可见,液固比在-0.8~0.3水平,酶添加量在-0.5~1水平范围内,可溶性蛋白含量有最大值。
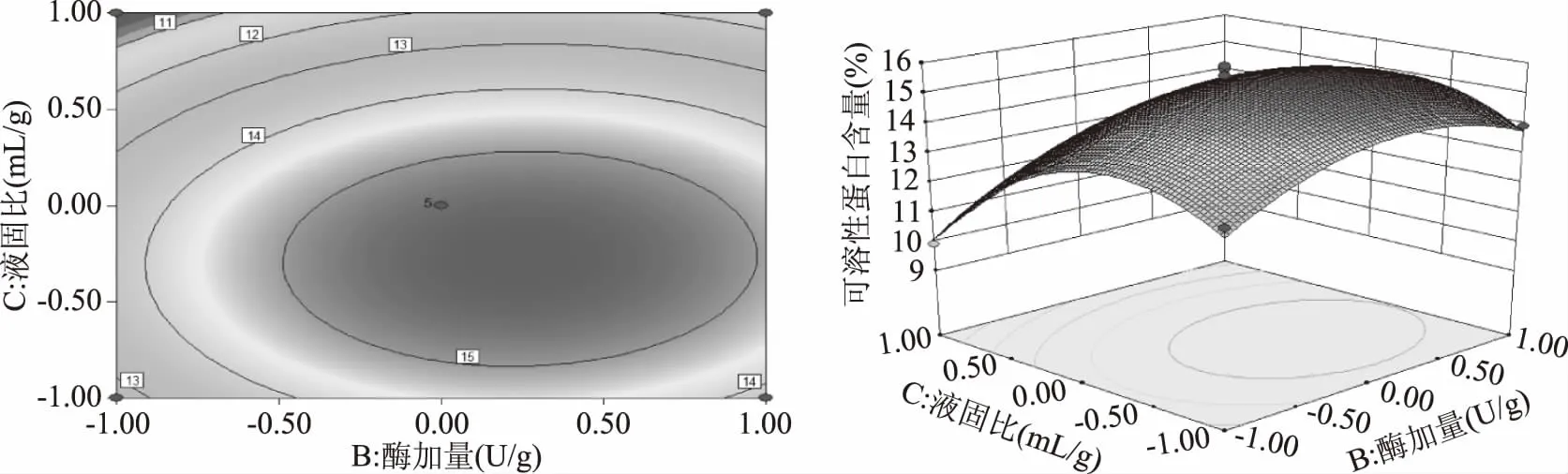
图6 液固比和酶添加量对肠粘膜可溶性蛋白影响的等值线图和3D响应曲面图Flg.6 The contour map and 3D response surface map of the soluble protein of intestinal mucosa were affected by liquid ratio and enzyme
图7为固定酶添加量5000 U/g蛋白,液固比和水解时间对可溶性蛋白含量的影响。由图所示,随着液固比和酶添加量的增加,可溶性蛋白的含量先升高后下降,其中,水解时间对可溶性蛋白含量的影响较小[25-26]。

图7 液固比和水解时间对肠粘膜可溶性蛋白影响的等值线图和3D响应面图Flg.7 The contour map and 3D response surface of the soluble protein of intestinal mucosa were affected by the liquid ratio and hydrolysis time
由响应面软件分析预测得到最大的响应值(Y)时,因子A、B、C对应的编码值分别为A=6.56、B=5372.12、C=1∶3.78,其所对应的木瓜蛋白酶生产肠膜蛋白粉的最佳工艺为:酶添加量为5372.12 U/g蛋白,水解时间为6.65 h,液固比为3.78 mL/g,可溶性蛋白含量最高为15.92%。
为了检验响应面法的可行性,采用得到的最佳酶解条件并考虑实际操作,修正工艺条件为:酶添加量5400 U/g蛋白,水解时间6.5 h,液固比4 mL/g,得到实验可溶性蛋白含量为15.81%±0.04%,与理论值相差0.75%。因此,响应面法对肠粘膜蛋白粉生产工艺进行优化具有可行性。
3 结论
以可溶性蛋白含量为指标,确定木瓜蛋白酶为最适用酶。在此基础上,通过单因素实验和响应面设计分析优化木瓜蛋白酶酶解猪小肠粘膜的工艺条件。确定最佳肠粘膜蛋白粉制备条件为:水解时间6.5 h、酶添加量5400 U/g、液固比为4 mL/g,在此条件下得到的水解产物可溶性蛋白含量为15.81%±0.04%。结果表明本实验方法对天然肠衣加工副产物-肠粘膜的利用开发具有参考价值。
[1]Johnston L J,Pettigrew J E,Baidoo S K,et al. Efficacy of sucrose and milk chocolate product or dried porcine solubles to increase feed intake and improve performance of lactating sows[J]. Journal of Animal Science,2003,81(10):2475-2481.
[2]陈璇. 猪小肠黏膜肝素加工废弃物中黏蛋白的提取分离、结构表征及免疫活性评价[D].青岛:中国海洋大学,2015.
[3]闫欲晓,粟桂娇. 车螺蛋白酶法水解条件的研究[J]. 食品工业科技,2003(10):90-92.
[4]Nishimura T,Kato H. Taste of free amino acids and peptides[J]. Food Reviews International,1988,4(2):175-194.
[5]Gill I,L Pez-Fandi O R,Jorba X,et al. Biologically active peptides and enzymatic approaches to their production[J]. Enzyme & Microbial Technology,1996,18(3):163-168.
[6]夏继华,张立娟,王长维,等.肠膜蛋白的研究现状及展望[J]. 饲料博览,2011(10):37-39.
[7]朱滔,黄小燕. 肠膜蛋白在动物生产中应用研究进展[J]. 饲料研究,2015(20):9-13.
[8]舒夏娃. 猪肠膜蛋白粉的制备及对仔猪生长性能的影响[D]. 武汉:武汉工业学院,2007.
[9]王春维,胡奇伟,杨海锋. 猪肠膜蛋白粉(DPS)生产工艺研究[J]. 粮食与饲料工业,2005(1):29-30.
[10]侍爱秋. 肠衣废水的综合利用[J]. 污染防治技术,2002(2):35-36.
[11]陈璇. 猪小肠黏膜肝素加工废弃物中黏蛋白的提取分离、结构表征及免疫活性评价[D].青岛:中国海洋大学,2015.
[12]Lee S J,Cheong S H,Kim Y S,et al. Antioxidant activity of a novel synthetic hexa-peptide derived from an enzymatic hydrolysate of duck skin by-products[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2013,62(12):276-280.
[13]Garcia-Mora P,Frias J,Pe As E,et al. Simultaneous release of peptides and phenolics with antioxidant,ACE-inhibitory and anti-inflammatory activities from pinto bean(PhaseolusvulgarisL.var.pinto)proteins by subtilisins[J]. Journal of Functional Foods,2015:18319-18332.
[14]赵新淮,冯志彪. 大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995(2):178-181.
[15]潘丽军,陈锦权. 实验设计与数据处理[M]. 南京:东南大学出版社,2008.
[16]Box G E P,Hunter J S,Hunter W G. Statistics for experimenters:An introduction to design,data analysis,and model building[J]. Wiley,1978,73(10):229.
[17]Jonh R C S. Response surfaces:designs and analyses[J]. Technometrics,1996,31(3):214-273.
[18]谢正军,金征宇. 苜蓿叶蛋白抗氧化肽水解用酶的筛选研究[J]. 食品科学,2007,28(7):342-346.
[19]刘春娥,林洪,单俊伟,等. 鱿鱼内脏蛋白质酶解工艺的研究[J]. 食品工业科技,2004(9):83-85.
[20]罗红玉. 茶渣多肽制备及其抗氧化活性研究[D].南京:南京农业大学,2011.
[21]贾韶千,李艳霞. 黄鳝鱼骨多肽制备及其抗氧化活性[J].食品科学,2016,37(1):133-138.
[22]吴显荣. 木瓜蛋白酶的开发与应用[J]. 中国农业大学学报,2005,10(6):11-15.
[23]程水明,赵俊仁,王春,等. 木瓜蛋白酶酶解海蜇脑蛋白工艺的优化[J]. 湖北农业科学,2014(7):1649-1653.
[24]赵世光,张焱,杨超英,等. 酶法水解芝麻粕制备芝麻多肽[J]. 中国油脂,2012,37(11):28-31.
[25]申彩红. 海参肽的酶法制备及其抗氧化、抗疲劳活性研究[D]. 厦门:华侨大学,2015.
[26]Guo Y,Pan D,Masaru T. Optimisation of hydrolysis conditions for the production of the angiotensin-I converting enzyme(ACE)inhibitory peptides from whey protein using response surface methodology[J]. Food Chemistry,2009,114(1):328-333.
