酶解牡丹籽粕蛋白制备抗氧化肽的工艺优化
2018-04-26张金宝程安玮贺圣文孙金月
阎 震,郭 溆,张金宝,王 青,程安玮,贺圣文,孙金月,4,*
(1.潍坊医学院公共卫生与管理学院,山东潍坊 261053;2.山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业部新食品资源加工重点实验室,山东济南 250100;3.潍坊医学院临床医学院,山东潍坊 261053;4.山东省农业科学院,山东济南 250100)
牡丹(PaeoniasuffruticosaAndr.)属于芍药科(Paeoniaceae)芍药属(Paeonia),为多年生落叶小灌木。牡丹籽含油量丰富,籽油中不饱和脂肪酸总量为80%~92%,其中亚麻酸含量为 32%~67%,亚油酸含量为 19%~35%[1-2]。α-亚麻酸作为人体的必需脂肪酸,具有降胆固醇、降血脂等多种保健功能。2011年3月国家卫生部批准凤丹和紫斑牡丹籽油为新资源食品,我国油用牡丹种植面积急剧扩大,牡丹籽产量逐年提高,油脂提取后产生大量的牡丹籽饼粕。目前这些饼粕主要作为饲料原料或食用菌培养基基料,综合开发利用水平较低,对其研究主要集中在牡丹籽饼粕蛋白的提取工艺优化和性质评价[3-6]。牡丹籽饼粕蛋白含量约25%,由于牡丹籽蛋白组成复杂,水溶性差,极大地限制了其在食品领域的应用。
1960年Marcuse首次报道了多肽具有抗氧化活性[7],此后对食源性抗氧化肽的活性研究引起广泛关注,并发现许多来自食物蛋白的寡肽或多肽具有抗氧化活性[8-11]。抗氧化肽是介于蛋白质和氨基酸之间的肽类,由5~16个氨基酸残基组成[12],与其它生物分子相比,具有极强的生物活性和多样性,抗氧化性更为显著,安全性高[13]。但目前用牡丹籽粕蛋白研发活性肽的研究还鲜见报道,个别有关牡丹籽蛋白酶解的工艺优化多以提高水解度为目标[14-15]。由于水解度与抗氧化能力之间并不是单纯的线性关系[16],根据蛋白水解度制备的抗氧化肽的活性还不是很高。
该研究将利用制备的牡丹籽粕蛋白为原料,探究应用响应面法(RSM)优化制备抗氧化活性肽的最佳酶解条件,获得利用牡丹籽粕蛋白制备具有较强抗氧化活性多肽的最佳工艺,为牡丹籽粕的精深加工开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
牡丹籽 山东菏泽尧舜牡丹生物技术有限公司;碱性蛋白酶(2.4AU-A/g)、中性蛋白酶(0.8AU-A/g)、复合蛋白酶(1.5AU-A/g)、风味蛋白酶(500LAPU/g) 诺维信公司;木瓜蛋白酶(800 U/mg)、1,1-二苯基-2-苦基肼(DPPH) 上海源叶生物科技有限公司;氢氧化钠、铁氰化钾、三氯乙酸、盐酸等均为分析纯 国药集团化学试剂有限公司。
电热恒温水浴锅DK-S24型 上海精宏公司;台式酸度计FE20K型 美国梅特勒-托利多公司;电子天平AR423CN型 美国奥豪斯公司;紫外分光光度计UV-1800型 日本岛津公司;高效冷冻离心机Allegra 25R型 美国 Beckman公司;超低温冰箱907型 美国赛默飞世尔公司;真空冷冻干燥机Lab-1A-50E型 北京博医康公司;离心机LXJ-ⅡB 上海安亭科学仪器厂;全自动氨基酸分析仪L-8900 日本日立公司。
1.2 实验方法
1.2.1 牡丹籽粕蛋白的制备 称取80 g牡丹籽粕加入2000 mL去离子水,用1 mol/L NaOH溶液调pH到11.0,180 W超声2.5 h,使蛋白充分溶解,5000 r/min离心10 min,去沉淀留上清,收集上清液用1 mol/L HCl调pH至3.80,5000 r/min离心10 min,去上清留沉淀,沉淀置于-60 ℃真空冷冻干燥机中冻干,-20 ℃储存备用。
1.2.2 蛋白酶的筛选 称取制备的牡丹籽粕蛋白5份,底物质量分数为2%、溶于去离子水,然后分别加入5种酶,加酶量6.25%,在各自最适温度和pH条件下酶解8 h,5种酶情况详见表1。酶解8 h后,将酶解液置于沸水中10 min灭酶活,10000 r/mmin离心10 min,在酶解过程的不同时刻记录为维持pH恒定所加入的NaOH的量计算水解度,取上清液冻干,配制成相同浓度的多肽溶液测定DPPH自由基清除能力。

表1 5种蛋白酶水解牡丹籽粕蛋白的最适酶解条件Table 1 Optimal reaction conditions of five enzymesused for hydrolysis of peony seed meal protein
1.2.3 牡丹籽粕蛋白的酶解 称取制备的牡丹籽粕蛋白溶于去离子水,置于80 ℃水浴中预热20 min,然后用0.5 mol/L NaOH溶液将混合液pH快速调至8.0;加入碱性蛋白酶的量为6.25%,缓慢搅拌混匀后,于50 ℃恒温水浴锅中进行酶解,通过滴加0.5 mol/L NaOH溶液使混合液pH保持不变,并记录一定时间间隔的碱液消耗量,来计算牡丹籽粕蛋白的水解度。2 h后将酶解液置于沸水中10 min灭酶活,冰浴迅速冷却,10000 r/min离心10 min,取上清液冷冻干燥备用。
1.2.4 多肽制备的单因素实验 在选用最佳蛋白酶碱性蛋白酶的基础上,以底物质量分数、酶解时间、加酶量([E]/[S])、酶解温度、酶解pH为自变量,以DPPH自由基清除率和水解度为响应值,研究各单因素对制备多肽的抗氧化活性的影响。在酶解温度50 ℃、底物质量分数2%、加酶量6.25%、pH8.0、酶解时间2 h的条件下酶解牡丹籽粕蛋白,设置各因素的水平分别为:底物质量分数0.5%、0.75%、1%、2%、3%、4%;水解时间1、1.5、2、2.5、3、3.5 h;加酶量2.50%、3.75%、5%、6.25%、7.50%、8.75%;酶解温度45、50、55、60、65 ℃;酶解pH6.0、7.0、8.0,9.0、10.0。
1.2.5 响应面优化实验 在单因素基础上筛选出影响较大的四个因子进行 Box-Behnken中心组合实验设计。固定pH=8.0,选择时间(A)、底物质量分数(B)、温度(C)、加酶量(D)为自变量,以DPPH自由基清除率为响应值,设计四因素三水平的响应面分析进行实验。确定利用酶解牡丹籽粕蛋白制备抗氧化肽的最佳工艺,并进行实验验证。响应面优化实验的自变量因素及水平设计见表2。
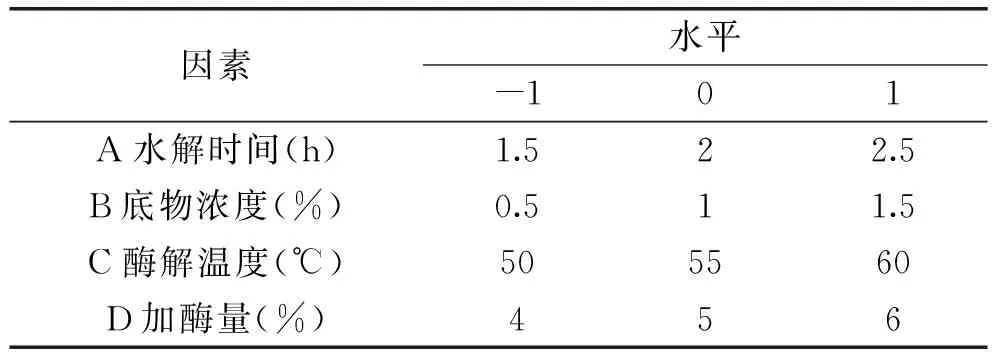
表2 响应面优化实验的自变量因素及水平设计Table 2 Independent variables and theirlevels used in response surface design
1.2.6 指标的测定
1.2.6.1 牡丹籽粕蛋白酶解物水解度的测定 根据pH-state 法[17]计算水解度(DH)。pH-state法是根据水解过程中释放质子的量进行水解度的测定。在蛋白质水解过程中记录不同时刻为维持反应体系pH恒定而消耗的碱量,根据消耗的碱量按下式计算出蛋白质的水解度。
式中,C:NaOH溶液浓度(mol/L);V:NaOH溶液消耗体积(mL);m:样品蛋白质质量(g);h:每克原料牡丹籽粕蛋白中肽键的毫摩尔数(h=7.84 mmol/g);T:实验温度(K)。
1.2.6.2 牡丹籽粕蛋白酶解物对DPPH自由基清除率的测定 将待测样品配制成浓度为133.3 mg/L的溶液,取2 mL溶液加入2 mL 0.1 mmol/L DPPH溶液,混匀,室温下避光反应30 min,于517 nm波长下测定吸光度值Ai。空白组加入2 mL样品液和2 mL去离子水,吸光度值为Aj。对照组加入2 mL DPPH溶液和2 mL去离子水,用4 mL无水乙醇调零,测定吸光度值为A0[18-20]。计算公式:
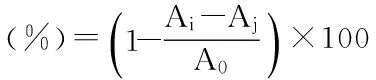
1.2.7 多肽中氨基酸组成分析 使用氨基酸全自动分析仪,根据GB 5009.124-2016对制备得到的牡丹多肽粉进行17种水解氨基酸组成分析。
1.3 数据统计分析
采用SPSS Statistics 17.0软件对数据进行显著性分析,结果以平均值±标准差表示。p<0. 05表示差异显著有统计学意义,p<0.01说明差异极显著。
2 结果与分析
2.1 水解蛋白酶的筛选
5种蛋白酶水解牡丹籽粕蛋白的水解度随酶解时间的变化曲线如图1A所示。水解反应都符合典型的酶学进程曲线,但每种酶又表现出各自不同的反应特性。牡丹籽粕蛋白的水解度随酶解时间的延长而逐渐增大,酶解反应的最50 min内,水解度增加较快,100 min后变缓。水解曲线结果表明,在前50 min水解速度从高到低依次为:复合蛋白酶>碱性蛋白酶>中性蛋白酶>风味蛋白酶>木瓜蛋白酶;50 min后复合蛋白酶和碱性蛋白酶的水解度增加趋势仍然较为明显,其余三种酶的水解度则上升缓慢,其中木瓜蛋白酶和风味蛋白酶的水解速度最为缓慢。这些结果表明,木瓜蛋白酶和风味蛋白酶这两种酶对牡丹籽粕蛋白的水解能力较弱,而复合蛋白酶和碱性蛋白酶较为适合酶解牡丹籽蛋白。碱性蛋白酶能特异性催化疏水性氨基酸的水解,而复合蛋白酶则作用广泛,二者较适合催化牡丹籽粕蛋白的水解,说明牡丹籽粕蛋白中含有大量的疏水性氨基酸,如丙氨酸、酪氨酸、缬氨酸等,这与庞雪飞等[15]的研究结果相符。

图1 不同蛋白酶酶解对牡丹籽粕多肽水解度(A)和DPPH自由基清除率(B)的影响Fig.1 Effects of proteases on hydrolysis degree A,DPPH free radical scavenging rate B of peptides prepared from peony seed meal
图1B结果表明,分别用5种蛋白酶酶解牡丹籽蛋白,基中经碱性蛋白酶酶解后得到的多肽对DPPH自由基的清除能力较强,且水解度高;经木瓜蛋白酶酶解后得到的多肽对DPPH自由基的清除能力最强,但水解度太低,制备得到的多肽量很少,蛋白的利用率极低,浪费严重。综合考虑水解度和DPPH自由基清除能力,碱性蛋白酶是水解牡丹籽粕蛋白制备抗氧化肽的最适宜蛋白酶,因此后续实验研究将选用碱性蛋白酶对牡丹籽粕蛋白进行酶解。
2.2 单因素实验
2.2.1 底物浓度对水解度及DPPH自由基清除率的影响 不同底物质量分数对水解度和DPPH自由基清除能力的影响差异极显著(p<0.01),结果如图2所示。随底物质量分数的增加,水解度与清除率都呈现先升高后降低的趋势。在底物质量分数为0.75%时,DPPH自由基清除率达到最大为50.83%,此时水解度为5.67%;底物质量分数为0.75%~2%时,清除率和水解度变化不大;之后二者都显著降低。该变化趋势可能是因为底物浓度过大,导致有效浓度降低,反应体系的粘度增大,酶与底物不能充分接触反应,导致水解度与清除率都降低[21]。因此,选择0.5%、1%和1.5% 3个水平进行响应面分析。
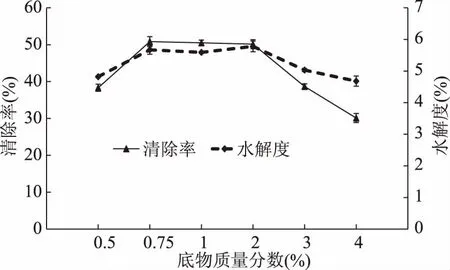
图2 底物浓度对酶解物水解度和DPPH自由基清除率的影响Fig.2 Effects of substance concentrations on DH and DPPH free radical scavenging activity of hydrolysates
2.2.2 酶解时间对水解度及DPPH自由基清除率的影响 酶解时间对水解度和DPPH自由基清除能力的影响差异极显著(p<0.01),结果如图3所示。随酶解时间的延长,牡丹籽粕蛋白的水解度先增加,酶解2.5 h时达最高值,然后趋于稳定;DPPH清除率在酶解2 h时达最大值为51.34%,而后随时间的延长清除率反而降低,推测原因可能是由于蛋白酶解过程是逐步进行的,具有DPPH自由基清除活性的肽段部分被酶解,导致活性降低。多肽的抗氧化活性在于其含有能与自由基反应的特殊基团,即供氢基团,只有这些多肽在适当的分子量时,这些特定的供氢基团才能够最大限度地接触自由基,从而表现出较强的抗氧化性[22]。因此,选择酶解时间1.5、2、2.5 h进行响应面分析。

图3 酶解时间对酶解物水解度和DPPH自由基清除率的影响Fig.3 Effects of hydrolysis time on DH and DPPH free radical scavenging activity of hydrolysates
2.2.3 加酶量对水解度及DPPH自由基清除率的影响 加酶量对水解度和DPPH自由基清除能力的影响差异极显著(p<0.01),结果如图4所示。DPPH自由基清除率随加酶量的增加而增大,当加酶量达到5%时,清除率达到最大,之后呈降低趋势。清除率下降的原因可能是过量的酶催化可使具有抗氧化活性的肽段进一步水解,失去活性。因此,选择加酶量4%、5%、6%三个水平进行响应面分析。
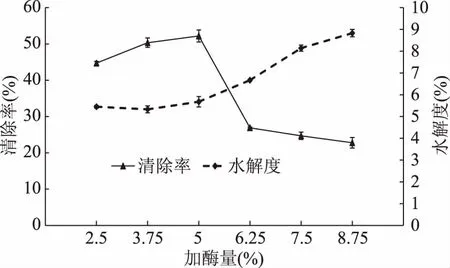
图4 加酶量对酶解物水解度和DPPH自由基清除率的影响Fig.4 Effects of enzyme dosage on DH and DPPHfree radical scavenging activity of hydrolysates
2.2.4 酶解温度对水解度及DPPH自由基清除率的影响 酶解温度对水解度和DPPH自由基清除能力的影响差异显著(p<0.05),结果如图5所示。随着温度的升高,酶解物的DPPH自由基清除率呈现先增加后降低的趋势,原因可能是温度过高会导致酶活力降低甚至失活[23]。在温度为55 ℃时,清除率达到最高,而此时的水解度却最低为5.65%;55~65 ℃时,酶解度升高,水解度与清除率的变化趋势不一致。相关研究表明,酶解产物的抗氧化性与水解度有一定的关系,但并不是水解度越高,抗氧化性就越强,相对较高水解度的蛋白水解产物可能含有电子供体物质,可与自由基反应,将其转化为更稳定的产物并终止自由基链反应[24]。研究抗氧化肽的工艺条件,我们应以酶解产物的抗氧化性作为响应值,而不能只简单地提高水解度,所以选择50、55、60 ℃三个因素进行响应面分析。
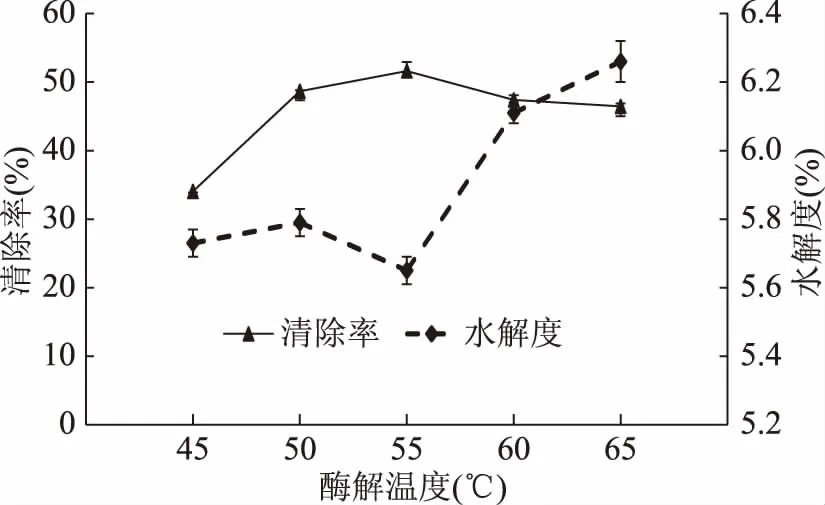
图5 酶解温度对酶解物水解度和DPPH自由基清除率的影响Fig.5 Effect of temperature on DH and DPPHfree radical scavenging activity of hydrolysates
2.2.5 pH对水解度及DPPH自由基清除率的影响 酶解pH对水解度和DPPH自由基清除能力的影响差异极显著(p<0.01),结果如图6所示。随着pH的升高,DPPH自由基清除率先升高后降低;当pH8.0~9.0时,清除率升高较缓慢,在pH为9.0时达最大。较高pH条件下进行酶解,反应体系中需加入较多的NaOH,NaOH可与反应过程中生成的酸中和生成盐,使得产品中盐分含量较高,在进行抗氧化活性测定前需增加脱盐工序,造成成本增加。所以,制备活性肽时选用的最适酶解pH为8.0,而不选择pH9.0作为响应面分析的因素。
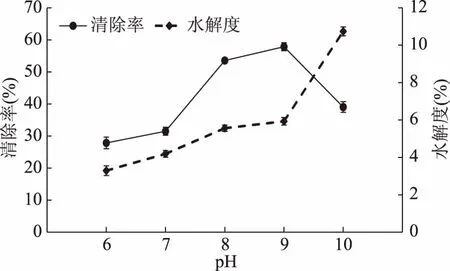
图6 pH对酶解物水解度和DPPH自由基清除率的影响Fig.6 Effects of pH value on DH and DPPH free radical scavenging activity of hydrolysates
通过上述各单因素对制备活性肽的影响的分析表明,牡丹籽粕蛋白酶解产物的水解度与抗氧化能力之间并不存在线性关系。本实验旨在研究利用牡丹籽粕蛋白制备抗氧化肽的工艺条件。因此,在进行响应面分析时只选用DPPH自由基清除率作为响应值。
2.3 酶解工艺参数的响应面实验优化
2.3.1 响应模型分析 响应面分析结果见表3,表中1~24号是析因实验,25~29号是中心实验。29个实验点分为析因点和零点,其中析因点为自变量,取值在X1、X2、X3、X4所构成的三维顶点;零点为区域的中心点,零点实验重复5次,用以估计实验误差。应用Design-Expert 8.0软件对各因素进行回归拟合分析,得到二次多项回归模型为:DPPH自由基清除率Y(%)=52.15-0.67A-1.36B+0.34C-0.65D-0.018AB-0.36AC+0.62AD-1.11BC+0.31BD+0.023CD-4.44A2-1.38B2-3.29C2-1.19D2。
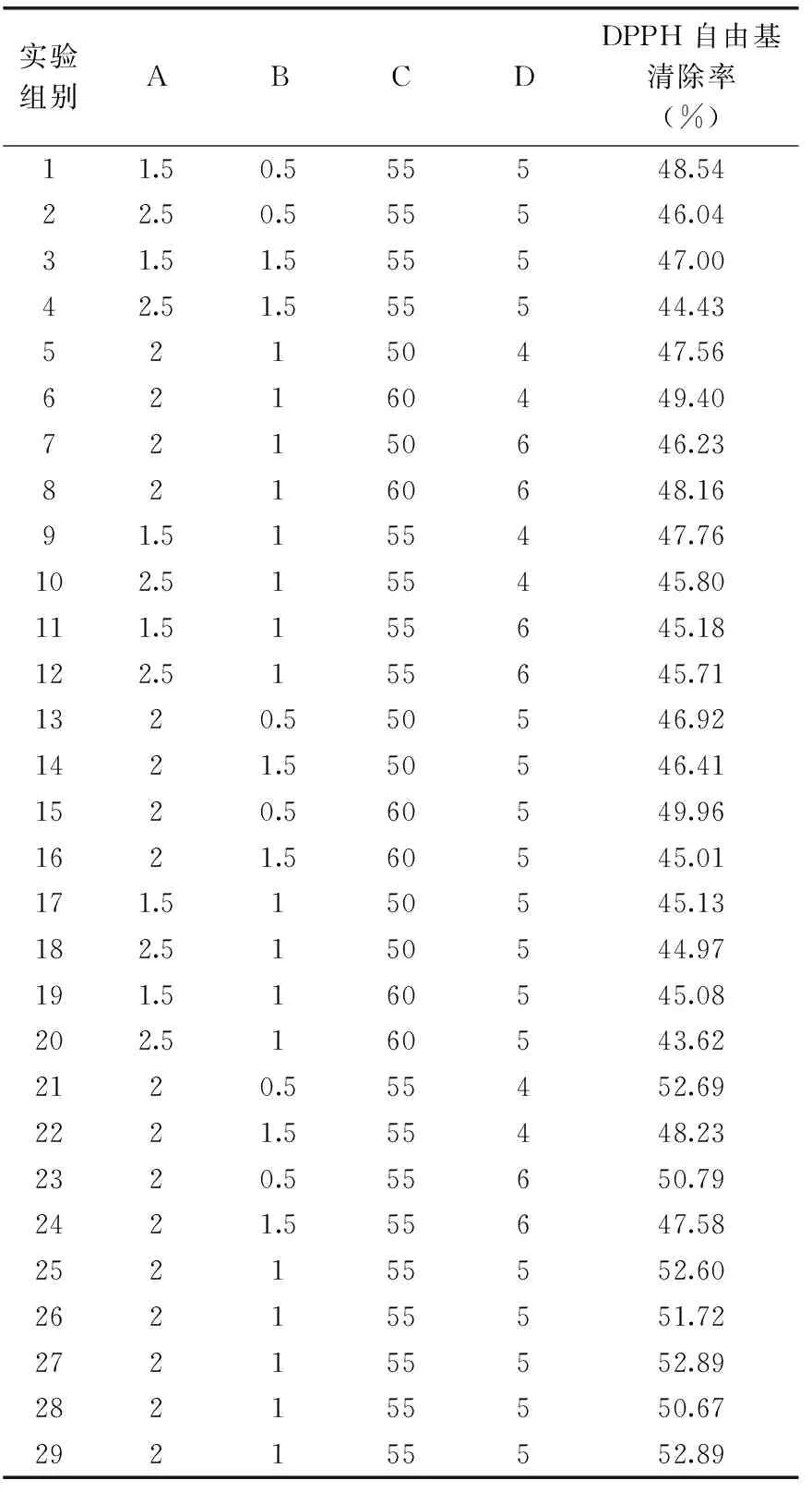
表3 响应曲面法实验设计及结果Table 3 Design and results of response surface experiment


表4 二次回归模型的方差分析结果Table 4 Analysis of variance for quadric regression model
2.3.2 两因子交互作用分析 各因子交互作用对DPPH自由基清除率的响应面三维和等值线如图7所示。结果表明,在所选范围内存在极值,它是响应曲面的最高点,也是等值线图中最小椭圆的中心。
图7(A~F)表明,底物质量分数对酶解产物DPPH自由基清除率的影响最为显著,曲面较陡;其次是酶解时间和加酶量;酶解温度对其影响最小,曲面平缓。底物质量分数与酶解时间,加酶量与酶解时间,酶解温度与底物质量分数之间的交互作用较为显著,等值线图中呈现椭圆。

图7 任意两变量交互作用对DPPH自由基清除率影响的响应曲面图Fig.7 Response surface plots for the synergetic effects of any two variables on DPPH radical scavenging activity
2.3.3 最佳酶解条件的预测及验证实验 通过二次多项数学模型进行解析,得出酶解蛋白的最佳工艺条件即底物质量分数0.7%、加酶量4.63%、酶解时间1.95 h、酶解温度56 ℃、pH8.0。根据实际的操作条件,将酶解牡丹籽蛋白制备抗氧化肽的最佳条件优化为底物质量分数0.7%、加酶量4.60%、酶解时间2 h、酶解温度56 ℃、pH8.0,在此条件下进行4次验证实验,结果测得酶解产物对DPPH自由基清除率为(52.49%±0.2768%)。通过实验获得的自由基清除率52.49%与理论预测值52.74%的误差小于1%,验证了该模型的有效性。
2.3.4 牡丹多肽粉氨基酸组成 通过对牡丹多肽粉进行17种水解氨基酸组成分析,可以看出氨基酸种类齐全,其中必需氨基酸含量较高,占总氨基酸量的32.24%,人体需要量最大的亮氨酸和赖氨酸含量较多,表明牡丹多肽具有较高的营养价值;17种水解氨基酸中谷氨酸含量最高,胱氨酸的含量最低,是牡丹籽多肽粉的第一限制氨基酸;异亮氨酸、亮氨酸、缬氨酸等必需氨基酸含量占总氨基酸的32.24%。
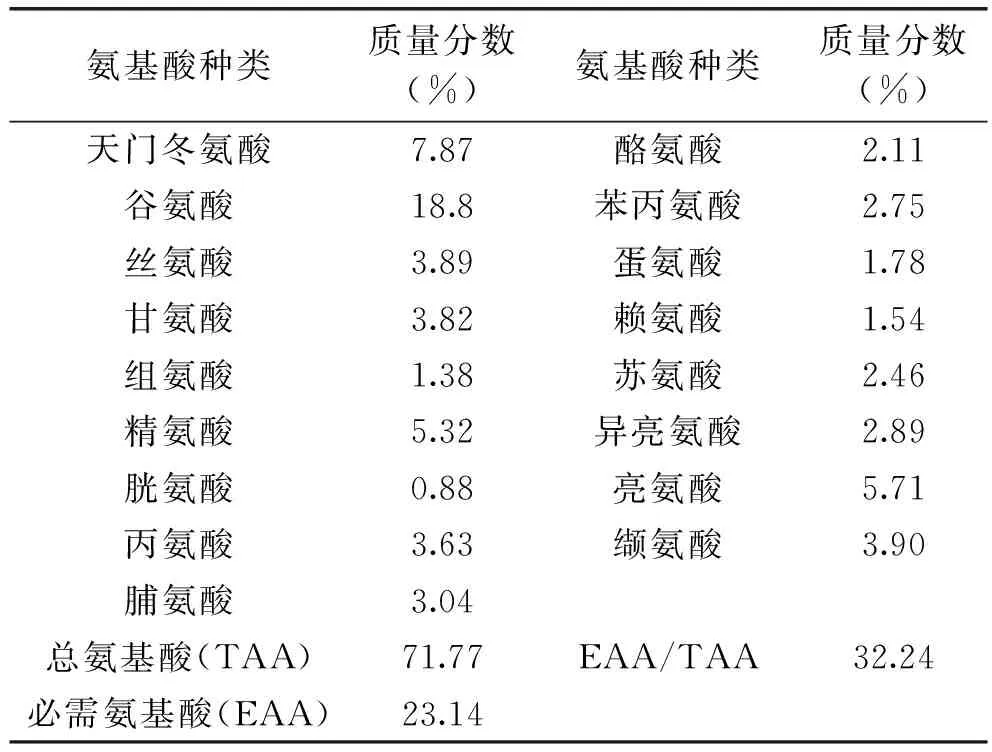
表5 牡丹多肽粉氨基酸组成分析Table 5 Analysis of amino acid composition of peony peptides
3 结论
选用5种蛋白酶对牡丹籽粕蛋白进行酶解,以蛋白水解度和DPPH自由基清除率为指标,筛选确定碱性蛋白酶为水解牡丹籽粕蛋白的最佳酶源,并得出酶解产物的抗氧化性与水解度有一定的关系,但并不是简单的线性关系;水解度越高,抗氧化性不一定越强。通过单因素和响应面法分析优化得到采用碱性蛋白酶水解牡丹籽粕蛋白制备抗氧化肽的最佳条件为:底物质量分数0.7%、加酶量4.60%、酶解时间2 h、酶解温度56 ℃、pH8.0,该条件下通过实验获得的DPPH自由基清除率为52.49%,与理论预测值52.74%的误差小于1%。对制备得到的牡丹多肽粉进行17种水解氨基酸组成分析,可以看出氨基酸种类齐全,其中必需氨基酸含量较高,占32.24%,表明牡丹多肽具有较高的营养价值。该研究利用新食品资源油用牡丹籽粕蛋白作为原料开展制备抗氧化肽的研究,提高了牡丹籽粕的利用率,为牡丹籽粕的精深加工开发利用提供了理论依据。
[1]王顺利,任秀霞,薛璟祺,等. 牡丹籽油成分、功效及加工工艺的研究进展[J]. 中国粮油学报,2016,31(3):139-146.
[2]朱献标,翟文婷,董秀勋,等.牡丹籽油化学成分及功能研究进展[J]. 中国油脂,2014,39(1):88-91.
[3]宋艳秋,吴苏喜,肖志红.牡丹籽蛋白的制备工艺优化及功能性质评价[J]. 中国油脂,2015,40(7):26-30.
[4]李加兴,房惠芳,陈选,等. 牡丹籽粕蛋白提取工艺优化及其等电点分析[J]. 食品与机械,2014,30(3):147-150.
[5]庞雪飞,何东平,胡传荣,等.牡丹籽蛋白功能特性的研究[J].中国粮油学报,2014,29(7):45-48.
[6]刘柏华,殷钟意,郑旭煦,等. 超声波对牡丹籽粕蛋白质碱提取工艺及氨基酸组成的影响[J]. 食品与发酵工业,2015,41(9):215-219.
[7]Marcuse R. Antioxidative effect of amino-acids[J]. Nature,1960,186(4728):886-887.
[8]陈丽,张瑜,谭亦成,等. 响应面法优化锐孔法制备大米抗氧化肽微胶囊工艺[J]. 食品科学,2014,35(22):97-103.
[9]Shavandi A,Hu Z,Teh S S,et al. Antioxidant and functional properties of protein hydrolysates obtained from squid pen chitosan extraction effluent[J]. Food Chemistry,2017,227:194-201.
[10]Garcíamora P,Martínmartínez M,Angeles B M,et al. Identification,functional gastrointestinal stability and molecular docking studies of lentil peptides with dual antioxidant and angiotensin I converting enzyme inhibitory activities[J]. Food Chemistry,2017,221:464.
[11]丁顺杰,罗金凤,丁晓雯,等. 酶解缫丝蚕蛹蛋白抗氧化肽的分离与稳定性研究[J]. 食品科学,2015,36(3):35-40.
[12]Chen H M,Muramoto Koji,Yamauchi Fumio,et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J].Journal of Agricultural & Food Chemistry,1996,44(9):2619-2623.
[13]王瑞雪,孙洋,钱芳.抗氧化肽及其研究进展[J]. 食品科技,2011,36(5):83-86.
[14]韩扬,马媛,王昌涛,等.牡丹籽蛋白酶解工艺条件的研究[J]. 食品工业科技,2009,30(10):250-256.
[15]庞雪风,何东平,胡传荣,等.不同水解度牡丹籽蛋白氨基酸组成及营养评价[J]. 食品工业,2014,35(11):288-292.
[16]武萌萌. 螺旋藻抗氧化多肽的制备及活性研究[D].北京:北京林业大学,2010.
[17]Adler-Nissen J. Enzymatic hydrolysis of food protein[M]. New York:Elsevier Applied Science,1986.
[18]Thaipong K,Boonprakob U,Crosby K,et al. Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition & Analysis,2006,19(6-7):669-675.
[19]于丽娜,高俊安,杨庆利,等. 酶解花生蛋白制备功能性短肽条件优化研究[J]. 食品科学,2012,33(11):104-109.
[20]Liu JR,Chen MJ,Lin CW. Antimutagenic and antioxidant properties of milk-kefir and soymilk-kefir[J].Journal of Agricultural and Food Chemistry,2005,53(7):2467-2474.
[21]赵立娜,汪少芸,饶平凡,等. 茶渣蛋白的提取、有限酶解及抗氧化性研究[J]. 中国食品学报,2012,12(2):53-59.
[22]Chen H M,Muramoto K,Yamauchi F,et al. Antioxidant properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. J Agric Food Chem,1998,46(1):49-53.
[23]贾韶千,李艳霞.黄鳝鱼骨多肽制备及其抗氧化活性[J].食品科学,2016,37(1):133-138.
[24]Jamdar S N,Rajalakshmi V,Pednekar M.D.,et al. Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J]. Food Chemistry,2010,121(1):178-184.
