黑木耳中多糖和类黄酮的隔氧提取及其协同抗氧化作用
2018-04-26郭艳莉
王 鹏,郭 丽,姜 喆,郭艳莉,马 雪,李 杨
(绥化学院食品与制药工程学院,黑龙江绥化 152061)
黑木耳(Auriculariaauricular)又名黑菜、光木耳、云耳等,属真菌类担子菌纲、木耳目、木耳科、木耳属。黑木耳作为药食同源真菌,营养价值和药用价值高,特别是黑木耳中多糖和类黄酮化合物具有抗氧化[1-4]、降血脂降胆固醇[1,5]、抗衰老[6]、抗肿瘤[7-8]等多种功效,逐渐得到人们的广泛关注。
有关黑木耳抗氧化物质的提取方法,主要集中在热水浸提[9-10]、乙醇溶液浸提[11]、回流提取[8]、超声波和微波辅助提取[9,12-13]开展研究,获得的黑木耳抗氧化多糖和类黄酮具有较好的清除自由基的能力,可抑制脂质过氧化,体外抗氧化效果显著。但在提取过程中黑木耳多糖和类黄酮的稳定性受氧气等因素影响而产生损失,隔氧提取可有效防止物质氧化,使生物活性物质发挥卓越功效,但目前有关隔氧提取黑木耳抗氧化成分的研究还鲜有报道。
黑木耳多糖和类黄酮因其优越的抗氧化功效成为天然抗氧化剂的良好来源,Peng等[14]建立小鼠皮肤光老化模型,体内实验发现黑木耳多糖可提高小鼠SOD和GSH-Px,延缓并抑制脂褐素和MDA的产生。张威[8]利用80%乙醇回流提取木耳黄酮和多酚,二者含量与抗氧化活性和抗肿瘤活性呈正相关。Fan等人[15]研究发现,添加9%木耳多糖粉的面包感官质量不变,木耳多糖粉在面包中具有较好的抗氧化效果。多种抗氧化活性物种联合使用时,其抗氧化活性往往较同浓度同剂量下的单一物质抗氧化活性强。因此,研究黑木耳抗氧化物质多糖和类黄酮之间的协同增效作用,寻找高效快速的复合方法对开发黑木耳新产品,提高其抗氧化效率具有重要意义。
本实验研究隔氧条件下超声波辅助提取黑木耳多糖、黑木耳类黄酮,将黑木耳多糖和类黄酮组合,探讨二者之间协同抗氧化作用,以期为开发绿色、高效的天然抗氧化剂提供理论依据。
1 材料与方法
1.1 材料与仪器
黑木耳 黑龙江省绥化市;芦丁标准品、葡萄糖标准品、DPPH 美国sigma公司;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、六氰合铁酸钾、苯酚、邻二氮菲、邻苯三酚、乙二胺四乙酸、三羟甲基氨基甲烷等试剂 均为国产分析纯。
KQ-600D 型数控超声波清洗机 昆山市超声仪器有限公司;752型紫外可见分光光度计 上海析谱仪器有限公司;80-2B型离心机 湖南星科科学仪器有限公司;FW135型高速万能粉碎机 天津市泰斯特仪器有限公司;SHZ-D(Ⅲ)型循环水式真空泵 上海科雳仪器设备有限公司。
湖北襄阳大头菜是湖北襄阳的农家品种[1],更是我国四大名腌菜之一。襄阳大头菜历史悠久,为诸葛亮隐居襄阳隆中时所创,在民间享有“诸葛菜”、“孔明菜”之美称[2]。但是襄阳大头菜的生产总体处于粗放式加工状态,由于雨水和尘土等因素的影响,腌制池或缸表面会形成一层白色的生物膜。随着生物膜的出现,大头菜的脆度明显降低且产生刺激性气味,最终导致产品品质下降直至失去经济价值。
1.2 实验方法
1.2.1 黑木耳多糖的提取 用万能粉碎机粉碎一定量的干燥黑木耳,过60目筛,称取5.0 g黑木耳粉,加入双蒸水(提取剂提前在0.1 MPa脱气10 min),采用超声波仪提取黑木耳多糖,提取条件:固液比1∶55 (w/v),超声波功率200 W,提取温度50 ℃,提取时间40 min,选择两种提取环境,分别为隔氧提取和有氧提取。隔氧提取采用减压提取,将样品和提取溶剂按比例加入圆底烧瓶进行抽真空处理,真空度为0.09 MPa。
1.2.2 黑木耳类黄酮的提取 取上述黑木耳干粉5.0 g,加入60%乙醇为提取剂(提取剂提前在0.1 MPa脱气10 min),浸泡1 h,采用超声波仪提取黑木耳黄酮。提取条件:固液比1∶40 (w/v),超声波功率400W,提取温度30 ℃,提取时间30 min,超声波提取后于8000 r/min离心10 min,取上清液,沉淀重复提取一次,选择两种提取环境,分别为隔氧提取和有氧提取。隔氧提取采用减压提取,将样品和提取溶剂按比例加入圆底烧瓶进行抽真空处理,真空度为0.09 MPa。
1.2.3 黑木耳多糖、类黄酮含量及抗氧化活性实验 测定隔氧提取和有氧提取下黑木耳多糖和黑木耳类黄酮的含量。以提取剂双蒸水和60%乙醇为阴性对照,以维生素C为阳性对照,分别测定两种条件下黑木耳多糖和黑木耳类黄酮对抗氧化指标还原能力,DPPH自由基、羟自由基和超氧阴离子自由基清除能力的影响。
1.2.4 黑木耳多糖和类黄酮复配实验及协同抗氧化研究
1.2.4.1 黑木耳多糖和类黄酮复配比例的确定 经上述1.2.3研究,确定隔氧提取条件为最佳提取条件,以此条件下提取的黑木耳多糖和黑木耳类黄酮进行复配实验,以黑木耳多糖、黑木耳类黄酮、维生素 C和维生素E为对照,多糖:类黄酮(v/v)复配比例为1∶9、3∶7、5∶5、7∶3、9∶1。分别在反应0 min和30 min进行DPPH自由基清除能力测定,在反应45 min时进行羟自由基清除能力测定,分析不同复配条件下溶液清除DPPH自由基能力和羟自由基能力。
1.2.4.2 黑木耳多糖和类黄酮复配抗氧化实验 a.不同浓度复配液的清除自由基能力:确定多糖和类黄酮最佳复配比例后,研究不同浓度复配液的清除DPPH自由基能力和羟自由基能力。取稀释后的复配液0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5 mL,定容至2 mL,分别在反应0 min和30 min进行DPPH自由基清除能力测定。取复配液0.2、0.4、0.6、0.8、1.0 mL,定容至1 mL,在反应45 min时进行羟自由基清除能力测定。
b.复配液降温过程清除自由基能力:研究复配液在降温过程中清除DPPH自由基能力和羟自由基能力。温度分别为60、50、40、30 ℃,在反应45 min时进行羟自由基清除能力测定。
c.复配液在不同反应时间清除自由基能力:研究复配液在不同反应时间清除DPPH自由基能力和羟自由基能力。清除DPPH自由基能力研究,反应时间分别为0、10、20、30、40、50、60 min。清除羟自由基能力研究反应时间分别为30、45、60、75、90、120 min。
1.2.5.1 多糖含量的测定 采用苯酚-硫酸法进行多糖含量的测定[16],按下式计算黑木耳多糖提取率。
计算公式为:
式中:X为多糖提取率,%。V1为样品定容体积,mL;V2为测定时所移取样品测定液的体积,mL;m1为经稀释后测定的多糖含量,mg;m2为黑木耳原料干重,g;N为稀释倍数。
1.2.5.2 类黄酮含量的测定 参考Chun等[17]的方法,略做改动。精密吸取浓度为12.8 mg/100 mL的芦丁标准溶液1.0、2.0、3.0、4.0、5.0 mL,分别置于10 mL的容量瓶中,用60%乙醇溶液补充至5 mL,分别加入5% NaNO2溶液0.3 mL,摇匀,放置6 min;再分别加入10%的Al(NO3)溶液0.3 mL,摇匀,放置6 min,加入1 mol/L的NaOH溶液4 mL,用水稀释到刻度,放置20 min,在510 nm处测定吸光度,并绘制标准曲线。所得标准曲线方程为:y=5.179x+0.120(R2=0.997)。取一定稀释倍数的黑木耳类黄酮样液按标准曲线制作方法测定吸光度值,利用标准曲线计算样品中类黄酮含量。
类黄酮含量计算公式为:
式中:V1为样品定容体积,mL;V2为比色测定时所移取样品测定液的体积,mL;m1为从标准曲线上查得样品测定液中类黄酮含量,mg;m2为样品质量,g。
1.2.5.3 还原能力的测定 参考Lee等[18]的方法,略做改动。取1 mL样液(空白用1 mL蒸馏水代替,其他试剂依次同下)中,加入2.5 mL质量分数为1%的六氰合铁酸钾(K3Fe(CN)6)和2.5 mL的磷酸盐缓冲液(PBS pH6.6,0.2 mol/L),混匀后在50 ℃保温20 min,然后加入2.5 mL质量分数为10%的三氯乙酸,混合后以3000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL质量分数为0.1%的Fecl3,混匀后在700 nm波长下比色,记录吸光度值。以25~200 μg/mL VC为标准溶液做标准曲线,以mg VC/mL表示铁还原能力。
1.2.5.4 DPPH自由基清除能力的测定 参照Yamaguchi等[19]的方法,略做改动。精确配制1×10-4mol/L的DPPH乙醇溶液,于0~4 ℃避光保存,备用。分别取待测溶液2 mL与DPPH溶液2 mL均匀混合,在黑暗中放置一定时间,于517 nm波长处分别在30 min测定光密度值,空白组以无水乙醇取代DPPH,对照以无水乙醇取代样品。清除率的计算方法如下:
式中:I表示DPPH自由基清除率,Ai为样品组吸光度,Aj为空白组吸光度,Ac为对照组吸光度。
1.2.5.5 羟自由基清除能力的测定 采用邻二氮菲-Fe2+氧化法进行测定[20]。
1.2.5.6 超氧阴离子自由基清除能力的测定 采用邻苯三酚自氧化法进行测定[21]。
1.3 数据处理
使用SPSS 19.0统计软件进行分析,采用ANOVA进行邓肯氏多重差异分析,采用多元线性回归分析方法进行相关性分析。p<0.05为具有统计学意义上的差异。
2 结果与分析
2.1 提取方式对黑木耳多糖和类黄酮提取率及抗氧化活性的影响
黑木耳多糖和类黄酮在隔氧条件下的提取率及抗氧化活性均高于有氧条件(见表1)。在隔氧条件下,多糖的提取率为3.85%,黑木耳类黄酮的提取率为4.2 mg/100 g;显著高于有氧方式获得的多糖和类黄酮提取率(p<0.05)。密闭隔氧提取的黑木耳类黄酮和多糖清除DPPH自由基、羟自由基、超氧阴离子自由基能力的能力以及还原能力均高于有氧提取类黄酮和多糖(p<0.05)。

表1 隔氧和有氧提取对黑木耳多糖、类黄酮提取率及抗氧化活性对比(n=3)Table 1 Comparison of the content and antioxidant activity of polysaccharides and flavonoids from Auricularia auricula by aerobic extraction and oxygen-resistant extraction(n=3)
由此可见,隔氧方式提取黑木耳中多糖和类黄酮,在氧含量较低的条件下,避免了二者的氧化降解,使其含量保持较高水平,进而抗氧化活性效果更为突出[22]。
2.2 黑木耳多糖和黑木耳类黄酮协同抗氧化研究
为了筛选出黑木耳多糖和黑木耳类黄酮复配液协同清除自由基效果,实验选择一种以氮为中心的自由基DPPH自由基,一种活性氧自由基羟自由基,用两种自由基清除效果来综合评价黑木耳多糖和黑木耳类黄酮复配液协同抗氧化作用。
2.2.1 黑木耳多糖和黑木耳类黄酮复配比例对清除DPPH自由基能力的影响 由图1可见,初始0 min,不同配比黑木耳多糖(浓度为3 mg/mL)和黑木耳类黄酮(浓度为3 mg/mL)复配液之间对DPPH自由基清除能力差异不显著(p>0.05)。30 min时,随着多糖体积的增加,类黄酮体积的减少,复配液对DPPH自由基清除能力依次分别增加了30.3%、41.6%、44.5%、47.5%和54.3%,可见随着多糖含量的增加,复配液清除DPPH自由基能力逐渐增强。复配液配比多糖:类黄酮为9∶1和7∶3时,DPPH自由基清除率较大,分别为100%和95%,二者之间差异显著(p<0.05)。
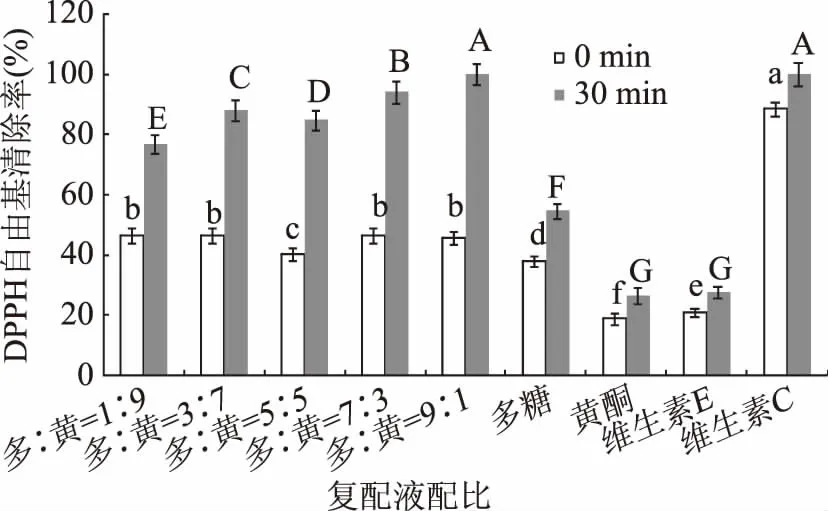
图1 黑木耳多糖和黑木耳类黄酮复配后对DPPH自由基的清除能力Fig.1 DPPH radicals scavenging ability of complex with polysaccharides and flavonoids from Auricularia auricular注:不同小写字母表示反应初期0 min不同复配物清除DPPH自由基能力差异显著(p<0.05);不同大写字母表示反应30 min不同复配物清除DPPH自由基能力差异显著(p<0.05)。
由图2可见,不同配比复配液之间对羟自由基清除能力差异显著(p<0.05),当黑木耳多糖∶黑木耳类黄酮=7∶3时,羟自由基清除率最大,为62%。复配液中多糖碳氢链上的氢原子与羟自由基结合成水,而碳原子上剩下的单电子可继续氧化形成过氧自由基,进一步分解,阻止活性氧等新自由基形成,阻断连锁自由基扩增途径,从而达到抗氧化效果[23]。综合复配液对DPPH自由基、羟自由基清除能力的影响,确定黑木耳多糖∶黑木耳类黄酮=7∶3为最佳配比。

图2 黑木耳多糖和黑木耳类黄酮复配后对羟自由基的清除能力Fig.2 Hydroxyl radicals scavenging ability of complex with polysaccharides and flavonoids from Auricularia auricular注:不同小写字母表示差异显著(p<0.05)。
2.2.2 黑木耳多糖和类黄酮复配抗氧化实验
2.2.2.1 不同浓度复配液的抗氧化能力 由图3、图4可见,随着复配液浓度的增加,复配液对DPPH自由基清除能力和羟自由基清除能力逐渐增加。复配液对DPPH自由基清除能力在0 min和30 min时差异显著(p<0.05),反应30 min复配液浓度为0.72×10-3mg/mL时,清除率最高为88.65%。复配液浓度为0.432×10-3mg/mL以后,对DPPH自由基清除率维持稳定,差异不显著(p>0.05)。

图3 复配液浓度对DPPH自由基清除能力的影响Fig.3 Effect of complex concentration on DPPH radical scavenging ability
由图4可见,当复配液浓度为3.6×10-3mg/mL时,对羟自由基的清除率达55.6%,随着复配液浓度的增大,羟自由基的清除能力逐渐增强,复配液浓度在三个范围区间(1.2~2.4×10-3mg/mL,3.6~4.8×10-3mg/mL,6.0×10-3mg/mL)差异显著(p<0.05)。

图4 复配液浓度对羟自由基清除能力的影响Fig.4 Effect of complex concentration on hydroxyl radical scavenging ability
2.2.2.2 降温过程中复配液抗氧化能力的变化 图5为降温过程复配液的DPPH自由基清除能力变化曲线。60 ℃条件下反应20 min时,复配液对DPPH自由基清除能力最强,之后随时间延长趋于稳定。温度下降至40 ℃和50 ℃反应40 min后,复配液的DPPH自由基清除能力达到最高,分别为78.9%、80.6%。温度下降至30 ℃,复配液对DPPH自由基清除率最低,与其他温度相比差异显著(p<0.05)。

图5 不同温度下复配液清除DPPH自由基的能力Fig.5 DPPH radical scavenging ability of complex at different temperature
由图6可见,随着反应温度的降低,复配液对羟自由基清除能力呈下降趋势,各温度之间羟自由基清除率差异显著(p<0.05),在60 ℃时,羟自由基清除率为91.6%,30 ℃时清除率为21.4%。

图6 不同温度下复配液清除羟自由基的能力Fig.6 Hydroxyl radical scavenging ability of complex at different temperature
2.2.2.3 不同反应时间对复配液抗氧化能力的影响 由图7可见,复配液对DPPH自由基清除能力随反应时间的增加而增强,在10~60 min内DPPH自由基清除率变化幅度较小,但与初始0 min相比DPPH自由基清除率差异显著(p<0.05)。复配液浓度与DPPH自由基的清除能力呈显著正相关(p<0.05)。在反应60 min时,0.02×10-3mg/mL、0.1×10-3mg/mL、0.3×10-3mg/mL浓度的复配液对DPPH自由基的清除率达到最大,分别为53.9%、71.6%、86.5%。

图7 不同反应时间下复配液清除DPPH自由基能力Fig.7 DPPH radical scavenging ability of complex in different reaction time
由图8可见,随着反应时间的延长,复配液对羟自由基的清除能力呈先上升后下降的趋势。当反应时间为75 min时,清除率上升至最高,为98.9%;在反应90 min和120 min时,羟自由基的清除率维持稳定,差异不显著(p>0.05),与其他时间处理相比差异显著(p<0.05)。

图8 不同反应时间下复配液清除羟自由基能力Fig.8 Hydroxyl radical scavenging ability of complex in different reaction time
3 结论
与有氧提取相比,隔氧提取获得的黑木耳多糖、黑木耳类黄酮含量较高,分别为3.85%、4.2 mg/100 g;同时清除DPPH自由基、羟自由基、超氧阴离子自由基能力,还原能力较强。
黑木耳多糖和黑木耳类黄酮复配比例为7∶3时,清除DPPH自由基能力为95%,清除羟自由基能力为62%。随着黑木耳多糖和黑木耳类黄酮复配液浓度增加,对DPPH自由基和羟自由基清除能力增大;降温过程中,40 ℃和50 ℃反应40 min后,对DPPH自由基和羟自由基清除能力达到最大,二者差异不显著(p>0.05)。0.3×10-3mg/mL浓度的复配液对DPPH自由基的清除率在60 min时达到最大,为86.5%,75 min时,复配液对羟自由基清除率上升至最高,为98.9%。
综上,经过隔氧条件提取得到的黑木耳多糖和类黄酮,其提取率及抗氧化活性均高于有氧条件提取物;黑木耳多糖和类黄酮复配品可提高对DPPH自由基和羟自由基清除效率,具有协同抗氧化作用。
[1]Luo Y C,Chen G,Li B,et al. Evaluation of antioxidative and hypolipidemic properties of a novel functional diet formulation ofAuriculariaauriculaand Hawthorn[J]. Innovative Food Science & Emerging Technologies,2009,10(2):215-221.
[2]Soomro A H,Feng X,Sauer M B,et al. Characterization ofAuriculariaauriculapolysaccharides and its antioxidant properties in fresh and pickled product[J]. International Journal of Biological Macromolecules,2015,81(11):387-395.
[3]Zhang H,Wang Z Y,Yang L,et al.Invitroantioxidant activities of sulfated derivatives of polysaccharides extracted fromAuriculariaauricular[J]. International Journal of Molecular Sciences,2011,12(5):3202-3287.
[4]Feyza O,Belma A. Protective effect of two edible mushrooms against oxidative cell damage and their phenolic composition[J]. Food Chemistry,2011,128(3):613-619.
[5]Zhao S,Rong C B,Liu Y,et al. Extraction of a soluble polysaccharide fromAuriculariapolytrichaand evaluation of its anti-hypercholesterolemic effect in rats[J]. Carbohydrate Polymers,2015,122(2):39-45.
[6]Zhang H,Wang Z Y,Zhang Z,et al. PurifiedAuriculariaauricular-judae polysaccharide(AAP I-a)prevents oxidative stress in an ageing mouse model[J]. Carbohydrate Polymers,2011,84(1):638-648.
[7]厉荣玉,钱森和,董群,等. 地木耳总黄酮提取及抑菌作用[J]. 皖南医学院学报,2012,31(3):186-190.
[8]张威. 地木耳天然活性物质的筛选及活性研究[D].兰州:兰州大学,2007.
[9]Zeng W C,Zhang Z,Gao H,et al. Characterization of antioxidant polysaccharides fromAuriculariaauricularusing microwave-assisted extraction[J]. Carbohydrate Polymers,2012,89(2):694-700.
[10]王鹏,郭丽,周凤超,等. 低温长时加热制备黑木耳提取液的性质研究[J]. 食品工业,2014,35(1):171-173.
[11]Suphaphit B,Wanwimol K,Pongtep W. Antioxidant activities of extracts from five edible mushrooms using different extractants[J]. Agriculture and Natural Resources,2016,50(2):89-97.
[12]缪钱江,刘宇,许峰,等. 4种食用菌总黄酮生物功能的研究[J]. 食品科技,2014,39(7):206-209.
[13]李超,王磊,任遥,等. 黑木耳多糖的微波提取及含量的测定[J]. 食品工业,2012,33(8):128-131.
[14]Peng X B,Li Q,Ou L N,et al. GC-MS,FT-IR analysis ofblack fungus polysaccharides and its inhibition against skin aging in mice[J]. International Journal of Biological Macromolecules,2010,47(2):304-307.
[15]Fan L S,Zhang S,Yu L,et al. Evaluation of antioxidant property and quality of breads containingAuriculariaauricularpolysacchar ide flour[J]. Food Chemistry,2007,101(3):1158-1163.
[16]中国国家标准化管理委员会. GB/T 15672-2009食用菌中总糖含量的测定[S]. 北京:中国标准出版社,2009.
[17]Chun O K,Kim D O,Lee C Y. Superoxide radical scavenging activity of the major polyphenols in fresh plums[J]. Journal of Agricultural and Food Chemistry,2003,51(27):8067-8072.
[18]Lee S C,Jeong S M,Kim S Y. Effect of far-infrared radiation and heat treatment on the antioxidant activity of water extracts from peanut hulls[J]. Food Chemistry,2006,94(4):489-493.
[19]Yamaguchi T,Takamura H,Matoba T,et al. HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J]. Bioscience Biotechnology Biochemistry,1998,62(6):1201-1204.
[20]Sun X,Sun Y,Zhang Q,et al. Screening and comparison of antioxidant activities of polysaccharides from Coriolus versicolor[J]. International Journal of Biological Macromolecules,2014,69:12-19.
[21]Wu P P,Ma G Z,Li N H,et al. Investigation ofinvitroandinvivoantioxidant activities of flavonoids rich extract from the berries ofRhodomyrtustomentosa(Ait.)Hassk[J]. Food Chemistry,2015,173:194-202.
[22]杨柳,许舜军. 大黄蒽醌类成分在提取过程中的量变规律[J]. 中国医院药学杂志,2007,27(7):908-910.
[23]张华. 黑木耳中性多糖片段硫酸酯对辐射诱导氧化应激防护作用[D]. 哈尔滨:哈尔滨工业大学,2013.
