CXCL10与CXCL12基因多态性与肺结核易感性的关系
2018-04-26邢志伟高艳军张建武张珣孙红梅
邢志伟,高艳军,张建武△,张珣,孙红梅
肺结核是经过空气传播的慢性传染病,主要由结核分枝杆菌感染引起,全世界每年约900万的肺结核新发病例,其中大约有140万人死亡[1-2]。我国的结核病疫情仍然处于较高水平[3],控制形势依然严峻。机体对结核分枝杆菌的免疫防御主要是细胞介导的免疫应答,其中趋化因子发挥了多种生物学功能。最近研究表明,趋化因子作为一种早期炎症介质起着重要作用,它决定了宿主接触病原体后的免疫反应[4]。趋化因子CXCL10与CXCL12可以趋化炎症细胞,诱导多种细胞释放炎症因子,起到促进细胞凋亡及抗病毒、抗肿瘤等作用。趋化因子基因的编码区或非编码区存在基因多态性,这些基因的多态性可能改变趋化因子的表达水平、稳定性以及与受体之间的相互作用。因此,趋化因子基因的多态性与疾病进展的程度有关。实际上感染结核分枝杆菌的人群中约90%没有临床症状。有研究表明肺结核感染存在宿主的遗传差异,个体遗传基因多态性与肺结核的易感性有关[5]。本文选取趋化因子CXCL10与CXCL12的基因单核苷酸多态性(single nucleo-tide polymorphism,SNP)位点进行研究,探讨CXCL10-135G/A和CXCL12-801G/A基因多态性与肺结核易感的相关性。
1 对象与方法
1.1 研究对象 收集2016年10月—2017年3月在我院结核内科住院的102例初治肺结核痰涂片阳性患者作为病例组,其中男 59 例,女 43例,年龄 19~60岁,平均(38.2±11.7)岁。肺结核诊断参照中华人民共和国卫生行业标准(WS288-2008),以病原学或组织病理学证实为主,辅助检查结核菌素试验(PPD)阳性,结合典型的临床表现和影像学证据,进行综合分析作出诊断。收集同期来自我院体检中心的115例健康体检者为对照组,其中男68例,女47例,年龄24~61 岁,平均(39.1±10.3)岁。所有研究对象均为汉族,均无合并糖尿病、肿瘤、自身免疫性疾病及其他慢性感染性疾病,如病毒性肝炎、人类免疫缺陷病毒(HIV)感染等。2组人群年龄(t=0.600)、性别(χ2=0.037)差异无统计学意义,具有可比性。本研究所收集的标本均经医院伦理委员会批准,患者及志愿者均签署知情同意书。
1.2 主要试剂与仪器 基因组DNA提取试剂盒购自北京赛百盛基因技术有限公司。引物购自英潍捷基(上海)贸易有限公司。限制性内切酶BstBⅠ和MspⅠ购自宝生物工程(大连)有限公司。Taq PCR Master Mix体系购自宝生物工程(大连)有限公司。PCR扩增仪(LightCycler 480Ⅱ,Roche公司)。凝胶图像处理系统(Tanon-1600,上海天能科技有限公司)。电泳仪(DYY-6C,北京市六一仪器厂)。Nanodrop核酸分析仪[ND2000,赛默飞世尔科技(中国)有限公司]。
1.3 方法
1.3.1 基因组DNA的抽提 抽取患者及体检者空腹静脉血2 mL,置于含乙二胺四乙酸(EDTA)真空管抗凝,使用全血基因组DNA提取试剂盒,操作步骤按说明书进行。4℃冰箱保存提取的DNA,备用。
1.3.2 DNA浓度的测定 取DNA样品2µL,于Nanodrop核酸分析仪检测DNA浓度以及260 nm和280 nm处光密度(OD)值,测定浓度均为 40 g/L以上,OD260/OD280在 1.7~1.9样品即为合格DNA。
1.3.3 PCR反应检测目的基因 体系包括1µL DNA模板,2µL 10×PCR缓冲液(含Mg2+),0.3µL TaqDNA聚合酶(5 U/µL),0.5 µL dNTP(10 mmol/L),上、下游引物各 0.5 µL(10 mmol/L),用灭菌双蒸水补齐,体系总共20µL。CXCL10-135G/A 引物:上游 5′-CCGTTCATGTTTTGGAAAGTGA-3′,下 游 5′-GGGAAGTCCCATGTTGCAGATT-3′。 CXCL12-801G/A 引物:上游 5′-CAGTCAACCTGGGCAAAGCC-3′,下游 5′-AGCTTTGGTCCTGAGAGTCC-3′。PCR扩增条件:95℃预变性 5 min;95℃变性30 s,60℃退火45 s,72℃延伸45 s,35个循环;最后72℃延伸10 min。
1.3.4 PCR产物的酶切反应及电泳 对目的基因PCR扩增后的产物进行酶切反应,体系包括10µL PCR产物,各0.5µL限制性内切酶,2µL 10×buffer缓冲液,7.0µL灭菌去离子水,总体系20µL。混匀放37℃水浴12 h,取酶切产物10µL上样于适量溴化乙锭染色的2%琼脂糖凝胶中,在1×Tris-硼酸-EDTA(TBE)电泳缓冲液中,80 V恒压电泳约40 min,最后在自动凝胶成像系统上观察扩增条带及酶切结果并记录。进行成像分析后准确判断酶切产物大小。
1.4 统计学方法 采用SPSS 22.0软件进行数据处理。所得数据计量资料以均数±标准差(±s)表示,组间比较进行2独立样本t检验;基因型及基因频率以率表示,组间比较采用χ2检验。Hardy-Weinberg平衡定律检验各组样本代表性。P<0.05为差异有统计学意义。
2 结果
2.1 基因型的遗传平衡分析 结果显示,2组CXCL10-135G/A和CXCL12-801G/A位点基因型符合 Hardy-Weinberg平衡定律(P>0.05),病例组和对照组样本均具有群体代表性,见表1。

Tab.1 The distribution of genotypes in two groups表1 2组基因型分布情况 观察值(理论值)
2.2 PCR-RFLP分析
2.2.1 CXCL10-135G/A及CXCL12-801G/A的PCR扩增产物酶切片段分析 PCR产物经酶切电泳后,CXCL10-135G/A SNP位点GG基因型显示为123 bp一条片段,AA基因型显示为100 bp一条片段,GA基因型显示为123 bp和100 bp两条片段,见图1。CXCL12-801G/A SNP位点GG基因型显示为202 bp和100 bp两条片段,AA基因型显示为302 bp一条片段,GA基因型显示为302 bp、202 bp和100 bp三条片段,见图2。
2.2.2 CXCL10和CXCL12基因型及等位基因分析 CXCL10-135G/A多态性基因型及等位基因的分布频率在病例组及对照组中差异均有统计学意义(均P<0.05),病例组G等位基因的分布频率高于对照组,A等位基因的分布频率低于对照组,见表2。CXCL12-801G/A多态性基因型及等位基因在分布频率在病例组及对照组中差异均无统计学意义(均P>0.05),见表 3。
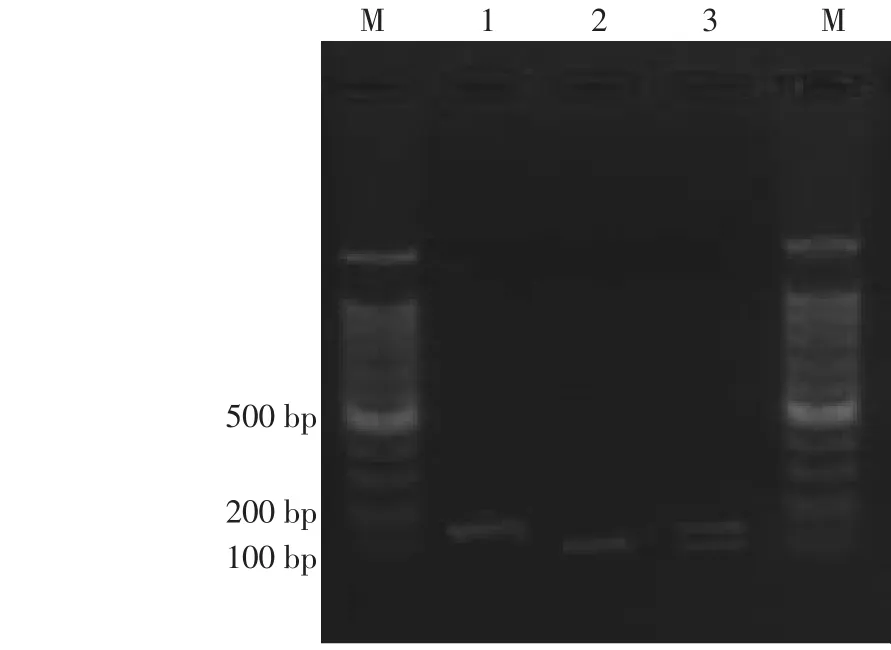
Fig.1 Enzyme digestion results of PCR product of CXCL10-135 gene图1 CXCL10-135基因的PCR产物酶切结果
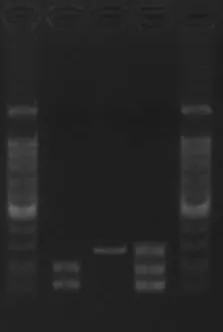
Fig.2 Enzyme digestion results of PCR product of CXCL12-801 gene图2 CXCL12-801基因的PCR产物酶切结果
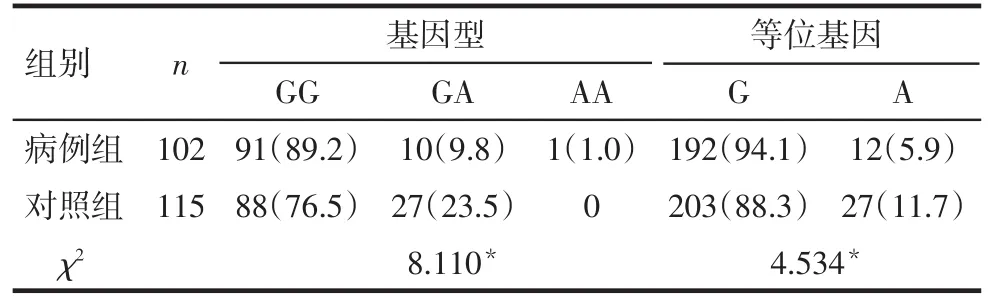
Tab.2 Distribution of genotype frequency and allele frequency of CXCL10-135G/A表2 CXCL10-135G/A基因型频率及等位基因频率分布例(%)
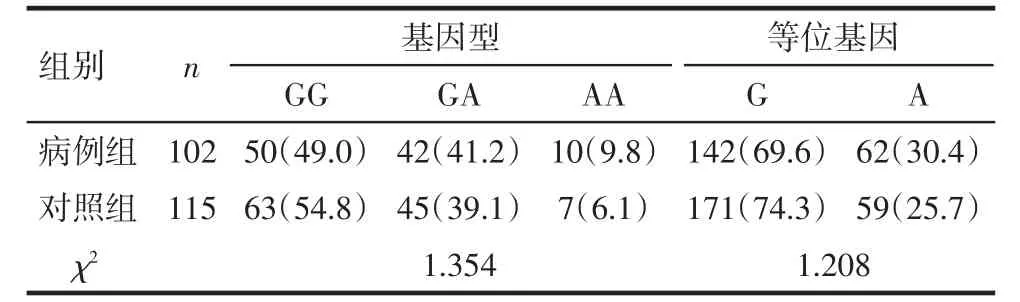
Tab.3 Distribution of genotype frequency and allele frequency of CXCL12-801G/A表3 CXCL12-801G/A基因型频率及等位基因频率分布例(%)
3 讨论
3.1 宿主对结核分枝杆菌的免疫防御 结核分枝杆菌可能侵入人体全身各器官,但主要侵犯肺脏,称为肺结核病。结核分枝杆菌主要通过呼吸道进入肺泡,被中性粒细胞、上皮细胞、肺泡巨噬细胞和树突状细胞等吞噬[6],引起细胞介导的免疫反应。上述这些靶细胞可启动趋化因子和细胞因子等级联反应。趋化因子是一类结构和功能相似的小分子细胞因子,可以特异性结合靶细胞表面受体,通过G蛋白把信号传入胞内,经过下游信号分子转导,从而激活靶细胞,趋化单核巨噬细胞及淋巴细胞等到达炎症或感染部位,最终发挥调节细胞运输和黏附等多种生物学作用。结核病发病的宿主遗传因素和趋化因子的作用密切相关,趋化因子基因多态性在治疗反应、基因调控和疾病转归中发挥重要作用[7]。
3.2 趋化因子CXCL10与肺结核易感的相关性 趋化因子可以分为 4个亚族——C、CC、CXC和CX3C。CXCL10即γ干扰素(IFN-γ)诱导蛋白10(IP-10),属于CXC类的趋化因子,由IFN-γ诱导产生,其生物学功能包括募集中性粒细胞,促进多种细胞因子分泌,参与感染性疾病如结核病、病毒性肝炎及恶性肿瘤等发病。有资料表明CXCL10参与结核免疫,用结核分枝杆菌特异性抗原肽刺激外周血单个核细胞,细胞培养液上清中IP-10的水平比血浆明显增加,并且肺结核组显著高于潜伏感染组和常见肺病组[8]。还有研究显示IP-10可能成为活动性肺结核与潜伏性结核的鉴别诊断指标[9]。CXCL10基因在病毒性肝炎的免疫反应及呼吸道病原体的固有免疫应答中起着重要作用[10-11]。CXCL10基因启动子区存在多态性位点,可以调节基因靶位点与核内蛋白的亲和力,影响核因子(NF)-κB表达的转录激活作用,最终调控该基因的表达及趋化因子的表达水平[12]。本研究采用PCR-RFLP技术研究趋化因子CXCL10-135G/A位点SNP与肺结核易感相关性,结果发现病例组与对照组GG、GA和AA三种基因型分布频率以及G、A等位基因分布频率分布差异均有统计学意义,因此,CXCL10启动子区的-135G/A多态性位点可能是影响肺结核发病易感性的基因位点,这与Tang等[13]的研究结果一致。
3.3 趋化因子CXCL12与肺结核易感的相关性 CXCL12属于CXC类趋化因子,又称基质细胞衍生因子(stromal cell-derived factor,SDF),具有多种生物学功能,可以促进血管生成、调节免疫炎症反应及淋巴细胞分化发育等[14-15]。有研究发现胸腔积液中CXCL12水平升高,可能是诊断结核性胸膜炎的标志物[16]。CXCL12是一种作用于前B细胞的刺激因子,最初在小鼠骨髓基质细胞分泌的细胞因子中被发现。CXCL12-801G/A是人群遗传变异中较常见的一个多态性位点,指CXCL12的基因3′非翻译区(UTR)第 801位碱基发生 G→A的突变。CXCL12-G801A基因突变位于编码CXCL12β转录子高度保守的片段,可以通过改变基因的转录水平及蛋白的表达而影响CXCL12的表达,该基因G801A位点的多态性与其他疾病的关系已有报道,如HIV感染及移植排斥反应等[17-18],但与肺结核病易感的研究报道较少。本研究应用PCR-RFLP分析趋化因子CXCL12801G/A位点SNP与结核病易感相关性,结果显示CXCL12-801G/A基因位点三种基因型分别为GG、GA和AA,2组基因型及等位基因频率分布差异均无统计学意义,推测CXCL12-801G/A基因位点多态性与肺结核的易感性可能无关。
综上,在机体控制结核分枝杆菌的感染免疫中,趋化因子的基因多态性参与细胞免疫应答的过程,笔者采用PCR-RFLP技术证实了趋化因子CXCL10-135G/A基因多态性与肺结核发病可能相关。本实验病例组和对照组标本均来自于我院,由于肺结核的发病不仅有宿主的遗传因素,还有个体差异、地域、环境因素等影响,这是本研究的局限之处。因此进一步寻找肺结核病遗传易感性基因,进行多位点及多因素结合分析,对于结核病的防治和早期诊断具有重要的临床应用价值。
[1]Diel R,Loddenkemper R,Nienhaus A.Predictive value of interferon-γ release assays and tuberculin skin testing for progression from latent TB infection to disease state:a meta-analysis[J].Chest,2012,142(1):63-75.doi:10.1378/chest.11-3157.
[2]Monin L,Khader SA.Chemokines in tuberculosis:The good,the bad and the ugly[J].Semin Immunol,2014,26(6):552-558.doi:10.1016/j.smim.2014.09.004.
[3]李亮,唐神结,杜建,等.结核病防控年度回顾及展望(2016年)[J].中华结核和呼吸杂志,2017,40(1):11-15.Li L,Tang SJ,Du J,et al.Annual review and prospect of tuberculosis prevention and control(2016)[J].Chin J Tubere Respir Dis,2017,40(1):11-15.doi:10.3760/cma.j.issn.1001-0939.2017.01.004.
[4]Stone MJ,Hayward JA,Huang C,et al.Mechanisms of regulation of the chemokine-receptor network[J].Int J Mol Sci,2017,18(2).pii:E342.doi:10.3390/ijms18020342.
[5]Meyer CG,Thye T.Host genetic studies in adult pulmonary tuberculosis[J].Semin Immunol,2014,26(6):445-453.doi:10.1016/j.smim.2014.09.005.
[6]Dorhoi A,Kaufmann SH.Versatile myeloid cell subsets contribute to tuberculosis-associated inflammation[J].Eur J Immunol,2015,45(8):2191-2202.doi:10.1002/eji.201545493.
[7]Qidwai T,Khan MY.Impact of genetic variations in C-C chemokine receptors and ligands on infectious diseases[J].Hum Immunol,2016,77(10):961-971.doi:10.1016/j.humimm.2016.06.010.
[8]潘燕玉,李津,程小星.肺结核患者特异性抗原反应性IP-10的表达特点[J].临床肺科杂志,2013,18(1):103-104.Pan YY,Li J,Cheng XX.Expression features of IP-10 stimulated by specific antigen in patients with pulmonary tuberculosis[J].Journal of Clinical Pulmonary Medicine,2013,18(1):103-104.doi:10.3969/j.issn.1009-6663.2013.01.055.
[9]Jeong YH,Hur YG,Lee H,et al.Discrimination between active and latent tuberculosis based on ratio of antigen-specific to mitogen-induced IP-10 production[J].J Clin Microbiol,2015,53(2):504-510.doi:10.1128/JCM.02758-14.
[10]Xu Z,Liu Y,Liu L,et al.Association of interferon-gamma induced protein 10 promoter polymorphisms with the disease progression of hepatitis B virus infection in Chinese Han population[J].PLoS One,2013,8(9):e72799.doi:10.1371/journal.pone.0072799.
[11]Tang NL,Chan PK,Wong CK,et al.Early enhanced expression of interferon-inducible protein-10(CXCL-10)and other chemokines predict adverse outcome in severe acute respiratory syndrome[J].Clin Chem,2005,51(12):2333-2340.
[12]Huang J,Xu N,Pan J.A SNP in the porcine chemokine(C-X-C motif)ligand 10 gene is associated with blood hemoglobin concentration[J].Anim Genet,2016,47(1):134-135.doi:10.1111/age.12345.
[13]Tang NL,Fan HP,Chang KC,et al.Genetic association between a chemokines gene CXCL-10(IP-10,interferon gamma inducible protein 10)and susceptibility to tuberculosis[J].Clin Chim Acta,2009,406(1/2):98-102.doi:10.1016/j.cca.2009.06.006.
[14]Badr HS,El-Gendy FM,Helwa MA.Serumstromal-derived-factor-1(CXCL12)and its alpha chemokine receptor(CXCR4)as biomarkers in neonatal sepsis[J].J Matern Fetal Neonatal Med,2017,14:1-7.doi:10.1080/14767058.2017.1336760.
[15]Chodari L,Mohammadi M,Ghorbanzadeh V,et al.Testosterone and voluntary exercise promote angiogenesis in hearts of rats with diabetes by enhancing expression of VEGF-A and SDF-1a[J].Can J Diabetes,2016,40(5):436-441.doi:10.1016/j.jcjd.2016.03.004.
[16]Kohmo S,Kijima T,Mori M,et al.CXCL12 as a biological marker for the diagnosis of tuberculous pleurisy[J].Tuberculosis(Edinb),2012,92(3):248-252.doi:10.1016/j.tube.2012.01.001.
[17]Ammaranond P,Sanguansitthianan S,Phaengchomduan P,et al.Impact of CCR2 and SDF1 polymorphisms on disease progression in HIV-infected subjects in Thailand[J].J Clin Lab Anal,2013,27(1):38-44.doi:10.1002/jcla.21559.
[18]Bogunia-Kubik K,Gieryng A,Dlubek D,et al.The CXCL12-3'A allele is associated with a higher mobilization yield of CD34 progenitors to the peripheral blood of healthy donors for allogeneic transplantation[J].Bone Marrow Transplant,2009,44(5):273-278.doi:10.1038/bmt.2009.30.
