利用NSCLC 患者ROSE 细胞学制片进行EGFR、KRAS、PIK3CA 基因检测可行性的研究
2018-04-26胥京京冯靖曹洁
胥京京,冯靖,曹洁
目前,肺癌的发病率和病死率居于所有恶性肿瘤之首[1-3]。由于肺癌早期症状隐匿,约70%患者确诊时已处于疾病晚期,大多数已经错失了外科手术机会[4-5]。晚期肺癌患者 5年生存率仅为17.7%[6]。近年来,靶向药物的出现为晚期非小细胞肺癌(NSCLC)患者提供了一种新的治疗手段,而肿瘤细胞基因突变的检测结果也成为了指导晚期NSCLC患者个体化治疗的重要依据[7]。目前大多数国内外机构主要利用NSCLC患者组织学标本进行基因突变检测,但在一些特殊情况下,例如钳夹病灶时大量出血不能继续取材,因而无法取到足够的组织标本、经支气管镜针吸活检(TBNA)获取的组织标本量小,现有的组织学标本仅够用于病理诊断而无法继续进行基因检测,因此积极探索NSCLC可替代标本进行基因检测具有重要的临床意义。本研究旨在探讨应用气管镜取材过程中现场制做的快速现场评价(ROSE)细胞学制片(ROSE细胞学标本)作为基因检测替代标本,利用xTAG70plex液相芯片技术对其进行表皮生长因子受体(EGFR)、KRAS和PIK3CA基因突变检测是否具有可行性。
1 对象与方法
1.1 对象 连续纳入2016年6月—2017年6月就诊于天津医科大学总医院行支气管镜检查并经最终病理诊断为NSCLC的患者,严格按照纳入标准和排除标准,共收集75例组织学标本和ROSE细胞学制片配对的病例,男33例,女42例,平均年龄(58.84±11.01)岁。其中49例标本来自肺原发病灶的肺活检(TBLB),5例来自黏膜活检(EBB),21例来自纵隔淋巴结穿刺活检(TBNA)。组织学病理根据WHO 2015分类,分为61例腺癌,14例鳞状细胞癌;TNM分期:Ⅲa期12例,Ⅲb期24例,Ⅳ期39例。本研究已获得医院伦理委员会批准。纳入标准:(1)经气管镜行TBLB、EBB或者TBNA获得组织学标本者。(2)组织学标本经病理诊断为NSCLC。(3)每例患者术中均制作了ROSE细胞学制片。(4)告知患者研究事项并签署知情同意书。排除标准:(1)病理学诊断为小细胞肺癌或组织学病理诊断分类不清者。(2)有严重心、肺、脑等疾病不能耐受手术者。(3)凝血功能严重障碍者。(4)未制作ROSE细胞学制片者。
1.2 主要试剂与设备 迪夫快速细胞染色液A、B液(珠海贝索生物技术有限公司);活检钳(JHY-FB-18-105-O-OA1,常州市久虹医疗器械有限公司);王氏组织穿刺针(MW-319,美国ConMed公司);常规支气管镜(外径5.5 mm,BFF260)、超细支气管镜(外径 4 mm,BF-P-260F)、虚拟支气管镜导航软件(DirectPath V1.02,Cybernet Systems)、内镜超声系统(MAJ-935)、外部直径为1.4 mm的20 MHz腔内超声探头(UM-S20-17S)和引导鞘套装(K201/K203)、显微镜(CX31)、解剖显微镜(SZX7)均购自奥林巴斯公司;基因组DNA抽提试剂盒(NucleoSpin Blood,吉泰生物);液相芯片试剂盒购自益善生物技术股份有限公司;液相基因芯片系统购自美国Luminex公司。
1.3 方法
1.3.1 获取组织学标本 患者术前禁食水6 h,确保术前7 d内没有使用抗凝血药物,给予2%利多卡因5 mL雾化吸入20 min,患者取仰卧位,经鼻导管给氧,检测血压、心率和血氧饱和度。气管镜经鼻腔进入主支气管,根据每位患者病灶部位、淋巴结的转移情况,依据ROSE的诊断性介入肺脏病学标准取材技术以及常规 TBNA技术[8-9],选择性地采用TBLB、EBB、TBNA获取组织学标本,在保证患者安全的情况下,尽可能多地取得组织学标本,获取的组织学标本分别送病理学检查及装于EP管中置于-80℃冰箱保存。
1.3.2 ROSE细胞学制片 依据ROSE的临床实施指南[10],用2.5 mL的一次性注射器针头将仅有的极少的组织粒从活检钳钳杯中挑起,或从组织针尖端推出,在无菌细胞学专用玻片染色端自内向外涂出厚薄均匀、直径约1 cm的圆形,空气中晾干后将涂片依次放入迪夫快速细胞学染色液A、B液中完成ROSE染色,1名经验丰富的细胞学医师立即于显微镜下观察细胞成分、形态及细胞背景、挑拣并确保送检的ROSE细胞学制片上具有足够的肿瘤细胞进行基因检测,在ROSE细胞学制片上当肿瘤细胞数量大于总细胞数量的50%判断为肿瘤细胞数量足够用于EGFR、KRAS和PIK3CA基因检测。ROSE细胞学制片在常温干燥的环境下即可保存。每位患者至少制作出2张ROSE细胞学制片。
1.3.3 DNA提取 在解剖显微镜下将ROSE细胞学制片上蓝色深染的肿瘤细胞用手术刀片刮下,分离出肿瘤细胞;DNA提取按照DNA抽提试剂盒说明书操作,经过裂解、消化、纯化后,把上面装有絮状DNA无水乙醇溶液的离心管离心5 min,离心速率13 000 r/min。弃去上层液,留下DNA沉淀。吸取950µL 70%乙醇至上面有DNA沉淀的离心管中,轻轻翻转2次,120 r/min离心5 min,弃去上层液。离心管放置数分钟,使管内乙醇蒸发干净。吸取30~100µL保存液到上面附着DNA的离心管中(保存液的量根据组织大小而定),轻轻拍打,使附在管壁上的DNA弥散到保存液中,先置于室温10 min,加速DNA溶解,再4℃保存。
1.3.4 EGFR、KRAS和PIK3CA基因突变检测 xTAG70plex液相芯片检测EGFR、KRAS和PIK3CA基因突变操作按照益善基因突变检测试剂盒说明书检测。主要包括以下5个步骤:(1)多重PCR获得各基因外显子上含有常见等位基因型的基因片段。(2)核酸外切酶酶切及碱性磷酸酶(EXOSAP)水解,去除多余的引物和dNTP。(3)等位基因特异性引物延伸(allele specific primer extension,ASPE)反应。(4)ASPE引物上的Tag序列与聚苯乙烯微球上的Anti-Tag序列特异结合,即杂交反应。(5)杂交后的微球通过Luminex 200多功能流式点阵仪分析,读取每个样品的中位荧光值。以组织学标本检测所得结果为金标准。在这75例患者中,由于PIK3CA检出率过低(1/75,1.3%),无法进行相关比较,笔者仅对EGFR和KRAS进行相关比较。
1.4 统计学方法 应用SPSS 21.0软件进行分析,计数资料采用χ2检验,以P<0.05为差异有统计学意义。计算ROSE细胞学标本配对组织学标本基因突变敏感度、特异度、一致率。
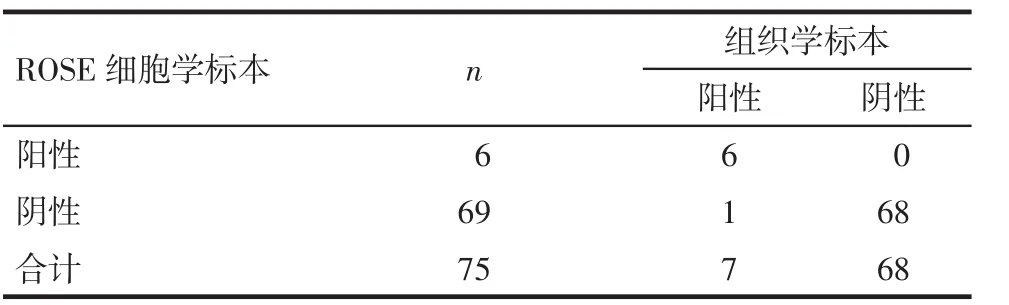
Tab.1 The comparision of KRAS mutation results between ROSE cytology group and histology group表1 组织学标本与ROSE细胞学标本KRAS基因突变比较 (例)
2 结果
2.1 ROSE镜下表现 典型的肺腺癌在光学显微镜下表现为癌细胞嗜碱呈蓝色深染,体积较大,呈圆形或类圆形,密集成团分布,呈桑葚样排列,胞浆丰富,可有空泡,呈高分泌样,见图1。典型的肺鳞状细胞癌在光学显微镜下表现为癌细胞形状不规则、大小不一、呈多角形,胞浆角化,部分少浆、裸核,细胞核大小不规则,畸形明显,见图2。肺鳞癌ROSE细胞学制片坏死背景明显,可见红细胞、炎细胞、坏死细胞残片,如有感染可见中性粒细胞。
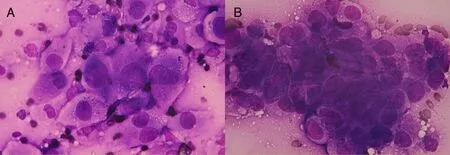
Fig.1 Pictures showing typical adenocarcinoma from ROSE cytological slides图1 典型肺腺癌ROSE细胞学制片在光学显微镜下表现
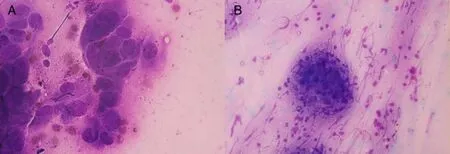
Fig.2 Pictures showing typical spuamous cell carcinoma from ROSE cytological slides图2 典型肺鳞状细胞癌ROSE细胞学制片在光学显微镜下表现
2.2 组织学标本与配对ROSE细胞学标本基因突变一致性分析 75例患者中36例在组织学标本和配对ROSE细胞学标本中同时检测出了相同的EGFR突变类型:23例 L858R突变,11例E746_A7501缺失,1例 L861Q突变,1例L747_P735突变,EGFR突变检出一致率为100%。6例在组织学标本配对ROSE细胞学标本中同时检测出了相同的KRAS突变类型:4例G12V突变,2例G12C突变;1例在组织学标本中检测出KRAS突变(G12V突变),而在配对的ROSE细胞学标本中没有检测出KRAS突变,ROSE细胞学敏感度85.7%,特异度100%,一致率98.7%,见表1;1例在组织学标本配对ROSE细胞学标本中同时检测出了相同的PIK3CA突变类型(E545K突变)。
2.3 ROSE细胞学标本EGFR基因突变与临床特征的关系 在组织学标本配对ROSE细胞学标本中同时检测出了相同的EGFR突变类型的36例中,EGFR基因突变高发于女性、非吸烟者和肺腺癌者(均P<0.05),见表 2。
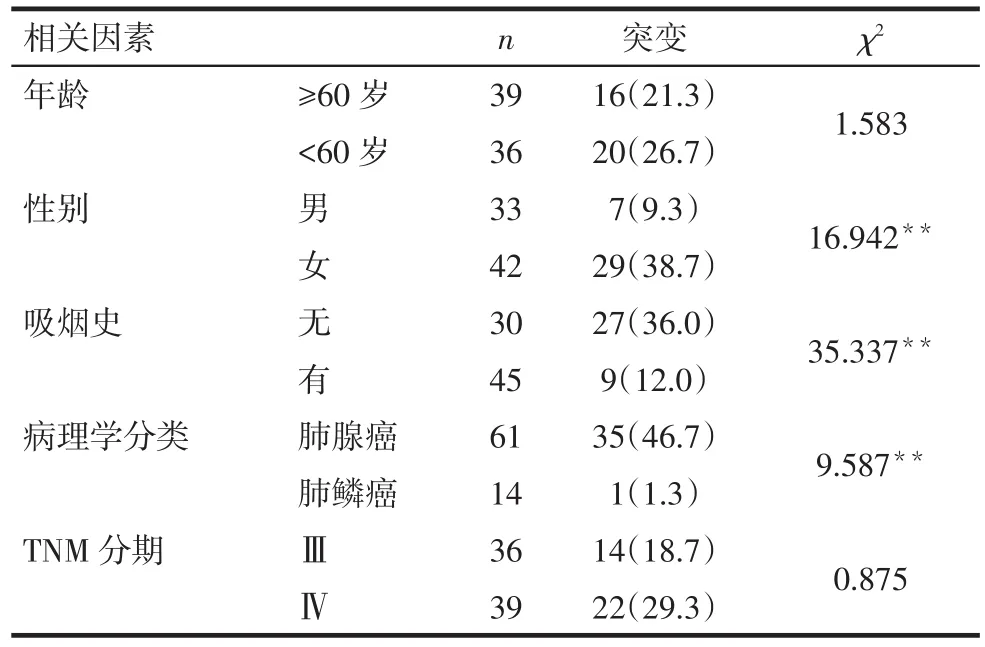
Tab.2 EGFR mutation and clinical characteristics in ROSE cytology group表2ROSE细胞学标本EGFR基因突变与临床特征的关系例(%)
3 讨论
随着基因检测技术的不断发展,细胞学标本的获取对于肺癌患者具有越来越重要的意义,因为细胞学标本获取简单、创伤小,特别是对已经失去手术机会的晚期肺癌患者,获取肿瘤组织的细胞学标本可以避免外科手术风险、减轻患者痛苦。已有学者对细胞学标本比如肺泡灌洗液、胸水、外周血、针吸细胞悬液等进行基因突变检测的报道[11-16],但少有将ROSE细胞学制片作为细胞学标本应用于基因检测的报道。在诊断性介入肺脏病学操作中,ROSE细胞学制片具有制作简单、制作所需时间短、易于保存、保存时间久等优点,但其最主要的优点是可以联合快速现场评价技术提供标本细胞分类和细胞数量的实时反馈。本实验创新性地应用NSCLC患者行气管镜检查时现场制作的ROSE细胞学制片作为细胞学标本进行EGFR、KRAS和PIK3CA基因突变检测,对比配对的组织学标本基因检测的结果,探究ROSE细胞学制片作为细胞学标本进行EGFR、KRAS和PIK3CA基因突变检测的可行性。
本研究中,有1例组织学标本检测出KRAS基因突变而在ROSE细胞学标本中没有检出,笔者推测这1例ROSE细胞学制片基因突变检测结果假阴性可能为ROSE细胞学制片上肿瘤细胞数量不足、刮取下来的肿瘤细胞中混杂有正常细胞(比如炎症细胞、类上皮细胞)导致。
常规的基因检测方法如直接测序法、扩增阻滞突变系统(ARMS)、聚合酶链反应-单链构象多态性(PCR-SSCP)等技术由于敏感度不足等问题在细胞学标本检测基因突变应用中受限,对于细胞数量确实很少的细胞学标本,可以使用敏感性更高的检测方法,本实验采用的xTAG70plex液相芯片技术有检测样本多样性、所需样本量少、敏感性高、特异性强、检测速度快及检测方便等优势[17],但xTAG70plex液相芯片技术对于细胞学标本中肿瘤细胞的数量尚无统一要求。Bozzetti等[18]指出当使用直接测序法检测基因突变时,吉姆萨染色制片上肿瘤细胞数量>50%总细胞数量(即相当于至少300个肿瘤细胞,DNA产量范围为30~140 ng)判断为细胞数量足够用于 EGFR、KRAS 基因检测。Jain 等[12]发现在DNA提取过程中将蛋白酶K孵育时间延长至2 h可以提高DNA产量。目前关于细胞学标本基因突变检测肿瘤细胞数量标准的文献较少。为了避免分子检测假阴性结果,应取得尽可能多的肿瘤细胞。这就需要支气管镜操作者对肿瘤的准确定位,除了支气管镜下直接可见的肿物外,还需要联合采用支气管内超声引导(EBUS)、磁导航、电子虚拟导航或者超声探头等辅助方法以帮助操作者准确到达病灶取材,以取到尽可能多的肿瘤组织。另外,制作出高质量的ROSE细胞学制片以保留尽可能多的肿瘤细胞也很重要,比如涂片应厚薄均匀以减少细胞重叠、涂片经空气晾干后应尽快放入染缸中染色以防止细胞溶解、及时更换染液以达到良好的染色效果等,而且良好的制片也有助于细胞病理学家对制片的判读以指导气管镜准确取材。
另外ROSE细胞学制片可以“一片两用”,在一些特殊的情况下,患者行气管镜检查取材时,钳夹或穿刺病灶时大量出血或其他特殊情况不能继续取材(例如出血风险极高、存在气胸风险、患者极度不配合要求终止操作等)而无法取到足够的组织标本用于病理学诊断和基因检测时,获取的少量组织学标本可以用于制作ROSE细胞学制片,继而送检细胞病理学诊断,用于诊断的ROSE细胞学制片在细胞病理学诊断后可以尝试继续用于基因检测,患者不仅可以避免再次行活检取材的风险,也能尽快得到疾病的诊断和及时的治疗。
多项研究发现,NSCLC患者EGFR基因突变高发于女性、非吸烟、肺腺癌患者,且这类NSCLC患者对靶向药物吉非替尼反应较好[12,16,19],本实验同样发现在ROSE细胞学标本中,EGFR基因突变在女性、肺腺癌和非吸烟者中检出率较高。
xTAG70plex液相芯片技术可以有效地检测ROSE细胞学标本EGFR、KRAS和PIK3CA的基因突变状态,xTAG70plex液相芯片技术检测ROSE细胞学标本和配对的组织学标本基因突变结果高度一致。因此,对于NSCLC患者,ROSE细胞学制片可以作为组织学替代标本进行基因检测,并且此方法特别适用于没有多余组织学标本进行基因检测的晚期NSCLC患者,具有较高的临床价值。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.doi:10.3322/caac.21262.
[2]Zhou C.Lung cancer molecular epidemiology in China:recent trends[J].Transl Lung Cancer Res,2014,3(5):270-279.doi:10.3978/j.issn.2218-6751.2014.09.01.
[3]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.doi:10.3322/caac.21332.
[4]Novello S,Barlesi F,Califano R,et al.Metastatic non-small cell lung cancer:ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2016,27(suppl 5):v1-v27.doi:10.1093/annonc/mdw326.
[5]Miller KD,Siegel RL,Lin CC,et al.Cancer treatment and survivorship statistics,2016[J].CA Cancer J Clin 2016,66(4):271-289.doi:10.3322/caac.21349.
[6]Ettinger DS,Wood DE,Aisner DL,et al.Non-small cell lung cancer,Version 5.2017,NNCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2017,15(4):504-535.doi:10.6004/jnccn.2017.0050.
[7]Dacic S.Molecular diagnostics of lung carcinomas[J].Arch Pathol Lab Med,2011,135(5):622-629.doi:10.1043/2010-0625-RAIR.1.
[8]冯靖,周国武,李雯,等.基于快速现场评价的诊断性介入肺脏病学标准取材技术[J].天津医药,2017,45(6):638-642.Feng J,Zhou GW,Li W,et al.The standard operating techniques for diagnostic interventional pulmonology based on rapid on-site evaluation[J].Tianjin Med J,2017,45(6):638-642.doi:10.11958/20170514.
[9]冯靖,李彩丽,曹洁.基于快速现场评价的常规经支气管针吸活检技术[J].天津医药,2017,45(11):1218-1221.Feng J,Li CL,Cao J.Conventional transbronchial needle aspiration technique guided by rapid on-site evaluation[J].Tianjin Med J,2017,45(11):1218-1221.doi:10.11958/20170911.
[10]国家卫计委海峡两岸医药卫生交流协会呼吸病学专业委员会,中华医学会结核病学分会呼吸内镜专业委员会,中国医师协会儿科学分会内镜专业委员会(筹),等.诊断性介入肺脏病学快速现场评价临床实施指南[J].天津医药,2017,45(4):441-448.Cross-Straits Medical Exchange Association,Chinese Medical Association,Chinese Medical Doctor Association,et al.Clinical guidance for diagnostic interventional pulmonary rapid on-site evaluation[J].Tianjin Med J,2017,45(4):441-448.doi:10.11958/20170320.
[11]Bozzetti C,Negri FV,Azzoni C,et al.Epidermal growth factor receptor(EGFR) and KRAS gene expression:reliability of mutational analysis on cytological samples[J].Diagn Cytopathol,2013,41(7):595-598.doi:10.1002/dc.22905.
[12]Jain D,Ramachandrappa VS,Singh V,et al.Use of exfoliative specimens and fine-needle aspiration smears for mutation testing in lung adenocarcinoma[J].Acta Cytol,2017,61(6):455-461.doi:10.1159/000479217.
[13]Billah S,Stewart J,Staerkel G,et al.EGFR and KRAS mutations in lung carcinoma:molecular testing by using cytology specimens[J].Cancer Cytopathol,2011,119(2):111-117.doi:10.1002/cncy.20151.
[14]Lee SE,Lee SY,Park HK,et al.Detection of EGFR and KRAS mutation by pyrosequencing analysis in cytologic samples of nonsmall cell lung cancer[J].J Korean Med Sci,2016,31(8):1224-1230.doi:10.3346/jkms.2016.31.8.1224.
[15]Allegrini S,Antona J,Mezzapelle R,et al.Epidermal growth factor receptor gene analysis with a highly sensitive molecular assay in routine cytologic specimens of lung adenocarcinoma[J].Am J Clin Pathol,2012,138(3):377-381.doi:10.1309/AJCPVAGIUC1AHC3Y.
[16]Wang S,Yu B,Ng CC,et al.The suitability of small biopsy and cytology specimens for EGFR and other mutation testing in nonsmall cell lung cancer[J].Transl Lung Cancer Res,2015,4(2):119-125.doi:10.3978/j.issn.2218-6751.2015.01.05.
[17]Li G,Luo X,He J,et al.A novel liquidchip platform for simultaneous detection of 70 alleles of DNA somatic mutations on EGFR,KRAS,BRAF and PIK3CA from formalin-fixed and paraffin-embedded slides containing tumor tissue[J].Clin Chem Lab Med,2011,49(2):191-195.doi:10.1515/CCLM.2011.040.
[18]Bozzetti C,Naldi N,Nizzoli R,et al.Reliability of EGFR and KRAS mutation analysis on fine-needle aspiration washing in nonsmall cell lung cancer[J].Lung Cancer,2013,80(1):35-38.doi:10.1016/j.lungcan.2013.01.007.
[19]王敬慧,张宗德,张树才.肺腺癌驱动基因研究相关进展[J].中国肺癌杂志,2013,16(2):91-96.Wang JH,Zhang ZD,Zhang SC.Advances on driver oncogenes of lung adenocarcinoma[J].Chin J Lung Cancer,2013,16(2):91-96.doi:10.3779/j.issn.1009-3419.2013.02.06.
