慢病毒介导的PRL-3 shRNA 对结肠癌细胞增殖、侵袭、凋亡的影响
2018-04-26王燕张姣王会峰王宁菊
王燕,张姣,王会峰,王宁菊
结直肠癌是世界范围内常见的消化道恶性肿瘤之一,中国国家癌症登记中心调查发现结直肠癌发病率居我国恶性肿瘤的第4位,死亡率居第5位[1]。目前已证实肝再生磷酸酶-3(PRL-3)在结肠癌中高表达[2],且PRL-3能启动结肠癌肿瘤细胞的增殖和侵袭[3],但是确切的分子机制尚需要进一步研究。本课题组前期研究证实靶向PRL-3基因的shRNA慢病毒载体可以明显抑制结肠癌SW480细胞的PRL-3基因表达水平,后续功能实验均选择PRL-3 shRNA进行。本研究利用已构建的慢病毒载体感染SW480细胞,进一步探讨PRL-3基因沉默后对人结直肠癌SW480细胞增殖、侵袭和凋亡的影响。
1 材料与方法
1.1 主要试剂与仪器 人结直肠癌SW480为宁夏医科大学总医院医学实验中心保存,RPMI 1640培养基、胎牛血清(Ausbian公司),TRIzol(上海普飞公司)、MTT试剂(Genview公司);DMSO(上海试一化学试剂有限公司);SYBR Master Mixture试剂盒(TaKaRa公司),D-Hanks、PRL-3 shRNA、阴性对照的慢病毒颗粒(上海吉凯基因技术有限公司);酶标仪(Tecan infinite);DMEM、侵袭试剂盒及 Transwell试剂盒(Corning公司),胰酶(上海化学试剂公司),细胞凋亡检测试剂盒 Annexin V-FITC(eBioscience公司),GIEMSA染色液(Sigma公司)。Real time PCR仪(Agilent公司),荧光显微镜(奥林巴斯),离心机(赛默飞世尔科技中国有限公司),倒置显微镜(上海蔡康光学仪器有限公司),CO2培养箱(SANYO),生物安全柜(上海振梓创电气净化设备有限公司),流式细胞仪(Millipore公司)。
1.2 方法
1.2.1 细胞培养 SW480细胞在含有10%胎牛血清的RPMI 1640培养液,37℃恒温,5%CO2条件下持续培养,所有的实验要求细胞的生长状态为对数生长期。
1.2.2 慢病毒PRL-3 shRNA转染SW480细胞株 SW480细胞接种于12孔板中,4×104个/孔,当每孔细胞密度大约20%时,分别加入慢病毒PRL-3 shRNA、阴性对照的慢病毒颗粒,进行SW480细胞的转染,16 h更换培养基,72 h后荧光显微镜下观察绿色荧光蛋白(GFP)表达效率。实验分组:空白对照组(细胞不作处理)、阴性对照组(阴性对照病毒组)、转染组(转染慢病毒PRL-3 shRNA组)。
1.2.3 Real-time PCR检测转染后SW480细胞中PRL-3 mRNA表达 收集各个实验组对数生长期的细胞,TRIzol法提取总RNA,逆转录试剂盒逆转录成cDNA,实时荧光定量PCR检测细胞内PRL-3 mRNA表达水平,内参为GAPDH。反应条件:95℃预变性 30 s;95℃ 5 s,60℃退火 30 s,45个循环。引物序列:PRL-3上游引物 5′-GATGGCATCACCGTTGTGGA-3′,下 游 引 物 5′-CGTACTTCATCCCGCTCTCAAT-3′,扩 增 片 段 199 bp;GADPH 上游引物 5′-TGACTTCAACAGCGACACCCA-3′,下游引物 5′-CACCCTGTTGCTGTAGCCAAA-3′,扩增片段121 bp;由上海吉凯基因生物公司合成。采用2-ΔΔCt法进行相对定量分析,实验重复3次。
1.2.4 平板克隆形成实验 PRL-3 shRNA、阴性对照的慢病毒颗粒转染SW480细胞后第5天种板,持续培养5 d,每3 d换液1次。按400个细胞/孔分别接种到6孔板中,使细胞分散均匀。分空白对照组、阴性对照组、转染组,继续培养1周,直到可见克隆生长时,按照GIEMSA染色法进行染色,镜检计数。实验重复3次。
1.2.5 流式细胞术检测PRL-3 shRNA转染对SW480细胞凋亡的影响 PRL-3 shRNA转染SW480细胞后第3天传代,第5天检测,细胞融合度达85%以上,收集各组细胞各1.0×105个,PBS洗3次,上流式细胞仪单染法检测细胞凋亡率变化。实验重复3次。
1.2.6 MTT法检测PRL-3 shRNA对细胞增殖的影响 收集各个实验组细胞,待每组细胞生长状态良好后,接种96孔板,密度为1×104个/孔,设重复孔,按照MTT试剂操作方法进行,用酶联免疫标记分析仪测其光密度(OD)值,连续5 d。重复3次。
1.2.7 Transwell小室法检测PRL-3 shRNA对SW480细胞迁移能力的影响 收集空白对照组、阴性对照组、转染组(PRL-3 shRNA转染SW480细胞后72 h)细胞,调整细胞密度至1.0×105个,弃培养基并加入100µL细胞悬液,下室内加入600µL 30%FBS的培养基。37℃培养箱培养34 h后,用GIEMSA染色液进行染色,镜检计数穿膜的细胞数,每个样本随机计数5个视野,取平均值,实验重复3次。
1.2.8 侵袭小室法检测PRL-3 shRNA对SW480细胞侵袭能力的影响 收集空白对照组、阴性对照组、转染组(PRL-3 shRNA转染SW480细胞后72 h)细胞,调整细胞密度至1.0×105个,实验前将上、下小室各加500µL无血清培养基,使Matrigel基质层再水化。水化后上室加入500µL细胞悬液,下室内750µL 30%胎牛血清培养基,37℃培养箱培养34 h后,用湿棉拭子轻轻移去小室内未转移细胞,GIEMSA染色,倒置显微镜下计数,观察侵袭Matrigel基质层后的细胞数,实验重复3次。
1.3 统计学方法 采用SPSS 18.0软件进行分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒PRL-3 shRNA转染SW480细胞建立稳定转染细胞系 将PRL-3 shRNA和阴性对照组的慢病毒颗粒转染至人结肠癌细胞株SW480并培养72 h后,于荧光显微镜下观察转染效果,可见GFP表达的细胞比例达80%以上,慢病毒PRL-3 shRNA成功转染SW480细胞并稳定表达,后续实验可以进行,见图1。
2.2 PRL-3 shRNA转染结肠癌SW480细胞后mRNA表达水平 将PRL-3 shRNA和阴性对照的慢病毒颗粒转染SW480细胞72 h后,细胞生长良好,real-time PCR结果显示:转染组PRL-3 mRNA相对表达水平低于空白对照组、阴性对照组,差异有统计学意义(P<0.05),转染组PRL-3基因敲减效率达到89.6%。空白对照组和阴性对照组比较差异无统计学意义,见表1。
2.3 平板克隆形成实验结果 转染组细胞克隆形成数量较空白对照组、阴性对照组明显减少(P<0.05),而空白对照组与阴性对照组比较差异无统计学意义,见表1。
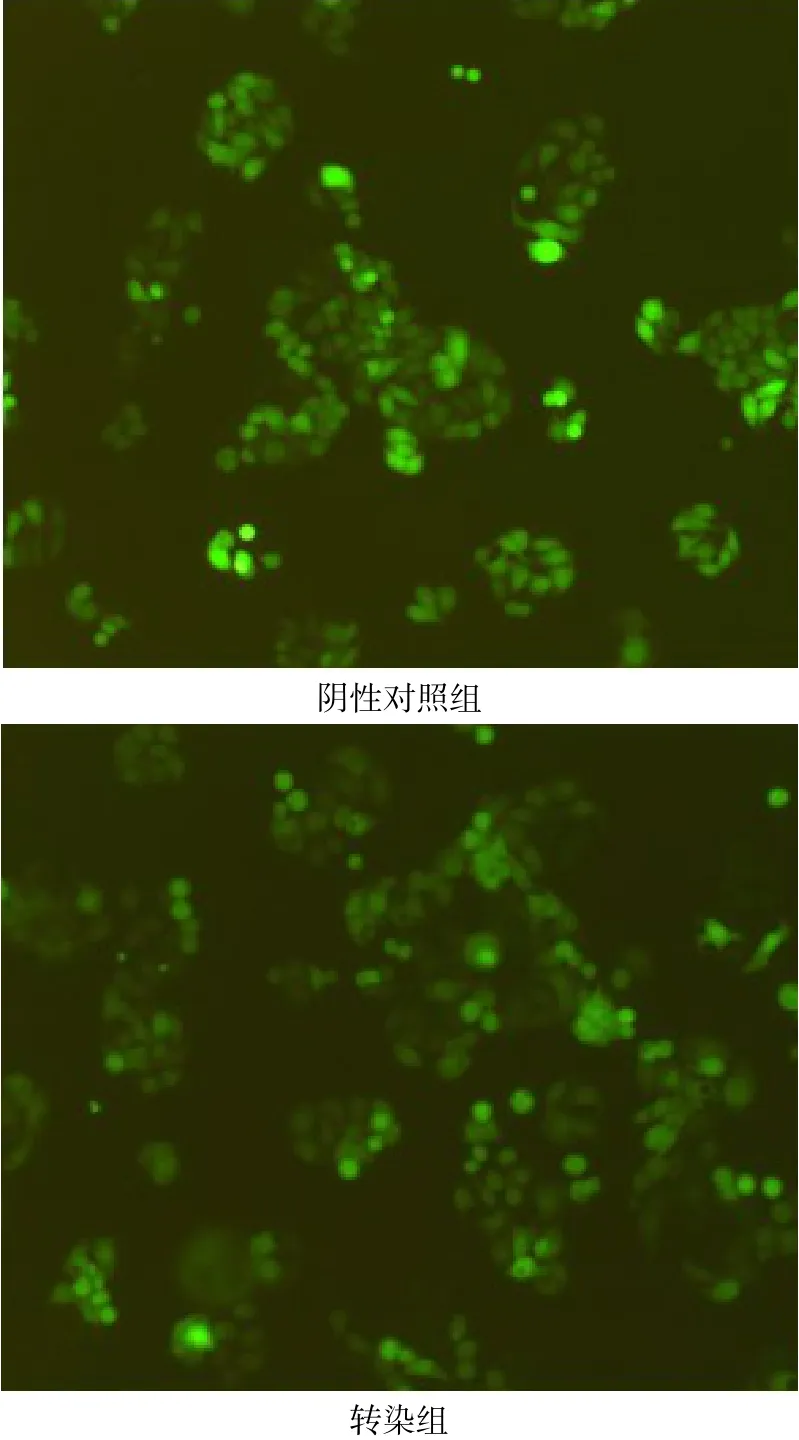
Fig.1 The expression of green fluorescent protein in SW480 cells infected with lentivirus PRL-3 shRNA图1 慢病毒PRL-3 shRNA感染SW480细胞后GFP的表达(×100)
Tab.1 Changes of relative expression of PRL-3 mRNA,colony formation and the apoptosis rate of SW480 cells after transfection表1 转染后SW480细胞PRL-3 mRNA、克隆形成、凋亡的变化 (n=3,±s)
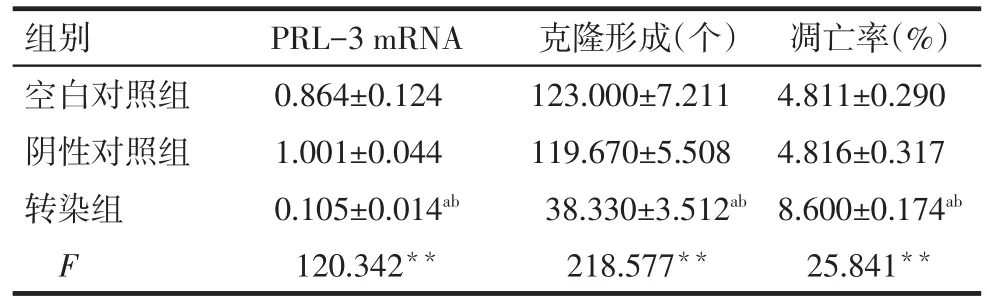
Tab.1 Changes of relative expression of PRL-3 mRNA,colony formation and the apoptosis rate of SW480 cells after transfection表1 转染后SW480细胞PRL-3 mRNA、克隆形成、凋亡的变化 (n=3,±s)
**P<0.01;a与空白对照组比较,b与阴性对照组比较,P<0.05
组别空白对照组阴性对照组转染组F PRL-3 mRNA 0.864±0.124 1.001±0.044 0.105±0.014ab 120.342**克隆形成(个)123.000±7.211 119.670±5.508 38.330±3.512ab 218.577**凋亡率(%)4.811±0.290 4.816±0.317 8.600±0.174ab 25.841**
Tab.2 The MTT result of proliferation of SW480 cells after transfected PRL-3-shRNA表2MTT法检测转染PRL-3-shRNA后SW480细胞增殖能力的影响 (n=3,OD值,±s)

Tab.2 The MTT result of proliferation of SW480 cells after transfected PRL-3-shRNA表2MTT法检测转染PRL-3-shRNA后SW480细胞增殖能力的影响 (n=3,OD值,±s)
**P<0.01;a与空白对照组比较,b与阴性对照组比较,P<0.05
组别空白对照组阴性对照组转染组F 24 h 0.157±0.004 0.149±0.003 0.153±0.002 4.483 48 h 0.388±0.025 0.369±0.006 0.353±0.005 3.985 72 h 0.737±0.012 0.638±0.027 0.378±0.011ab 40.597**96 h 1.197±0.021 0.948±0.044 0.471±0.001ab 525.360**120 h 1.865±0.039 1.492±0.019 0.671±0.029ab 1 260.359**
2.4 PRL-3 shRNA转染后SW480细胞凋亡率的变化 转染组细胞凋亡率与空白对照组、阴性对照组比较均显著增高(P<0.05),而空白对照组与阴性对照组比较差异无统计学意义,见表1。
2.5 转染PRL-3 shRNA后SW480细胞增殖能力的变化 转染组感染24、48 h后与空白对照组及阴性对照组比较,细胞增殖能力差异无统计学意义,转染72 h后,转染组与空白对照组及阴性对照组比较,细胞增殖能力明显受到抑制(P<0.05),转染120 h抑制更为显著,见表2。
2.6 转染PRL-3-shRNA后SW480细胞迁移和侵袭力变化 转染组细胞迁移和侵袭力较空白对照组、阴性对照组比较均显著下降(P<0.05),而空白对照组与阴性对照组迁移和侵袭力相比差异无统计学意义,见图2、表3。
3 讨论
PRLs是近年来发现的癌基因家族。PRLs家族成员包括 PRL-1、2、3,PRL-1、2 能使细胞向肿瘤细胞方向转化。PRL-3参与多种肿瘤的发生与发展,在结直肠癌[2]、非小细胞肺癌[4]、卵巢癌[5]、前列腺癌[6]和乳腺癌[7]中表达上调,在肿瘤细胞的增殖、黏附、迁徙及转移中发挥了重要的正向调控作用。抑制PRL-3的表达会减弱三阴性乳腺癌细胞迁移及侵袭能力[7]。刘楠等[8]发现下调高转移潜能的肺癌A549细胞中PRL-3的表达水平后,A549细胞的迁移、侵袭能力明显降低,但增殖能力没有明显变化,提示PRL-3在肺癌中发挥的作用可能与在其他类型的肿瘤不同。PRL-3在肿瘤增殖、侵袭和转移的多个环节中发挥重要作用,而对结肠癌细胞是否有影响需要进一步研究。
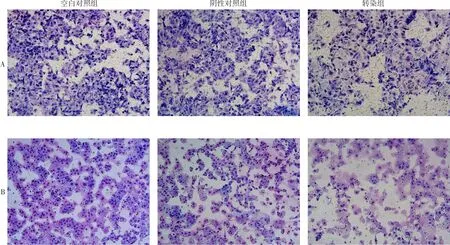
Fig.2 Migration and invasion of SW480 cells after transfection detected by Transwell assay and invasion assay(×100)图2 Transwell小室和侵袭小室法检测转染后SW480细胞迁移和侵袭力变化(×100)
Tab.3 Changes of migration and invasion of SW480 cells after transfection表3 转染后SW480细胞迁移及侵袭力的变化(n=3,个,±s)

Tab.3 Changes of migration and invasion of SW480 cells after transfection表3 转染后SW480细胞迁移及侵袭力的变化(n=3,个,±s)
**P<0.01;a与空白对照组比较,b与阴性对照组比较,P<0.05
组别空白对照组阴性对照组转染组F细胞迁移116.670±3.215 112.000±1.732 73.670±5.508ab 114.740**细胞侵袭65.000±3.000 66.330±0.577 38.670±6.110ab 46.950**
慢病毒载体广泛应用于稳定的转基因过表达、制备不同种类的转基因动物、持续的基因沉默等方面,具有不良反应低、转染效率高的优势。本研究利用已构建的慢病毒载体转染结肠癌SW480细胞,real-time PCR结果显示该慢病毒载体对SW480细胞中PRL-3基因的敲减效率达到89.6%,该重组慢病毒载体能够有效地抑制SW480细胞中PRL-3基因的表达,建立稳定转染的细胞株,这也证实了慢病毒介导的基因沉默技术转染效率高,是基因治疗的重要工具。本研究显示下调PRL-3的表达水平使SW480细胞存活率明显受到抑制,说明通过沉默PRL-3基因表达,可以抑制结肠癌SW480细胞的增殖。本研究转染组细胞凋亡率明显高于空白对照组及阴性对照组,与卵巢癌[5]、前列腺癌[6]中 PRL-3 的研究结果一致:PRL-3促进卵巢癌、前列腺癌细胞的生长和迁移,沉默PRL-3抑制肿瘤细胞的生长。
浸润和转移是恶性肿瘤最重要的特征。现有的研究显示PRL-3促进肿瘤细胞侵袭转移的机制主要有以下几个方面:(1)PRL-3可能通过改变RhoA、RhoC活性及其下游因子影响肺癌细胞的迁移和侵袭[4,8]。(2)上皮间质转化(EMT)是肿瘤浸润和转移的关键步骤。PRL-3可能通过EMT途径影响结肠癌细胞的侵袭。Lai等[3]发现PRL-3诱导KCNN4表达,导致EMT和E-钙黏蛋白下调,促进肿瘤转移。(3)张建龙等[9]发现 PRL-3 通过上调miRNA-21抑制PTEN表达,调节PI3K通路,从而促进结肠癌细胞的远处转移。(4)Gari等[7]用特异性抑制剂AMPI-109降低PRL-3表达水平后,三阴性乳腺癌细胞的侵袭迁移能力明显降低;PRL-3过表达通过上调基质金属蛋白酶(MMP)-10促进三阴性乳腺癌细胞的侵袭。以上研究显示PRL-3参与多水平调控及信号通路,在肿瘤发生、发展中有重要作用,PRL-3在肺癌、乳腺癌和结肠癌等肿瘤中的作用机制不同,可能与肿瘤的异质性有关。本研究结果显示:与空白对照组及阴性对照组相比,转染组穿越Matrigel胶的细胞数明显减少,提示下调PRL-3后,可以减弱结肠癌细胞的侵袭转移能力。
本研究表明,PRL-3在调控结肠癌增殖、侵袭、凋亡过程中起着重要作用,PRL-3可能作为结肠癌患者早期诊断、治疗选择的分子标志物。本课题不足之处在于未对PRL-3调控结肠癌致病机制进行深入研究。后续研究重点将关注PRL-3可能通过影响哪些下游靶基因的表达影响结肠癌侵袭、转移及其可能的分子机制,以期为结肠癌的靶向治疗提供更多依据。
[1]陈万青,郑荣寿,张思维,等.2013年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2017,26(1):1-7.Cheng WQ,Zheng RS,Zhang SW,et al.Report of cancer incidence and mortality in China,2013[J].China Oncology,2017,26(1):1-7.doi:10.11735/j.issn.1004-0242.2017.01.A001.
[2]Kim NW,Chu CW,Ahn TS,et al.Correlation between liver metastases and the level of PRL-3 mRNA expression in patients with primary colorectal cancer[J].J Korean Soc Coloproctol,2011,27(5):231-236.doi:10.3393/jksc.2011.27.5.231.
[3]Lai W,Liu L,Zeng Y,et al.KCNN4 channels participate in the EMT induced by PRL-3 in colorectal cancer[J]. Med Oncol,2013,30(2):566-574.
[4]张平,张志培,李香敏,等.非小细胞肺癌中PRL-3与RHOc的表达及相关性意义[J].中国肺癌杂志,2010,13(6):598-601.Zhang P,Zhang ZP,Li XM,et al.Expression and it’s relationship of PRL-3 and Rhoc in non-small cell lung cancer[J]. Chinese Journal of Lung Cancer,2010,13(6):598-601.doi:10.3779/j.issn.1009-3419.2010.06.006.
[5]Liu H,Al-aidaroos AQ,Wang H,et al.PRL-3 suppresses c-Fos and integrin alpha2 expression in ovarian cancer cells[J].BMC Cancer,2013,13:80.doi:10.1186/1471-2407-13-80.
[6]Vandsemb EN,Bertilsson H,Abdollahi P,et al.Phosphatase of regenerating liver 3(PRL-3)is overexpressed in human prostate cancer tissue and promotes growth and migration[J].J Transl Med,2016,14:71.doi:10.1186/s12967-016-0830-z..
[7]Gari HH,DeGala GD,Ray R,et al.PRL-3 engages the focal adhesion pathway in triple-negative breast cancer cells to alter actin structure and substrate adhesion properties critical for cell migration and invasion[J].Cancer Lett,2016,380(2):505-512.doi:10.1016/j.canlet.2016.07.017.
[8]刘楠,王力宁,姜奕,等.PRL-3对肺癌细胞迁移侵袭及RHOA活性调控的研究[J].中华临床医师杂志(电子版),2013,7(7):2995-3000.Liu N,Wang LN,Jiang Y,et al.Research of PRL-3 regulates cell migration,invasion and RhoA activity in lung cancer cell[J].Chin J Clinicians(Electronic Edition),2013,7(7):2995-3000.doi:10.3877/cma.j.issn.1674-0785.2013.07.103.
[9]张建龙,张萦斐,张育超,等.PRL-3调节PI3K信号通路在促进结肠癌细胞增殖、侵袭中的作用[J].中山大学学报(医学科学版),2013,34(1):16-21.Zhang JL,Zhang YF,Zhang YC,et al.PRL-3 promotes proliferation and invasion of colon cancer cells by modulating P13K signal pathway[J].J Sun Yat-sen Univ(Med Sci),2013,34(1):16-21.
