冷诱导RNA结合蛋白促进冷冻保存大鼠坐骨神经异体移植后神经再生的作用
2018-04-26李子健黄英如曾欢欢
李子健,黄英如,曾欢欢,汪 一,张 松
1.重庆医科大学中医药学院针灸骨伤教研室,重庆市400016;2.中医药防治代谢性疾病重庆市重点实验室,重庆市400016
自体神经移植是周围神经缺损修复的金标准,然而来源限制、造成新的失神经损伤等,限制了临床应用。同种异体神经移植物能为临床神经缺损修复提供不同大小的神经移植物,而周围神经低温保存使同种异体神经移植代替自体神经移植成为可能[1-2]。然而,组织细胞低温保存时的缺血、缺氧和低温环境不可避免对保存组织细胞造成损伤,导致保存后周围神经的施万细胞(Schwann's cells,SCs)失去活性甚至死亡,而SC是周围神经的主要结构和功能细胞,能分泌多种神经营养因子和黏附分子,对神经损伤后的轴突再生极为重要[3]。
冷诱导RNA结合蛋白(cold-inducible RNA binding protein,CIRP)是一种冷应激蛋白,在温和低温、紫外线、缺氧等应激条件下,CIRP被诱导表达[4-5],通过参与调控细胞生长、衰老、凋亡等发挥对细胞的保护作用[6]。本实验通过不同温度诱导CIRP表达,观察其对冷冻保存大鼠坐骨神经的保护作用,及同种异体移植后神经再生的影响,探讨CIRP提高大鼠周围神经冷冻保存效果的可能性。
1 材料与方法
1.1 实验动物
SPF级雄性Sprague-Dawley大鼠102只,体质量(200±20)g,购于重庆医科大学动物中心,动物生产许可证号SCXK(渝)2012-0001。12 h黑白交替,相对湿度65%~75%,室温22~24℃。根据《医学实验动物管理实施细则》的要求,所用动物实验研究均依照动物福利与伦理原则处理。
1.2 试剂与仪器
CIRP抗体:美国ABCAM公司。Bcl-2、Bax、神经生长因子(nerve growth factor,NGF)、神经胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)单克隆抗体、CD4抗体:美国SANTA CRUZ公司。GAPDH抗体:美国NOVUS公司。β-actin、二抗(山羊抗兔IgG二抗、山羊抗鼠IgG二抗):北京中杉金桥生物技术有限公司。胎牛血清(fetal bovine serum,FBS)、DMSO、0.25%胰酶、高糖型DMEM培养基:美国HYCLONE公司。双抗(青霉素-链霉素):上海碧云天生物技术有限公司。乙二醇:成都市科龙化工试剂厂。海藻糖:北京索莱宝科技有限公司。triton X-100:北京鼎国昌盛生物技术有限责任公司。Calcein-AM:日本东仁化学科技有限公司。碘化丙啶(propidium iodide,PI):上海前尘生物科技有限公司。大鼠白细胞介素(interleukin,IL)-6、干扰素(interferon,IFN)-γ ELISA试剂盒:上海沪尚生物科技有限公司。总RNA提取试剂盒、RR047A逆转录试剂盒:大连TaKaRa公司。BCA蛋白浓度测定试剂盒:上海碧云天生物技术有限公司。PCR引物:上海生工生物。
H-7500型透射电镜:日本HITACHI公司。TCS-SP2型激光扫描共聚焦显微镜:德国LEICA公司。BL-420F生物机能实验系统:成都泰盟。电泳仪、凝胶成像系统、RT-PCR扩增仪:美国BIO-RAD公司。BX51正置显微镜:日本OLYMPUS公司。低温高速离心机:德国SIGMA公司。
1.3 动物造模与分组
1.3.1 神经采集及预处理
将上述大鼠适应性喂养5 d后,10%水合氯醛4 ml/kg腹腔注射麻醉,截取双侧坐骨神经段15 mm,生理盐水冲洗,大鼠断颈处死。按照随机数字表法将176条坐骨神经置于含有10%FBS和1%双抗的DMEM预处理液中,于不同温度诱导处理24 h:4℃组(A组,n=44)、15℃组(B组,n=44)和32℃组(C,n=44),并设立新鲜神经组(D组,n=44)。
1.3.2 冷冻保存液配制、坐骨神经冷冻保存及复温
在DMEM溶液(含10%FBS、1%双抗、0.2 mol/L海藻糖)中分别加入5%DMSO和5%乙二醇、10%DMSO和10%乙二醇、20%DMSO和20%乙二醇,配制成含5%、10%、20%冷冻保护剂的冷冻保存液。
将上述4组大鼠坐骨神经浸入含5%、10%冷冻保护剂的冷冻保存液中室温静置各10 min,然后浸于含20%冷冻保护剂的冷冻保存液中,4℃放置30 min、-20℃放置1 h、-80℃放置1 h,最后将其转入液氮中保存4周。
保存后神经首先置于20%冷冻保护剂的冷冻保存液中37℃复温3 min;然后依次置于10%、5%冷冻保护剂的冷冻保存液中各10 min,最后置于含有10%FBS和1%双抗的DMEM溶液中。
1.3.3 移植术受体及分组
健康成年SPF级雄性Wistar大鼠91只,体质量(200±20)g,作为待实验大鼠。用上述保存后的4组坐骨神经修复对应Wistar大鼠(A′组、B′组、C′组和D′组)坐骨神经10 mm缺损,每组14只。设立Sprague-Dawley大鼠新鲜坐骨神经修复Wistar大鼠坐骨神经缺损作为新鲜同种异体移植对照组(E′组)。选取7只健康成年SPF级雄性Wistar大鼠,10%水合氯醛4 ml/kg腹腔注射麻醉,按照前文神经采集方法所获得的14根神经作为供体神经,将其移植于受体大鼠,作为F'组。
受体大鼠10%水合氯醛4 ml/kg腹腔麻醉,于右股后外侧纵行切口,沿肌间隙钝性分离,暴露、游离坐骨神经,距梨状肌下缘5 mm处整齐切除大鼠坐骨神经造成10 mm缺损;将供体神经修剪成10 mm长,6倍手术显微镜下,以9-0带线缝合针行神经外膜无张力间断缝合4~6针,逐层关闭切口。手术均由单人操作完成,术后大鼠均不做特殊处理。
1.4 检测指标
1.4.1 CIRP mRNA、蛋白表达
1.4.1.1 RT-PCR检测CIRP mRNA表达
使用TRIzol法提取上述预处理各组大鼠坐骨神经中总RNA。根据RR047A逆转录试剂盒说明书合成cDNA及在RT-PCR扩增仪扩增目的基因。使用GAPDH做内参校正,计算各组间相对表达量。基因引物序列见表1。
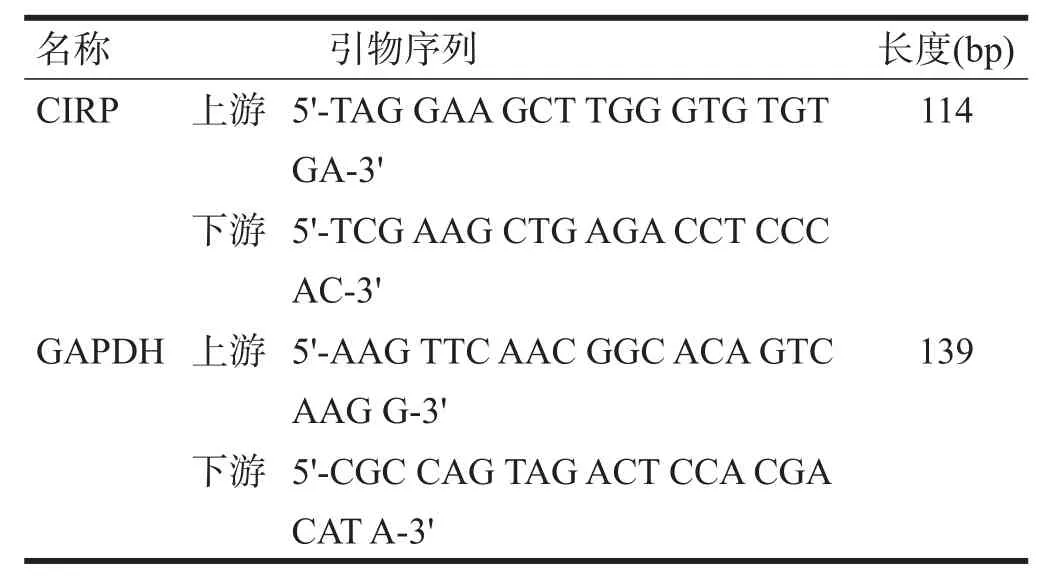
表1 基因引物序列
1.4.1.2 Western blotting检测CIRP蛋白表达
取上述预处理各组神经组织约30 mg,按照10 ml/kg比例加入裂解液,匀浆,静置1 h,12000 r/min离心15 min,抽取上清后按BCA法检测蛋白浓度。SDS-PAGE电泳,转移至PVDF膜,5%脱脂牛奶室温封闭2 h,TBST洗膜,一抗(CIRP 1∶1000;GAPDH 1∶5000)4℃孵育过夜;TBST洗膜后,二抗(山羊抗兔IgG)室温孵育60 min,TBST洗膜,ECL显色,凝胶成像系统成像,使用GAPDH做内参;用Image J软件进行定量分析,用目的蛋白与内参蛋白的灰度值比值表示蛋白的相对表达量,生物学重复为6次。
1.4.2 冷冻保存后Calcein-AM/PI荧光染色
取上述冷冻保存4周后各组坐骨神经各4条,另随即取新鲜神经4条作为新鲜对照组(E组),修剪成2 mm长短神经片段,浸入1%triton X-100中通透30 min,PBS冲洗,室温下Calcein-AM(20 μmol/L)染色30 min,PBS洗涤,PI染色15 min,PBS洗涤,防荧光淬灭剂封片,激光共聚焦显微镜观察荧光强度,激发波长490 nm(绿色荧光)和535 nm(红色荧光),活细胞呈绿色荧光,死细胞呈红色荧光。
1.4.3 Western blotting检测冷冻保存后Bcl-2、Bax蛋白表达
按照上述Western blotting法检测Bcl-2、Bax蛋白表达,β-actin作为内参,生物学重复为6次。
1.4.4 冷冻保存神经分泌NGF、GDNF检测
取上述冷冻保存4周后各组坐骨神经各8条,另随即取Sprague-Dawley大鼠新鲜神经8条作为新鲜对照组(E组),截成3 mm长小段,置于6孔培养板中,每孔中加入DMEM培养基(含10%FBS,1%双抗)2.5 ml,每组5个培养孔,于37℃、5%CO2培养7 d,每2天换液1次。按照上述Western blotting法检测NGF、GDNF蛋白表达,β-actin作为内参,生物学重复为6次。
1.4.5 同种异体神经移植术后免疫排斥反应
采用免疫组化染色观察免疫排斥反应。移植后4周,大鼠2%戊巴比妥钠30 mg/kg腹腔注射麻醉,于右股后外侧纵行切口,截取大鼠移植神经中段,4%多聚甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,纵切4 μm;二甲苯脱蜡后水化,抗原修复,血清封闭,CD4一抗孵育过夜,滴加二抗,辣根酶标,DAB显色,苏木精复染,盐酸酒精分化,碳酸锂返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片,光镜观察CD4阳性T淋巴细胞入侵移植物情况。
每组选取6只大鼠,2%戊巴比妥钠30 mg/kg腹腔注射麻醉,心脏取血,静置1 h后,3000 r/min离心15 min,取上清。血清IL-6、IFN-γ水平根据ELISA试剂盒说明书测定。
1.4.6 同种异体神经移植术后电生理检测
术后20周,各组选取6只大鼠,10%水合氯醛4 ml/kg腹腔麻醉,于右股后外侧纵行切口,沿肌间隙钝性分离,暴露、游离移植侧坐骨神经,于梨状肌下缘3 mm处神经干上放置刺激电极,同侧外踝关节上10 mm腓肠肌上安置接收电极,地线远离两电极接地,刺激强度1 V,刺激间隙0.25 ms。用BL-420F系统测定肌肉复合动作电位(compound muscle action potential,CMAP)和运动神经传导速度(motor nerve conduction velocity,MNCV)。
1.4.7 同种异体神经移植术后组织学分析
电生理检测后,截取大鼠移植神经中段8 mm,2%戊二醛4℃固定过夜,1%锇酸固定2 h,梯度丙酮脱水,环氧树脂包埋。
半薄切片,甲苯胺蓝染色,CCD光谱测量系统,每张切片随机取6个视野统计,以Image-Pro Plus 6.0图像分析软件,分析再生有髓神经纤维数目和髓鞘厚度。
每组另取两个样本,超薄切片、醋酸铀-柠檬酸铅双重染色,透射电镜观察再生神经超微结构。
1.5 统计学分析
采用SPSS 22.0进行分析。数据以表示,组间比较采用单因素方差分析,两两比较采用q检验,显著性水平α=0.05。
2 结果
2.1 预处理后神经CIRP mRNA及蛋白水平
4组CIRP mRNA表达有非常高度显著性差异(P<0.001),C组表达最高,B组表达最低,A组次之。4组CIRP蛋白表达有非常高度显著性差异(P<0.001),C组表达最高,B组表达最低,A组次之,但A组和B组间无显著性差异(P>0.05)。见图1、表2。

图1 不同温度预处理后坐骨神经CIRP蛋白表达(Western blotting)
2.2 坐骨神经冷冻保存后观察
2.2.1 Calcein-AM/PI荧光染色
E组神经纤维绿色荧光强、分布广泛,基本没有红色荧光;A组、B组、C组和D组液氮保存4周后,仍可见神经纤维较强绿色荧光,但荧光强度较E组弱,且红色荧光较E组明显多,但C组红色荧光明显较A组、B组和D组弱。见图2。
2.2.2 冷冻保存神经Bax、Bcl-2蛋白表达
4组间Bax蛋白表达均有非常高度显著性差异(P<0.001),C组表达低于A组、B组和D组(P<0.05),A组和B组间无显著性差异(P>0.05)。见表3、图3。
4组间Bcl-2蛋白表达均有非常高度显著性差异(P<0.001),C组表达高于A组、B组和D组(P<0.05),B组高于A组(P<0.05)。见表3、图3。

表2 各组预处理后CIRPmRNA及蛋白水平

图2 Calcein-AM/PI荧光染色激光共聚焦显微镜观察(400×,bar=50µm)
2.2.3冷冻保存神经分泌NGF、GDNF蛋白表达
坐骨神经体外培养7 d,均可检测到NGF及GDNF表达。与E组相比,C组表达升高(P<0.05),A组、B组和D组表达降低(P<0.05)。与D组相比,A组、B组NGF蛋白表达降低(P<0.05);A组、B组GDNF蛋白无显著性差异(P>0.05)。C组NGF及GDNF蛋白表达均高于其他组(P<0.05)。见表4、图4。
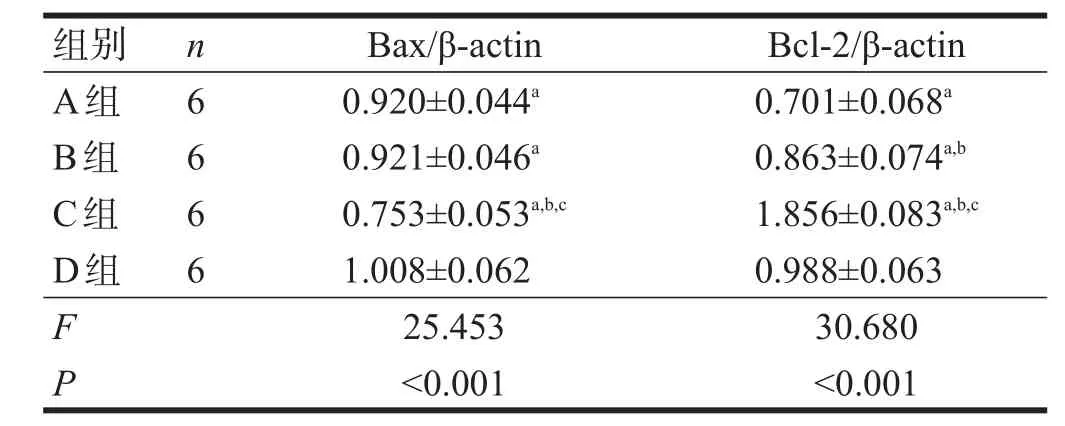
表3 各组冷冻保存神经Bax、Bcl-2蛋白水平

图3 冷冻保存神经Bax、Bcl-2蛋白表达(Western blotting)

图4 冷冻保存神经分泌NGF、GDNF蛋白表达(Western blotting)
2.3 同种异体神经移植后检测
2.3.1 免疫排斥反应
术后4周,F′组CD4+T淋巴细胞较少,E′组最多,各预处理组中,C′组较A′组、B′组及D′组相对较少(图5)。ELISA结果显示,F′组血清中IL-6、IFN-γ水平最低,E′组最高(P<0.001);与 E′组相比,C′组 IL-6、IFN-γ水平降低(P<0.05),并且在各个预处理移植组中,F′组IL-6、IFN-γ水平最低(P<0.05);C′组与D′组和F′组比较无显著性差异(P>0.05)。见表5。

表4 各组冷冻保存神经分泌NGF、GDNF蛋白水平

表5 各组术后4周各组大鼠血清IL-6、IFN-γ水平
2.3.2 电生理检测
移植术后20周,所有组间CMAP、MNCV均有非常高度显著性差异(P<0.001)。F′组CMAP、MNCV优于其他组(P<0.05);C′组优于A′组、B′组、D′组和E′组(P<0.05);与 D′组相比,A′组无明显变化(P>0.05),B′组降低(P<0.05)。见表6。
2.3.3 组织学分析
移植后20周,F′组髓鞘厚度优于其他组(P<0.05),C′组优于 A′组、B′组、D′组和 E′组(P<0.05)。见图6、表7。
移植后20周,电镜观察超微结构显示,F′组和C′组可见大量有髓神经纤维,纤维粗细均匀,髓鞘厚;D′组再生有髓神经纤维数量较多,分布广泛、髓鞘较厚;A′组及B′组再生有髓神经纤维数量较少,分布较广泛,髓鞘较薄;E′组再生有髓神经纤维数量少,直径较细,分布稀疏,髓鞘薄,可见明显结蹄组织增生。见图7。

图5 术后4周移植段神经淋巴细胞入侵(免疫组化染色,100×,bar=200µm)

图6 术后20周移植神经中段甲苯胺蓝染色(400×,bar=50µm)
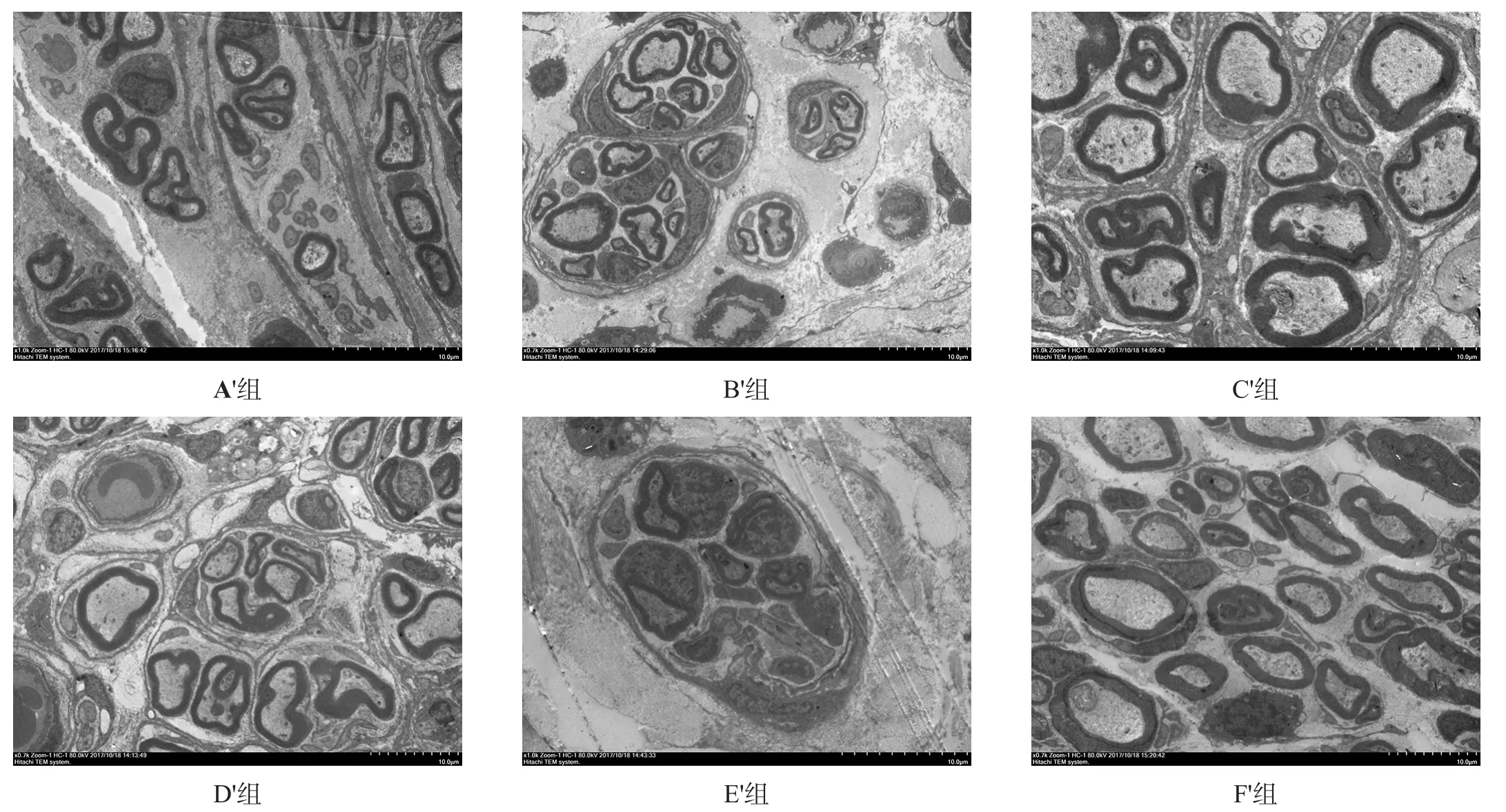
图7 各组术后20周移植中段再生神经电镜超微结构(6000×,bar=10µm)
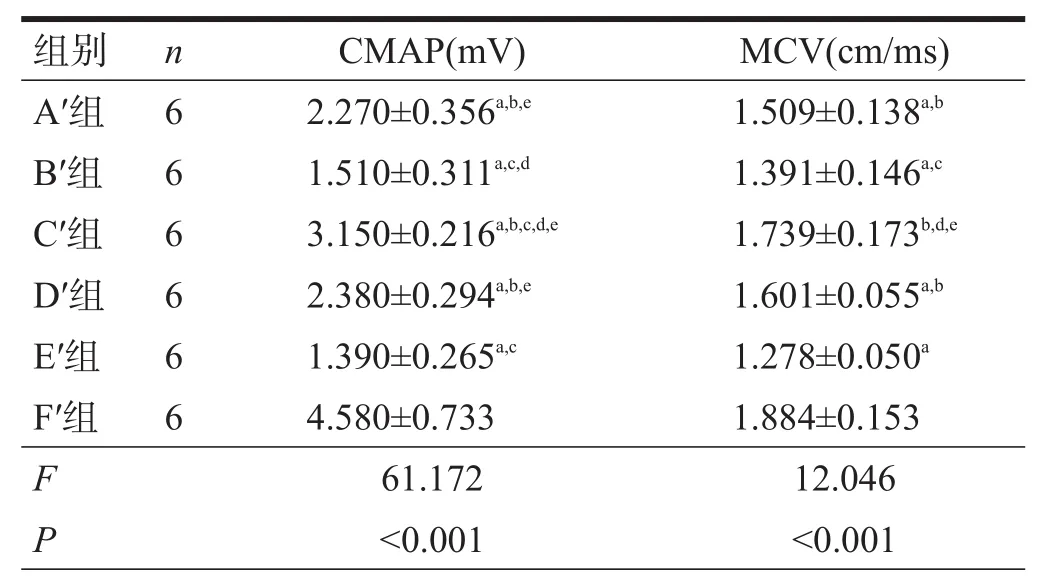
表6 各组术后20周肌肉CMAP和MNCV比较
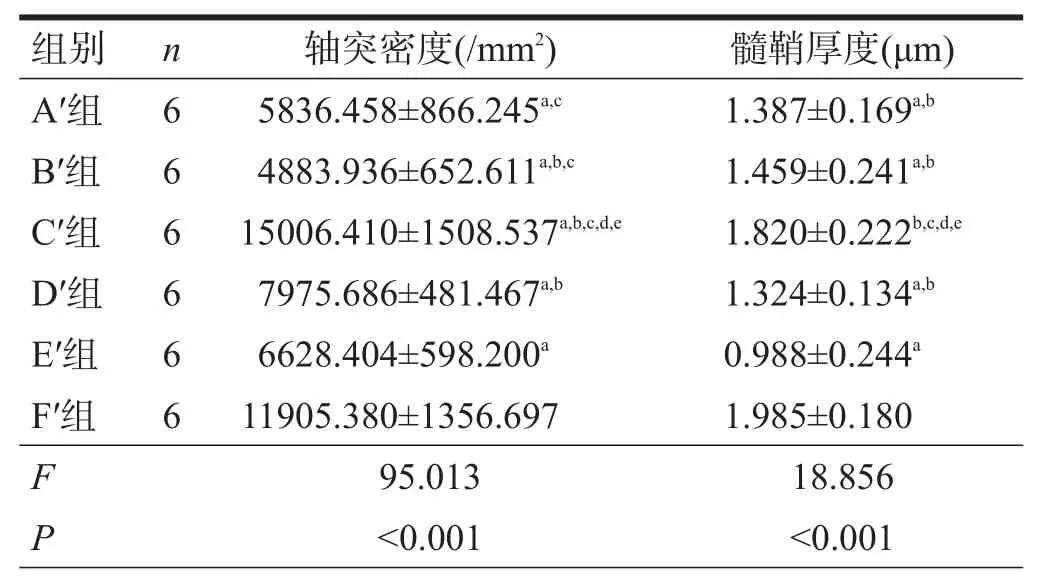
表7 各组术后20周轴突密度和髓鞘厚度比较
3 讨论
由于自体神经移植无法满足临床周围神经长段缺损修复需要,同种异体神经具有自体神经相同的组织结构特点,最有可能成为自体神经的替代物。周围神经深低温保存可以为临床提供神经缺损修复所需要的神经移植物,但是低温保存时渗透压的改变、冰晶形成、缺血缺氧等变化,会造成被保存组织的细胞(包括周围神经SCs)严重损伤[7-9]。SCs是周围神经的主要结构和功能细胞,能分泌多种神经营养因子和黏附分子,对周围神经损伤后的神经再生具有非常重要的作用,缺乏SCs的神经修复材料,不利于修复后的神经再生。
CIRP是首个在哺乳动物细胞中发现的冷休克蛋白,对冷诱导下细胞生长及凋亡具有调控作用[10]。同时,是亚低温时对脑、心、肝脏等组织器官起低温保护作用的温度依赖性关键调控蛋白,在细胞受到低温、缺氧、紫外线、渗透压变化等因素刺激时,表达会升高[11]。研究表明,在哺乳动物细胞中,CIRP在轻度至中度低温(28~34℃)时达到高峰,低温(15~25℃)时则显著下降;在热刺激(39~42℃)下表达显著降低[12]。
本实验结果显示,大鼠坐骨神经在不同温度预处理24 h后,32℃预处理后CIRP表达明显升高;用不同温度预处理24 h的大鼠坐骨神经冷冻保存4周,CIRP高表达提高了冷冻保存神经的活细胞数量。此外,32℃预处理后,Bcl-2表达升高,Bax蛋白降低。有研究表明,细胞凋亡是一个受多种因素调控的复杂过程,尤其是Bcl-2和Bax,在调节细胞分化和神经元存活中发挥作用。Bcl-2能够防止由于紫外线、自由基、生长因子缺乏等各种应激引起的细胞凋亡;相反,Bax诱导细胞死亡[13]。这些发现提示CIRP通过激活Bcl-2和抑制Bax,在冷冻保存过程中发挥神经保护作用。
SCs作为周围神经的主要结构与功能细胞,能释放多种神经营养因子,如NGF、GDNF,这些生长因子在周围神经损伤后,对神经细胞的存活、轴突的生长和走向起着十分重要的营养和诱导作用[14-16]。另外,有研究报道,GDNF通过上调Bcl-2和抑制Bax来保护神经细胞免于凋亡[17]。本实验结果显示,将冷冻保存后的坐骨神经于体外培养1周,32℃预处理后NGF和GDNF高表达,表明SCs在冷冻保存后仍具有分泌神经营养因子的生物学活性,这可能与Bax/Bcl-2途径密切相关。
免疫排斥反应是同种异体移植面临的又一大问题,可能对神经再生及功能恢复造成不利的影响。活化的CD4+T淋巴细胞通过释放炎症因子IL-6、IFN-γ等[18],介导免疫排斥反应。Li等[19]发现,CD4+T淋巴细胞水平升高会损伤移植后的器官。本实验结果显示,与新鲜同种异体移植相比,冷冻保存后同种异体移植的CD4+T淋巴细胞入侵及血清IL-6、IFN-γ水平较低,尤其是32℃预处理的同种异体移植后。据报道,冷冻保存可以降低同种异体移植排斥反应[20-21];此外,CIRP的缺乏将加速炎症反应、延长伤口愈合过程[22]。本实验结果与此一致,这表明CIRP的高表达以及冷冻保存降低了同种异体移植后的免疫排斥反应。
移植术后20周,与4℃同种异体移植、15℃同种异体移植、冷冻处理新鲜同种异体移植相比,32℃同种异体移植后再生有髓神经纤维数量较多,分布广泛、髓鞘较厚;肌肉CMAP高,MNCV快。据报道,神经损伤后,随着时间推移,其支配的靶肌肉将发生不可逆转的萎缩,并失去功能,其功能恢复与神经轴突的再生密切相关[23-24]。MNCV与髓鞘厚度有关,而髓鞘厚度是再生纤维成熟程度的反映。再生纤维的传导速度能否完全恢复正常,很大程度上取决于髓鞘厚度的恢复[25-26]。因此,本实验通过CIRP的诱导表达,提高了冷冻保存后神经的生物活性,同种异体移植后通过增加再生神经轴突的厚度和密度,进而促进坐骨神经的功能恢复。
综上所述,大鼠坐骨神经32℃亚低温预处理,通过诱导坐骨神经CIRP高表达,能够抑制冷冻保存过程中细胞凋亡,维持保存后神经SCs的生物活性,有利于SCs分泌神经营养因子,并可减弱移植后免疫排斥反应,从而改善异体移植后受体神经的再生效果以及功能恢复,这可为周围神经损伤治疗提供新的思路。我们将进一步探讨关于CIRP在坐骨神经再生中更为详细的分子机制。
]
[1]Gu X,Ding F,Yang Y,et al.Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration[J].Prog Neurobiol,2011,93(2):204-230.
[2]Motohashi HH,Sankai T,Kada H.Live offspring from cryopreserved embryos following in vitro growth,maturation and fertilization ofoocytesderived from preantralfolliclesin mice[J].J Reprod Dev,2011,57(6):715-722.
[3]李沿江,黄英如,王雷,等.人参皂甙Rb1冷保存大鼠坐骨神经修复周围神经缺损的实验研究[J].中国矫形外科杂志,2015,35(7):940-946.
[4]Liao Y,Tong L,Tang L,et al.The role of cold-inducible RNA binding protein(CIRP)in cell stress response[J].Int J Cancer,2017,141(11):2164-2173.
[5]Liu A,Zhang Z,Li A,et al.Effects of hypothermia and cerebral ischemia on cold-inducible RNA-binding protein mRNA expression in rat brain[J].Brain Res,2010,1347:104-110.
[6]Saito K,Fukuda N,Matsumoto T,et al.Moderate low temperature preserves the stemness of neural stem cells and suppresses apoptosis of the cells via activation of the cold-inducible RNA binding protein[J].Brain Res,2010,1358:20-29.
[7]Youm HW,Lee JR,Lee J,et al.Optimal vitrification protocol for mouse ovarian tissue cryopreservation:effect of cryoprotective agents and in vitro culture on vitrified-warmed ovarian tissue survival[J].Hum Reprod,2014,29(4):720-730.
[8]Maffei S,Pennarossa G,Brevini TA,et al.Beneficial effect of directional freezing on in vitro viability of cryopreserved sheep whole ovaries and ovarian cortical slices[J].Hum Reprod,2014,29(1):114-124.
[9]肖龙,黄英如,李沿江,等.二甲基亚砜和乙二醇对玻璃化保存大鼠坐骨神经的协同保护作用[J].上海交通大学学报(医学版),2015,35(7):940-946.
[10]Zhu X,Christoph B,Sven W.Cold-inducible proteins CIRP and RBM3,a unique couple with activities far beyond the cold[J].Cell Mol Life Sci,2016,73(20):1-21.
[11]Li SC,Zhang ZW,Xue JH,et al.Cold-inducible RNA binding protein inhibits H2O2-induced apoptosis in rat cortical neurons[J].Brain Res,2012,1441:47-52.
[12]Tong G,Endersfelder S,Rosenthal LM,et al.Effects of moderate and deep hypothermia on RNA-binding proteins RBM3 and CIRP expressions in murine hippocampal brain slices[J].Brain Res,2013,1504:74-84.
[13]闫斌,王靖博,张宏,等.槲皮素对高糖培养海马神经元凋亡及Akt、p-Akt、Bcl-2、Bax蛋白表达的影响[J].中国康复理论与实践,2017,23(12):1390-1396.
[14]陈虹,李俊岑,党彦丽,等.电刺激对大鼠脊髓损伤后神经生长因子表达的影响[J].中国康复理论与实践,2012,18(1):33-36.
[15]Madduri S,Feldman K,Tervoort T,et al.Collagen nerve conduits releasing the neurotrophic factors GDNF and NGF[J].J Control Release,2010,143(2):168-174.
[16]Allen SJ,Watson JJ,Shoemark DK,et al.GDNF,NGF and BDNF as therapeutic options for neurodegeneration[J].Pharmacol Ther,2013,138(2):155-175.
[17]Liu G,Wang X,Shao G,et al.Genetically modified Schwann cells producing glial cell line-derived neurotrophic factor inhibit neuronal apoptosis in rat spinal cord injury[J].Mol Med Rep,2014,9(4):1305-1312.
[18]张妮,左丽,王克,等.DENV-2感染的HUVECs与CD4+T细胞相互作用对炎性细胞因子产生的影响[J].中国免疫学杂志,2017,33(6):811-817.
[19]Li W,Wu WW,Lin XS,et al.Changes in T lymphocyte subsets and intracellular cytokines after transfer of chemically extracted acellular nerve allografts[J].Mol Med Rep,2012,5(4):1080-1086.
[20]Ray WZ,Kale SS,Kasukurthi R,et al.Effect of cold nerve allograft preservation on antigen presentation and rejection[J].J Neurosurg,2011,114(1):256-262.
[21]Levisetti PE,Patrizio P,Scaravelli G.Evolution of human oocyte cryopreservation:slow freezing versus vitrification[J].Curr Opin Endocrinol Diabetes Obes,2016,23(6):445-450.
[22]Idrovo JP,Jacob A,Yang WL,et al.A deficiency in cold-inducible RNA-binding protein accelerates the inflammation phase and improves wound healing[J].Int J Mol Med,2016,37(2):423-428.
[23]Zhu Z,Zhou X,He B,et al.Ginkgo biloba extract(EGb 761)promotes peripheral nerve regeneration and neovascularization after acellular nerve allografts in a rat model[J].Cell Mol Neurobiol,2015,35(2):273-282.
[24]范红石,王艳,陈国平.周围神经损伤后轴突再生微环境的研究进展[J].中国康复理论与实践,2015,21(3):288-291.
[25]Einheber S,Meng X,Rubin M,et al.The 4.1B cytoskeletal protein regulates the domain organization and sheath thickness of myelinated axons[J].Glia,2013,61(2):240-253.
[26]Payne SC,Bartlett CA,Harvey AR,et al.Myelin sheath decompaction,axon swelling,and functional loss during chronic secondary degeneration in rat optic nerve[J].Invest Ophthalmol Vis Sci,2012,53(10):6093-6101.
