黄河口牡蛎产卵场及邻近海域浮游植物的群落结构特征
2018-04-26巩俊霞王志忠张明磊许国晶陈秀丽李壮张金路杜兴华田功太郑慧丽
巩俊霞,王志忠,张明磊,许国晶,陈秀丽,李壮,张金路,杜兴华,田功太,郑慧丽
(山东省淡水渔业研究院,山东 济南 250017)
黄河年输入渤海径流量为344亿m3,带入巨量的淡水、泥沙和各种营养盐类,河口和近海区初级生产力较高,饵料生物丰富,形成了适宜海洋生物生长、发育的良好生态环境,是多种海洋生物的产卵场、索饵场和育肥场[1,2]。黄河口牡蛎产卵场(俗称黄河口牡蛎山)位于黄河口南侧小岛河入海口水域,牡蛎在此大量繁殖、生长、聚集,自然形成了大面积牡蛎礁。牡蛎不仅是高价值的海洋经济贝类,在海洋生态系统中也具有十分重要的生态作用。牡蛎礁在净化水体、提供栖息生境、保护生物多样性和耦合生态系统能量流动等方面均具有重要的功能[3]。研究认为,修复牡蛎礁,恢复和强化其生态系统的自净修复功能,可以治理海域污染,恢复其生态系统功能[4-6]。浮游植物种类多样性及群落特征是评价海域营养水平、污染状况、资源现状以及生产潜力和海洋生态系统稳定性的重要指标。海洋浮游植物群落的改变可以反映环境的变化[7]。目前有关黄河口牡蛎产卵场浮游植物群落结构的研究尚未见报道。本文通过调查及分析评价黄河口牡蛎产卵场及邻近海域浮游植物群落结构的特征,为保护和修复黄河口牡蛎产卵场,以及优化与恢复该海域生态环境质量提供科学参考。
1 材料与方法
1.1 调查站位
2015年在枯水期(5月)、平水期(6月)和丰水期(8月)对黄河口牡蛎产卵场及邻近海域生态环境进行3个航次的采样调查;每航次调查5个站位。调 查 区 域 为 E 119°4'34.99"~119°8'41.94",N 37°28'34.01"~37°35'19.95",调查面积约 68.88km2,调查采样站位分布见图1。

图1 黄河口牡蛎产卵场及邻近海域调查站位Fig.1 The survey sites in Yellow River estuary and adjacent waters
1.2 采样方法
采样方法和分类鉴定参照国家标准《海洋调查规范》[8]、《海洋监测规范》[9]、《海洋浮游生物图谱》[10]和《中国海藻志》[11]进行。浮游植物样品用浅水Ⅲ型浮游生物网自底层到表层作垂直拖网采集,5%甲醛溶液固定和保存,浓缩后用奥林巴斯CX41型生物显微镜观察、鉴定和计数。
1.3 统计分析
对浮游植物计数结果进行统计分析,其中物种的多样性指数、均匀度、物种丰富度和优势度分别按下式计算:

式中,H'为多样性指数;S为物种数目;Pi为种i的个体在全部个体中的比例,Pi=ni/N;fi为属于种i的个体在各站位中出现的频率;J为均匀度;N为样品的总个数;ni为样品中i种的个数。本研究中浮游植物优势度D≥0.02的种为优势种[14]。
1.4 评价方法
浮游植物优势种群及群落结构特征指数(如多样性指数、均匀度指数等)可用来表征其群落结构,优势种群和群落结构特征指数的变化可以在一定程度上反映出环境的变化(如污染等)[15-17]。本文根据孙军等[18]所提出的浮游植物多样性指数、丰富度和均匀度的阈值,综合评判黄河口牡蛎产卵场及邻近海域浮游植物群落结构及环境状况,各指数评价见表 1。H'在 3~4 为无污染,2~3 为轻度污染,1~2为中度污染,<l为重污染;同时结合均匀度、丰富度和优势度等指标来衡量调查海域生物群落结构现状。

表1 浮游植物群落结构指标评价Tab.1 Evaluation of community structure of phytoplankton
2 结果与分析
2.1 浮游植物的种类组成
共检出浮游植物2门21种,硅藻门19种,占90.48%,甲藻门2种,占9.52%。其中,5月检出2门13种,硅藻门12种,占92.31%,甲藻门1种,占7.69%;6月检出2门12种,硅藻门11种,占91.67%,甲藻门1种,占8.33%;8月检出2门8种,硅藻门7种,占87.5%,甲藻门1种占1.25%。由调查结果可知,枯水期(5月)浮游植物种类数最多,平水期(6月)次之,丰水期(8月)最少。硅藻门是本调查水域浮游植物的主要组成类群。
2.2 浮游植物的优势种
以浮游植物优势度Y≥0.02的种判定为优势种。调查水域的优势种分别为:细弱圆筛藻Coscinodiscus subtilis、虹彩圆筛藻Coscinodiscus oculusiridis、舟形藻Navicula、夜光藻Noctilucidae scientillans和短柄曲壳藻Achnanthes brevipes Ag.。枯水期(5月)优势种有4种,平水期(6月)3种,丰水期(8月)2种(表2)。舟形藻为本次调查出现频率最高(100%)的优势种,有较高的优势度,细弱圆筛藻、虹彩圆筛藻仅在枯水期(5月)和平水期(6月)出现。
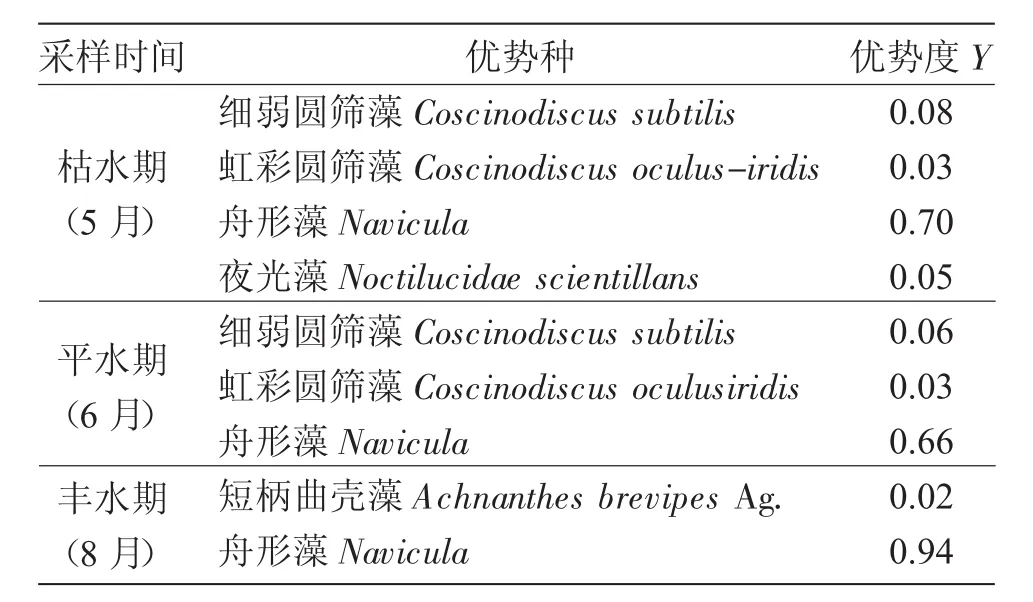
表2 黄河口牡蛎产卵场及邻近海域浮游植物的优势种及优势度Tab.2 Dominant species and dominance of phytoplankton in Yellow River estuary and adjacent waters
2.3 浮游植物丰度
2.3.1 浮游植物丰度组成
调查水域浮游植物丰度主要由硅藻、甲藻组成。枯水期(5月)硅藻的丰度为 111 447ind.·m-3,甲藻的丰度为5437.46ind.·m-3,硅甲藻的比值为20.50;平水期(6 月)硅藻的丰度为 108 100 ind.·m-3,甲藻的丰度为1.50 ind.·m-3,硅甲藻的比值为72 066.67;丰水期(8月)硅藻的丰度为 486 238 ind.·m-3,甲藻的丰度为 1 050ind.·m-3,硅甲藻的比值为 463.08(表3)。
2.3.2 浮游植物丰度的平面分布
黄河口牡蛎产卵场及邻近海域浮游植物丰度的变动范围为(3.68~358.31)×104ind.·m-3,平均丰度为20.33×104ind.·m-3。枯水期(5月)浮游植物丰度的变动范围为(3.68~21.89)×104ind.·m-3,平均为11.69×104ind.·m-3,低值出现在 1#站位,高值出现在 4#站位;平水期(6月)为(6.88~15.75)×104ind.·m-3,平均为 10.81×104ind.·m-3,低值出现在 1 号站位,高值出现在2#站位;丰水期(8月)为(12.60~101.50)×104ind.·m-3, 平 均 为 48.73 ×104ind.·m-3,低值出现在 1#站位,高值出现在 4#站位(图2),丰水期浮游植物丰度高值是低值的8倍,说明丰度平面分布不均匀。

图2 黄河口牡蛎产卵场及邻近海域浮游植物丰度分布Fig.2 The abundance distribution of phytoplankton in oyster spawning ground in Yellow River estuary and adjacent waters

表3 黄河口牡蛎产卵场及邻近海域浮游植物的丰度组成(ind.·m-3)Tab.3 The abundance(ind.·m-3)of phytoplankton in Yellow River estuary and adjacent waters
2.4 浮游植物生物多样性分布
黄河口牡蛎产卵场及邻近海域浮游植物多样性指数的变动范围在0.21~2.36之间,均值为1.19。枯水期(5月)的浮游植物多样性指数均值为1.59,高值出现在1#站位,低值出现在2#站位;平水期(6月)多样性指数均值为1.35,高值出现在4#站位,低值出现在2#站位;丰水期(8月)多样性指数均值为0.56,高值出现在1#站位,低值出现在3#站位。浮游植物多样性指数由高至低依次为:枯水期(5月)>平水期(6月)>丰水期(8月)。
黄河口牡蛎产卵场及邻近海域浮游植物的均匀度变动范围在0.13~0.91之间,均值为0.51。枯水期(5月)的浮游植物均匀度均值为0.66,高值出现在1#站位,低值出现在2#站位;平水期(6月)均匀度均值为0.53,高值出现在1#站位,低值出现在3#站位;丰水期(8月)均匀度均值为0.34,高值出现在1#站位,低值出现在3#站位。浮游植物均匀度枯水期(5月)>平水期(6月)>丰水期(8月)。
黄河口牡蛎产卵场及邻近海域浮游植物的物种丰富度变动范围在0.15~0.61之间,均值为0.33。枯水期(5月)的浮游植物丰富度均值为0.42,高值出现在4#站位,低值出现在5#站位;平水期(6月)丰富度均值为0.38,高值出现在4#站位,低值出现在3#站位;丰水期(8月)丰富度均值为0.20,高值出现在4#站位,低值出现在5#站位。浮游植物丰富度由高至低依次为:枯水期(5月)>平水期(6月)>丰水期(8月)。
综上所述,黄河口牡蛎产卵场及邻近海域浮游植物多样性指数、均匀度和丰富度均以枯水期(5月)最高,平水期(6月)次之,丰水期(8月)最低,表明枯水期(5月)浮游植物的群落结构特征好于平水期(6月)和丰水期(8月)。
2.5 环境质量评价

表4 黄河口牡蛎产卵场及邻近海域浮游植物的多样性指数与环境质量评价Tab.4 Diversity index and environmental quality assessment of phytoplankton in oyster spawning ground in Yellow River estuary and adjacent waters

图3 黄河口牡蛎产卵场及邻近海域浮游植物群落特征指数的分布Fig.3 Distribution of community feature index of phytoplankton in oyster spawning ground in Yellow River estuary and adjacent waters
由表4可知,枯水期(5月)黄河口牡蛎产卵场及邻近海域的浮游植物多样性指数均值为1.59,环境质量评价属于中污染水平。多样性指数在2~3之间的站位1个,属于轻污染水平,占20.00%;多样性指数在1~2之间的站位3个,属于中污染水平,占60.00%;多样性指数<1的站位1个,属于严重污染,占20.00%。平水期(6月)的多样性指数均值为1.35,从整体来看属于中污染水平。多样性指数在2~3之间的站位2个,属于轻污染水平,占40.00%;在1~2之间的站位1个,属于中污染水平,占20.00%;多样性指数<1的站位2个,属于严重污染,占40.00%。丰水期(8月)的多样性指数均值为0.63,整体属于重污染水平。多样性指数在1~2之间的站位1个,属于中污染水平占20.00%;多样性指数<1的站位4个,属于严重污染,占80.00%(表4)。
3 讨论
3.1 浮游植物的种类组成
共检出浮游植物2门21种,硅藻门19种,占90.48%,甲藻门2种,占9.52%。枯水期(5月)浮游植物种类数最多,平水期(6月)次之,丰水期(8月)最少。硅藻门是本调查水域浮游植物的主要组成类群。近年来,仅有少量关于黄河口及邻近海域浮游植物的种类组成的研究。张继民等[19]2006年的调查结果为:黄河口有浮游植物129种,其中硅藻99种,占76.74%,巩俊霞等[20]2008年对黄河口的调查结果为8门63种,其中硅藻26种占41.27%。冷春梅等[21]2012年对黄河口调查结果为79种,其中硅藻20种占25.32%。本次调查结果少于以上调查,种类组成差别也很大,但均以硅藻为主。其主要原因可能是调查区域的不同,充分说明了浮游植物种类组成的地理地域性。
3.2 浮游植物丰度的分布与变化
调查海域浮游植物丰度的变动范围在3.68×104~358.31×104ind.·m-3之间,平均丰度为 20.33×104ind.·m-3。丰水期浮游植物丰度高值与低值之间差异显著,充分说明丰度平面分布的不均匀性。本调查水域浮游植物丰度丰水期(8月)最高,枯水期(5月)次之,平水期(6月)最低,其原因可能是丰水期大量径流入海带来了丰富的营养盐,适宜浮游植物的生长繁殖。3次调查,1#站位的丰度值均最低1#站位于小岛河入海处,此处淡海水交汇,营养盐丰富,适合浮游生物的生长,生物多样性较好,是造成丰度值低的原因之一。
3.3 浮游植物的群落特征
调查海域浮游植物多样性指数的变动范围在0.21~2.36之间,均值为1.19。浮游植物多样性指数、均匀度及丰富度均枯水期(5月)最高,平水期(6月)次之,丰水期(8月)最低,表明枯水期(5月)浮游植物的群落结构好于平水期(6月)、丰水期(8月)。在3个航次的调查中,1#站位浮游植物的多样性指数、均匀度均最高,说明1#站位浮游植物的群落特征优于其他站位。
3.4 调查水域环境质量评价
根据孙军[18]等提出的环境评价标准对调查水域水质状况进行评价,枯水期(5月)和平水期(6月)环境质量评价属于中污染水平,丰水期(8月)整体属于重污染水平。
[1]庞家珍,姜明星.黄河河口演变(Ⅰ):(一)河口水文特征[J].海洋湖沼通报,2003(3):1-13.
[2]吕振波,李凡,曲业兵,等.2010年夏季黄河口及邻近海域鱼类群落多样性[J].渔业科学进展,2013,34(2):10-18.
[3]全为民,沈新强,罗民波,等.河口地区牡蛎礁的生态功能及恢复措施[J].生态学杂志,2006,25(10):1234-1239.
[4]Plutchak R,Major K,Cebrian J,et al.Impacts ofoyster reef restoration on primary productivity and nutrient dynamics in tidal creeks of the north central gulf of Mexico[J].Estuaries and Coasts,2010,33(6):1355-1364.
[5]Quan W M,Zheng L,Li B J,et al.Habitat values for artificial oyster (Crassostrea ariakensis)reefs compared with natural shallow-water habitats in Changjiang River estuary[J].Chinese Journal of Oceanology and Limnology,2013,31(5):957-969.
[6]Sharma S,GoffJ,MoodyR M,et al.Dorestored oyster reefs benefit seagrasses An experimental study in the Northern Gulf of Mexico[J].Restoration Ecology,2016,24(3):306-313.
[7]洪伟,吴承祯.Shannon—Wiener指数的改进[J].热带亚热带植物学报,1999,7(2):120-124.
[8]国家技术监督局.海洋调查规范[M].北京:中国标准出版社,1992:17-22.
[9]GB17378.4-1998,海洋监测规范(第4部分:海水分析)[S].
[10]韩茂森,束蕴芳.中国海洋浮游生物图谱[M].北京:海洋出版社,1992.
[11]郭玉洁,钱树本.中国海藻志[M].北京:科学出版社,2003.
[12]孙儒泳,李庆芬,牛翠娟,等.基础生态学[M].北京:高等教育出版社,2002:45-46.
[13]Margaleg D R.Information theory in ecology[J].Gensyst,1958(3):36-71.
[14]徐兆礼,陈亚瞿.东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J].生态学杂志,1989,8(4):13-15.
[15]孙军,刘东艳,宁修仁,等.2001/2002年夏季南极普里兹湾及其邻近海域的浮游植物[J].海洋与湖沼,2003,34(5):519-532.
[16]孙军,刘东艳,杨世民,等.渤海中部和渤海海峡及邻近海域浮游植物群落结构的初步研究[J].海洋与湖沼,2002,33(5):461-471.
[17]孙松,张永山,吴玉霖,等.胶州湾初级生产力周年变化[J].海洋与湖沼,2005,36(6):481-486.
[18]孙军,刘东艳,魏皓,等.琉球群岛邻近海域浮游植物多样性的模糊综合评判[J].海洋与湖沼,2001,32(4)445-453.
[19]张继民,刘霜,张琦,等.黄河口附近海域浮游植物种群变化[J].海洋环境科学,2010,29(6):834-837.
[20]巩俊霞,杨秀兰,刘飞,等.黄河入海口水域浮游植物的群落特征[J].长江大学学报:自然科学版,2012,9(7):22-26.
[21]冷春梅,曹振杰,张金路,等.黄河口浮游生物群落结构特征及环境质量评价[J].海洋环境科学,2014,3(33):360-365.
