血小板与淋巴细胞比值在早期结外NK/T细胞淋巴瘤中的预后价值*
2018-04-26权小英李力任苑蓉魏雯余思思吴萍张智慧610041成都四川省肿瘤医院研究所四川省癌症防治中心电子科技大学医学院淋巴瘤科权小英李力任苑蓉魏雯余思思吴萍张智慧646000四川泸州西南医科大学权小英
权小英,李力,任苑蓉,魏雯,余思思,吴萍,张智慧 610041成都, 四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 淋巴瘤科 (权小英、李力、任苑蓉、魏雯、余思思、吴萍、张智慧);646000 四川 泸州, 西南医科大学(权小英)
结外NK/T细胞淋巴瘤(extranodal natural killer/T-cell lymphoma,ENKTL)是非霍奇金淋巴瘤的一种罕见类型,具有高度侵袭性的特点。其临床表现及疗效差别较大,放疗是早期患者的主要治疗手段,晚期以化疗为主[1]。大部分患者就诊时属于局限性IE~IIE期,预后指标如国际预后指数(International Prognostic Index ,IPI)和韩国预后指数(Korean Prognostic Index,KPI )的使用受限[2-3]。因此,有必要寻找新的预后模式进行更确切的分层指导预后。有研究证实炎症反应与肿瘤发生发展密切相关[4]。淋巴细胞能够抑制肿瘤细胞的增殖和转移,在免疫监视中起关键作用。有研究证实淋巴细胞减少与多种肿瘤患者的不良预后密切相关[5]。血小板增多可能与癌症诱导的非特异性炎性反应密切相关,而它的激活对于癌症的进展至关重要[6]。因此,血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR),是血小板与淋巴细胞两个因素的结合,已被证实与多种实体瘤和B细胞淋巴瘤患者的不良预后有关[7-10]。但是,PLR与ENKTL预后的关系国内外相关报道较少[11-12]。本研究旨在探讨PLR与ENKTL预后的相关性,为临床治疗的选择提供依据。
1 资料与方法
1.1 一般资料
回顾性选择2009年1月至2015年12月在我院接受治疗的IE~IIE期ENKTL患者156例,所有患者符合以下标准:1)病理形态学和免疫组化确诊;2)IE~IIE期,原发部位均来源于鼻腔、鼻窦、鼻咽等上呼吸道;3)无感染及其他肿瘤;4)入院前未接受相关治疗;5)临床资料齐全。其中男性112例,女性44例,男女比2.55:1,年龄15岁~86岁,中位年龄44岁,60岁以上者27例。所有入组患者治疗前均需要完善血常规、生化、骨髓及流式细胞学,鼻咽颈部MRI,胸腹CT等检查。采集患者治疗前外周血,利用Mindray BC5800行血小板及淋巴细胞计数。通过鼻咽颈部MRI及骨髓穿刺行Ann Arbor分期[13],IE期86例。有B症状者69例。LDH>240U/L(正常范围0~240U/L)40例。ECOG score 0~1:129例。IPI score 0~1:116例。KPI score 0~1:106例。低PLR组117例,高PLR组39例。
1.2 治疗方案及疗效评价
156例患者均接受治疗[1]。其中接受化疗序贯放疗(chemotherapy followed by radiotherapy,CTFRT)50例,化疗夹心放疗(chemotherapy sandwiched radiotherapy,CTSRT)50例,单纯放疗(radiotherapy alone,RT)36例,放疗序贯化疗(radiotherapy followed by chemotherapy,RTFCT)20例。化疗方案:CHOP±E(环磷酰胺+长春新碱+表阿霉素+泼尼松±依托泊苷),PGEMOX(培门冬酶+吉西他滨+奥沙利铂),LOP(门冬酰胺酶+长春新碱+地塞米松),VDLP(门冬酰胺酶+顺铂+依托泊苷+地塞米松)。化疗疗程1~8周期(中位疗程4周期),每21天为一周期。使用6MeV电子线的直线加速器行适型调强放疗,靶区范围包括鼻腔及受累的邻近结构,颈部淋巴结受侵时加做双颈照射,根治性剂量50~60Gy(中位剂量56Gy),2.0Gy/天,每周5次。患者每2个周期化疗后及全部治疗结束后复查鼻咽颈部MRI/CT评价疗效。根据国际恶性淋巴瘤疗效标准评价近期疗效[14],分完全缓解(complete response,CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。
1.3 随访
采取门诊或电话随访,每3个月1次,随访时间截止至2017年5月。研究终点OS为从确诊之日起至发生任何原因死亡或随访终点的间隔时间。
1.4 统计学分析
采用SPSS 17.0软件,通过ROC曲线获取PLR的cut-off值(切分值),组间率的比较采用x2检验。生存分析采用Kaplan-Meier,两组间差异比较采用Log-rank检验。COX风险比例模型行多因素分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 PLR的cut-off值
以患者死亡作为终点事件,通过ROC曲线获取 PLR的曲线下面积(area under curve,AUC)为0.611,95%可信区间(confidence interval,CI)=0.509~0.713,敏感度为40.9%,特异度为81.2%(见图1),cut-off值208,分为低PLR组(<208)和高PLR组(≥208)。
2.2 两组PLR与临床病理特征关系
两组患者PLR与临床病理特征关系见表1。

表1 PLR与ENKTL患者临床病理特征间的关系
2.3 近期疗效
156例患者中,CR 100例(64.1%),PR 42例(26.9%),SD 5例(3.2%),PD 9例(5.8%),ORR 91.0%。其中,低PLR组CR 70.1%(82/117),PR 24.8%(29/117),ORR 94.9%(111/117)。高PLR组CR 46.2%(18/39),PR 33.3%(13/39),ORR 79.5%(31/39)。两组的CR,PD及ORR差异均有统计学意义,低PLR组较高PLR组有更好的疗效(P<0.05)(表2)。

图1 PLR的ROC曲线
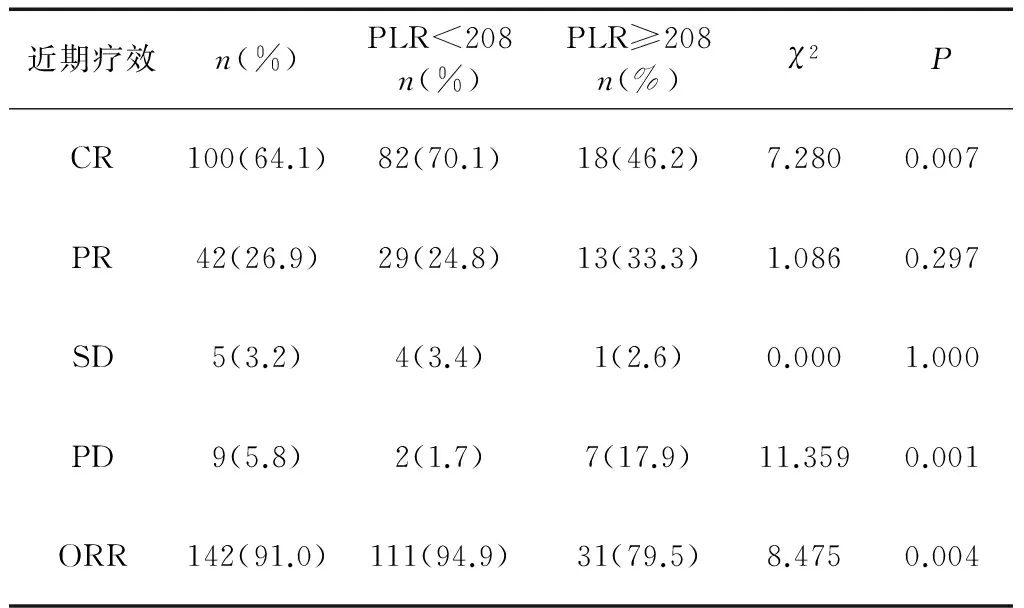
近期疗效n(%)PLR<208n(%)PLR≥208n(%)χ2PCR100(64.1)82(70.1)18(46.2)7.2800.007PR42(26.9)29(24.8)13(33.3)1.0860.297SD5(3.2)4(3.4)1(2.6)0.0001.000PD9(5.8)2(1.7)7(17.9)11.3590.001ORR142(91.0)111(94.9)31(79.5)8.4750.004
2.4 生存分析
随访时间2~97个月,中位随访25个月,死亡44例。37例失访,75例删失。整体3年OS为66.6%(图2A)。低PLR组3年OS为72.5%,高PLR组3年OS为50.3%,差异有统计学意义(χ2=6.641,P=0.01)(图2B)。
2.5 预后因素分析
单因素分析显示年龄>60岁、ECOG scores≥2、LDH>240U/L、stage IIE、IPI scores≥2、KPI scores≥2、PLR≥208的患者生存期相对短,差异有统计学意义(表3)。多因素分析显示PLR是影响ENKTL患者总生存的唯一预后因素(表4)。

图2 ENKTL患者3年OS生存曲线A:整体患者的3年OS生存曲线;B:低PLR组和高PLR组的3年OS生存曲线

临床特征3年OS(%)χ2P性别 男64.60.2240.636 女71.4年龄(y) ≤6071.74.5870.032 >6043.8LDH(U/L) ≤24068.55.2300.022 >24062.0ECOG 0~174.420.254<0.001 ≥229.3B症状 无68.10.5270.468 有64.6分期 IE75.96.3060.012 IIE55.5PLR <20872.56.6410.010 ≥20850.3IPI 0~173.814.474<0.001 ≥243.7
(转右表)
(接左表)

临床特征3年OS(%)χ2PKPI 0~171.47.7650.005 ≥256.3治疗模式 CTFRT66.10.1650.983 CTSRT64.9 RT71.7 RTFCT63.3

表4 影响ENKTL患者预后的多因素分析
2.6 PLR在IPI,KPI中的预后价值
以PLR的cut-off值作为切入点,在IPI(0~1分)组患者中,低PLR组的生存期较高PLR组长,差异有统计学意义(P=0.005,图3A)。在KPI(0~1分)组患者中,低PLR组的生存期较高PLR组好,差异有统计学意义(P=0.011,图3B)。PLR能区分基于IPI和KPI评分的低危组患者的预后。

图3 不同PLR组患者在IPI和KPI低危组的OS生存曲线A:不同PLR组与IPI(0~1分)的关系;B:不同PLR组与KPI(0~1分)的关系
3 讨 论
结外NK/T细胞淋巴瘤是一种特殊类型的非霍奇金淋巴瘤,具有明显的地域和种族分布特点,亚洲地区比西方国家常见,好发于中年男性,中位年龄45岁。目前发病机制尚不清楚,可能与EBV感染密切相关,主要侵犯上呼吸消化道等区域[15]。大部分患者就诊时诊断为IE/IIE期,对于这部分患者,放疗是初始治疗的主要组成部分,联合化疗可提高疗效和降低远处转移的风险。既往研究报道显示了单纯放疗在近期治疗反应和总生存率上的优势(ORR为91.2%,3年OS 为76.3%)[1]。同时,改变放疗技术可以提高肿瘤的治疗剂量和减轻周围正常组织的放射性损伤,适型调强放射治疗比三维适型放疗更能降低治疗的毒副反应,提高患者的耐受性[16]。近来的研究结果显示,与传统CHOP方案比较,P-GEMOX方案具有较高的ORR和较长的OS,同时不会引起严重的不良反应(ORR为92.3%,2年OS为92.3%)[17]。我们的研究采用适型调强放射治疗方式,选择单纯放疗或放疗联合化疗的治疗方案,获得较为满意的结果,整体的ORR为91.0%,3年OS为66.6%。
ENKTL具有恶性程度高和预后差的临床特点,目前,临床上多采用IPI评分作为判断ENKTL预后的指标,基于IPI评分, 绝大部分ENKTL患者属于低危组,故IPI在ENKTL患者的预后评估中使用受限[2]。韩国预后指数KPI的提出相对于IPI显示了良好的前景,但KPI评分同样不能对早期患者预后进一步区分[3]。鉴于以上指标在临床应用中存在的局限性,需要探索更准确全面的指标来评估该类疾病的预后。
有研究证实炎症与肿瘤的发生发展密切相关[4]。淋巴细胞是宿主免疫应答的重要组成部分,能够抑制肿瘤细胞增殖和转移,诱导凋亡,在免疫监视中起关键作用[18]。有文献报道,一些免疫抑制因子的释放与全身系统性炎症状态相关,如白介素-10(interlukin-10,IL-10)、转化生长因子-β(transforming growth factor,TGF-β),其机制可能是肿瘤诱导淋巴细胞破坏,从而引起淋巴细胞减少导致免疫抑制,提示抗肿瘤的能力下降[19]。基于以上结果,许多研究证实淋巴细胞减少与多种肿瘤患者的不良预后密切相关,包括ENKTL[5,20]。另外,有文献报道,促炎因子(如IL-10,IL-6等)的释放能刺激巨核细胞的产生,导致血小板的增多[21-22]。因此,血小板增多与肿瘤诱导的非特异性炎性反应密切相关。近年的研究发现血小板的激活对肿瘤的进展至关重要,其机制是因为血小板升高可能抑制自然杀伤细胞的杀伤能力,同时帮助肿瘤细胞逃避免疫监视,从而促进肿瘤进展和转移[6,23]。基于以上发现,血小板增多与预后差的关系已在多种实体肿瘤(如乳腺癌,肺癌)中被证实[24]。由上可知,外周血淋巴细胞计数、血小板计数是反映宿主抗肿瘤免疫反应和炎症反应的重要指标。另外,淋巴细胞数减少、血小板增多与肿瘤的预后不良密切相关。PLR作为血小板与淋巴细胞两者之比,可能更有助于对ENKTL疾病总生存的预测。
Wang等[12]进行的一项252例早期ENKTL患者的回顾性研究,发现PLR>185组患者的OS比PLR≤185组短(P=0.003),证实PLR是影响早期ENKTL患者预后的独立因素。同样,陈等[11]进行的一项132例ENKTL患者的研究(其中早期106例,晚期26例),发现PLR≥150组患者的OS明显比PLR<150组的短(P<0.001),得出PLR是影响ENKTL OS的独立因素。本研究发现,PLR≥208的患者与近期治疗反应有相关性,合并低CR、ORR。同时,高PLR组的3年OS(50.3%)明显低于低PLR组的3年OS(72.5%),差异有统计学意义(P=0.01)。此外,基于IPI和KPI评分的低危组患者,进一步分层分析发现高PLR较低PLR组均有相对低的OS,差异有统计学意义。外周血淋巴细胞、血小板都是肿瘤微环境的重要因素[4],外周血炎症指标异常信号往往先于临床症状,而IPI和KPI均基于临床症状,这可能是PLR比IPI和KPI能早期预测ENKTL预后的原因。多因素分析结果显示PLR是影响患者OS的独立预后因素。这一结论与文献[11-12]报道一致。本研究中PLR的cut-off为208,与既往Wang等(PLR 185)[12]研究报道阈值不同。可能与下列因素有关:1.不同研究治疗方案不同;2.不同研究人群种族不同;3.不同研究血细胞计数仪器不同。尽管与Wang[12]的研究相比,本研究的样本量较少,且疾病存在异质性,但我们同样证实了PLR是影响OS的预后因素。此外,我们的研究结果显示疾病分期、ECOG评分、LDH水平、年龄、IPI和KPI等在单因素分析中对预后有一定影响,但多因素分析显示并不是独立的预后因素,这可能是因为上述指标并不能全面反映ENKTL的生物学行为,需与其他指标相结合才有助于判断患者的预后。值得注意的是,治疗模式亦与ENKTL的预后无相关性,其原因可能为放疗是早期ENKTL患者的主要治疗手段,放疗在治疗中起了主要作用[1]。
综上,本研究发现PLR有助于判断ENKTL患者的预后,是一种简单经济的方法,具有可行性。然而,本研究尚存在一些不足之处,属于单中心回顾性研究,下一步有待多中心及前瞻性研究来进一步证实PLR在ENKTL预后判断中的作用,为该病建立一个精确全面的预后模型,以便进行更加确准的危险分层,选择合适的治疗方案改善患者预后。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[参考文献]
[1] Yang WC, Wang CW, Hong RL, et al. Treatment outcomes of and prognostic factors for definitive radiotherapy with and without chemotherapy for Stage I/II nasal extranodal NK/T-cell lymphoma[J]. J Radiat Res, 2016, 58(1):114-122.
[2] Chim CS, Ma SY, Au WY, et al. Primary nasal natural killer cell lymphoma: long-term treatment outcome and relationship with the International Prognostic Index[J]. Blood, 2004, 103(1):216-221.
[3] Au WY, Weisenburger DD, Intragumtornchai T, et al. Clinical differences between nasal and extranasal natural killer/T-cell lymphoma: a study of 136 cases from the International Peripheral T-Cell Lymphoma Project[J]. Blood, 2009, 113(17):3931-3937.
[4] Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203):436- 444.
[5] Ray-Coquard I, Cropet C, Van GM, et al. Lymphopenia as a prognostic factor for overall survival in advanced carcinomas, sarcomas, and lymphomas[J]. Cancer Res, 2009, 69(13):5383-5391.
[6] Bambace NM, Holmes CE. The platelet contribution to cancer progression[J]. J Thromb Haemost, 2011, 9(2):237-249.
[7] Li F, Hu H, Gu S, et al. Platelet to lymphocyte ratio plays an important role in prostate cancer's diagnosis and prognosis[J]. Int J Clin Exp Med, 2015, 8(7):11746-11751.
[8] Raungkaewmanee S, Tangjitgamol S, Manusirivithaya S, et al. Platelet to lymphocyte ratio as a prognostic factor for epithelial ovarian cancer[J]. J Gynecol Oncol, 2012, 23(4):265-273.
[9] Krennpilko S, Langsenlehner U, Thurner EM, et al. The elevated preoperative platelet-to-lymphocyte ratio predicts poor prognosis in breast cancer patients[J]. Br J Cancer, 2014, 110(10):2524-2530.
[10] Seo J, Kim WS, Kim JS, et al. Platelet to lymphocyte ratio (PLR) retains independent prognostic significance in advanced stage marginal zone lymphoma patients treated with rituximab, cyclophosphamide, vincristine, and prednisone combination chemotherapy (R-CVP):Consortium for improving survival of lymphoma trial[J]. Blood Res, 2017, 52(3):200-206.
[11] 陈亚芳, 臧立, 张小影,等. 外周血绝对单核细胞计数、血小板与绝对淋巴细胞计数比值在原发鼻腔NK/T细胞淋巴瘤中的预后分析[J]. 中国癌症杂志, 2017, 27(5):376-382.
[12] Wang KF, Chang BY, Chen XQ, et al. A prognostic model based on pretreatment platelet lymphocyte ratio for stage IE/IIE upper aerodigestive tract extranodal NK/T cell lymphoma, nasal type[J]. Med Oncol, 2014, 31(12):1-7.
[13] Carbone PP, Kaplan HS, Musshoff K, et al. Report of the Committee on Hodgkin's Disease Staging Classification[J]. Cancer Res, 1971, 31(11):1860-1861.
[14]Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J]. J Clin Oncol, 2007, 25(5):579-586.
[15] Tse E, Kwong YL. How I treat NK/T-cell lymphomas[J]. Blood, 2013, 121(25):4997-5005.
[16] Besson N, Pernin V, Zefkili S, et al. Evolution of radiation techniques in the treatment of mediastinal lymphoma: from 3D conformal radiotherapy (3DCRT) to intensity modulated RT (IMRT) using Helical Tomotherapy (HT): a single-centre experience and review of the literature[J]. Br J Radiol, 2016, 89(1059):20150409.
[17] 魏雯,吴萍,李力,等.P-GEMOX方案与CHOP方案一线治疗结外NK/T淋巴瘤的疗效对比[J].肿瘤预防与治疗,2016,29(5):254-259.
[18] Dunn GP, Old LJ, Schreiber RD. The immunobiology of cancer immunosurveillance and immunoediting.[J]. Immunity, 2004, 21(2):137-148.
[19] Salazar-Onfray F, López MN, Mendoza-Naranjo A. Paradoxical effects of cytokines in tumor immune surveillance and tumor immune escape[J]. Cytokine Growth Factor Rev, 2007, 18(1-2):171-182.
[20] Huang JJ, Jiang WQ, Lin TY, et al. Absolute lymphocyte count is a novel prognostic indicator in extranodal natural killer/T-cell lymphoma, nasal type[J]. Ann Oncol, 2011, 22(1):149-155.
[21] Alexandrakis MG, Passam FH, Moschandrea IA, et al. Levels of serum cytokines and acute phase proteins in patients with essential and cancer-related thrombocytosis[J]. Am J Clin Oncol, 2003, 26(2):135-140.
[22] Franco AT, Corken A, Ware J, et al. Platelets at the interface of thrombosis, inflammation, and cancer[J]. Blood, 2015, 126(5): 582-588.
[23] Labelle M, Begum S, Hynes RO. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J]. Cancer Cell, 2011, 20(5):576-590.
[24] Buergy D, Wenz F, Groden C, et al. Tumor-platelet interaction in solid tumors[J]. Int J Cancer, 2012, 130(12):2747-2760.
