血清MicroRNA-320c表达对食管鳞癌的诊断价值及临床意义*
2018-04-26马箐丁元杰马山蕊李新庆刘芬魏文强
马箐,丁元杰,马山蕊,李新庆,刘芬,魏文强
100021北京,国家癌症中心/中国医学科学院北京协和医学院肿瘤医院 (马箐、马山蕊、李新庆、魏文强);100069北京,首都医科大学公共卫生学院 流行病与卫生统计学系/北京市临床流行病学重点实验室(丁元杰、刘芬)
食管癌(esophageal cancer,EC)是世界上最常见的恶性肿瘤之一,据GLOBOCAN估计2012年全球约有456 000例新发食管癌病例,400 000例食管癌死亡病例,其发病率居全球恶性肿瘤发病率第8位,死亡率居恶性肿瘤死亡第6位[1]。据我国国家癌症中心统计显示,2014年中国食管癌发病人数为258 000例,发病率为18.85/10万,世标率为12.17/10万;死亡人数为193 000例,死亡率为14.11/10万,世标率为8.75/10万[2]。位于我国太行山脉南部地区的河南省林州市、河北省磁县、涉县和山西省阳城县形成了食管癌的高发区,其食管癌疾病负担居全国前列[3]。
食管癌主要有两种组织类型,鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和腺癌(esophageal adenocarcinoma,EAC)。全球90%的食管癌为ESCC,主要分布在亚洲国家,而西方国家EAC高发。我国食管癌也主要以ESCC为主[4]。食管癌早期症状不典型,70%~80%的食管癌患者确诊时已属晚期[5],5年生存率仅20.9%[6]。食管癌的早期诊治可显著改善患者的预后并降低死亡率[5]。我国自70年代开始,不断探索有效的食管癌筛查方法,目前普遍采用碘染色内镜活组织检查进行食管癌高发区的筛查工作,该检查可显著降低食管癌发病率、死亡率[5],但由于其高成本、高风险、病人依从性差、内镜技术掌握难度大、医源性感染等原因难以大范围推广实施[7]。若可发现适用于食管癌诊断的生物标志物,则对食管癌早诊早治工作具有重要意义。
微小RNA(MicroRNA,miRNA)是一类长约18~24个核苷酸的内源性非编码小分子RNA,可通过负调控靶基因,参与体内的基本信号传导途径。miRNAs分子来源于胞内和胞外,前者存在于组织内,后者由细胞主动分泌至血液、唾液等体液中[8]。相对于组织标本,血清/血浆较易获得,循环外周血miRNAs具有的高度稳定性及组织特异性等优点在早期筛查和早期诊断中可能具有广泛的应用前景[9]。
miR-320c来源于miR-320家族,是众多microRNA的成员之一。近年来,关于组织中miR-320与消化系统肿瘤关系的研究取得了较大进展。由以往研究可知,miR-320可参与调控消化系统肿瘤细胞增殖[10]与凋亡[11]。研究表明,miR-320可能通过抑制细胞周期蛋白依赖性激酶抑制因子P21(CKI)及p57(CDKN1C)的表达,促进双链RNA(dsRNA)结合蛋白Dgcr8缺陷的胚胎干细胞增殖,并可缩短细胞G1期[12]。消化系统肿瘤的发生发展可能伴随着miR-320的异常表达,而关于组织或血清/血浆来源miR-320c与食管癌关系的研究,国内外鲜有报道。本研究采用实时定量RT-PCR技术检测ESCC患者和对照组血清中miR-320c的表达水平,并结合危险因素调查与临床病历资料,探讨miR-320c的表达水平与食管鳞癌发生、发展的关系。
1资料和方法
1.1 研究对象
选取2014年10月至2016年9月河南省林州市肿瘤医院内镜科确诊并于该院治疗的ESCC患者100例,其中男50例,女50例,年龄(59.86±7.80)岁。每位患者均为初诊食管癌患者,无其他肿瘤病史。采取外周血标本前均未行放疗、化疗、生物治疗等任何治疗,病理诊断均为:食管鳞状细胞癌。对照组选取同期食管内镜筛查非ESCC研究对象外周血100例,其中男43例,女57例,年龄(59.02±2.76)岁。
1.2 流行病学调查
对病例组与对照组所有研究对象均采用统一设计的“食管癌早诊早治的研究”调查问卷。由经过培训的专职调查员采用面试方式进行问卷调查。调查内容主要包括:(1)基本信息:姓名、性别、年龄、婚姻情况、受教育程度、家庭人口数;(2)危险因素问卷调查,包括:水源、吸烟、饮酒、饮茶情况、蔬菜、水果、肉蛋奶类、豆类食品、腌晒食品、油炸食品、烫热食品、霉变食品食用情况、消化系统疾病史、肿瘤家族史。收集ESCC组患者临床病历资料,主要包括:发病部位、肿瘤分化程度、TNM分期。TNM分期依据国际抗癌联盟(Union for International Cancer Control,UICC)第7版食管癌TNM判定标准。
1.3 标本采集与处理
采集外周血2mL(采血时间一般为早晨或上午),迅速转入EDTA抗凝管中,涡旋或用移液器混匀。在1小时(室温条件下)或2小时(4℃条件下)内进行:820g,4℃,离心10分钟。吸取约1mL上清转至洁净的1.5mL离心管中,16 000g,4℃,离心10分钟,小心吸取上清到新的离心管中,置于-80℃保存备用。
1.4 qRT-PCR实验
1.4.1 主要试剂与仪器 反转录试剂为Taqman MicroRNA Reverse Transcription Kit (ABI, USA);定量PCR试剂为Taqman Universal PCR Master Mix (ABI, USA);探针:ABI,USA;引物:ABI,USA;定量PCR仪为7900 HT Sequence Detection System (ABI, USA)。
1.4.2 血清总RNA提取 按照血清总RNA提取试剂盒说明书进行:1)2×Denaturing Solution溶液中添加375μL β-巯基乙醇,混匀后备用;2)miRNA Wash Solution 1中添加21 mL无水乙醇,混匀后备用;3)Wash Solution 2/3 中添加40mL无水乙醇,混匀后备用;4)取适量血清(最多可抽625μL,不足100μL时,用Cell Disruption Buffer补至100μL),加入等量的2×Denaturing Solution,涡旋混匀,冰上放置5分钟;5)添加与总体积等量的酚/氯仿,涡旋混匀30~60秒,室温,最高转速离心5分钟;6)小心吸取上清到新的1.5mL离心管中,添加1.25倍体积的无水乙醇,涡旋混匀;7)将洁净的离心柱放置到洁净的收集管中,吸取上一步的液体到柱中,10 000g,室温离心30秒,弃流过液,将离心柱重新放置到收集管中。重复该步骤,直到所有的液体过柱;8)吸取350μL miRNA Wash Solution 1到离心柱中,10 000g,室温离心15秒,弃流过液,将离心柱重新放置到收集管中;9)混合10μL DNase I stock solution和70μL Buffer RDD QIAGEN (#79254)80μL加到离心柱中的膜上,25℃放置15min;10)吸取350μL miRNA Wash Solution 1到离心柱中,10 000g,室温离心15秒,弃流过液,将离心柱重新放置到收集管中;11)500μL Wash Solution 2/3 过柱两次,空柱离心1分钟;12)将离心柱放置到新的收集管中,柱中心加入100μL 95℃预热的Elution Solution 或nuclease-free水,室温最高转速离心20~30秒,收集管中的液体即为提取的总RNA,放置在-70℃保存。
1.4.3 逆转录反应 按照逆转录试剂盒说明书进行逆转录反应,反应体系25μL:100mM dNTPs 0.25μL;Multiscribe Reverse Transcriptase 1.6μL;10×Reverse Transcription Buffer 2.5μL;RNase Inhibitor(20U/μL)0.3μL;5×RT primer(1.6μL/gene)1.6*基因数;RNA+H2O。反应条件:16℃ 30min,42℃ 30min,85℃ 5min,将逆转录反应后产物cDNA,-20℃保存备用。
1.4.4 实时荧光定量PCR 在0.2mL PCR管中配制反应液,反应体系10μL:2×Taqman Universal PCR buffer,UNG 5μL;20×Taqman MicroRNA Assay Mix 0.5μL;Template 0.75μL;H2O 3.75μL。将反应液加入384孔板中。将384孔板置于7900 HT Sequence Detection System中。反应条件:50℃ 2min;95℃ 10min,95℃ 15s,60℃ 1min,40个循环。每个样本做3个复孔,一个或多个复孔未出现数据或复孔间数据差异太大者删除。
记录每个荧光反应管中的荧光信号达到所设定的阈值时所经历的循环数即ct值,将原始数据取3次重复的平均值,以miR-1228为内参,进行归一化,使用定量PCR中的相对定量法,得出△Ct,miR-320c表达量用2-△Ct表示。
1.5 统计学处理
用SPSS 22.0软件进行统计分析。首先进行描述性分析,计算一般人口学资料主要指标,对其进行均衡性检验。计数资料对比采用χ2检验,正态性计量资料采用t检验或方差分析。利用Kolanogorow-Smimov(K-S)正态性检验方法对数据进行正态性检验。通过SPSS正态得分方法对非正态数据进行正态转化,正态转化前miRNAs表达水平以“P50(P25,P75)”形式置于表中, 正态转化后数据以“均数±标准差”形式置于表中。
通过组间基线信息比较,对有统计学差异的基线信息因素进行协方差控制,采用协方差分析进行miR-320c表达量数据对比。应用二元logistic回归模型及ROC曲线进行多变量(多项测量指标)观察值的ROC曲线分析。将协变量纳入二元logistic回归模型,计算求出预测值概率,将此概率纳入ROC模型,进行ROC曲线分析。采用灵敏度、特异度、曲线下面积(area under curve,AUC)评估其诊断效能。采用双侧检验,检验水准为α=0.05。
1.6 质量控制
(1)进行调查员培训:统一调查标准,规范调查技巧,提高工作水平和责任心;病理报告由专业人员单独提供;(2)盲法原则:现场资料收集过程中由于无法避免病例和对照的身份,故由非医学专业背景人员担任调查员,并隐瞒调查的真实目的,避免对回答的判断具有倾向性;在筛检试验评价的整个过程中,为了避免偏倚,也要严格遵循盲法原则;(3)问卷核查:由专职调查员在每次调查后核查问卷的逻辑错误和错、漏信息,并在24小时之内及时进行补充调查;(4)制定生物学样本采集操作规程:严格控制采集的部位、大小、放置时间等,组织样本需病理学检查确认。
1.7 伦理知情
本研究经过医院伦理委员会审查和批准。
2 结 果
2.1 基线信息
实验过程中,所有样本RNA提取成功,质检合格,且每个样本至少一个复孔能检测到miR-320c的表达。排除26例不合格数据后,174例纳入统计分析,其中病例组96例,对照组78例。对照组与食管癌组miR-320c表达量数据均为非正态数据(P<0.001),正态性转换后数据用于后续分析(表1)。

表1 miR-320c原始表达量及正态转化值
病例组与对照组基本信息中,教育程度、水源、吸烟、饮酒、饮茶、肉蛋奶类、烫热食品食用情况在两组中分布不平衡:对照组研究对象受教育程度高于病例组,病例组中有更多的饮用自来水、吸烟、饮酒、饮茶、饮食肉蛋奶类、烫热食品人群(表2)。
通过对病例组患者病历信息的收集,得到病变部位、分化程度、肿瘤TNM分期信息。病例组中食管中段癌(75.0%)、中分化(60.4%)患者居多(表2)。

表2 病例组与对照组基本信息及危险因素调查情况
(转右表)
(接左表)

变量对照组(%)病例组(%)合计检验值P 自来水0(0.0)35(36.5)35吸烟4.4160.036 否61(78.2)61(63.5)122 是17(21.8)35(36.5)52饮酒24.092<0.001 否77(98.7)68(70.8)145 是1(1.3)28(29.2)29饮茶13.004<0.001 否76(98.7)76(79.2)152 是2(2.6)20(20.8)22新鲜蔬菜0.0001.000 很少1(1.3)2(2.1)3 经常77(98.7)94(97.9)171新鲜水果4.6940.097 从不2(2.6)3(3.1)5 很少51(65.4)76(79.2)127 经常25(32.1)17(17.7)42肉蛋奶类14.139<0.001 从不2(2.6)1(1.0)3 很少47(60.3)32(33.3)79 经常29(37.2)63(65.6)92豆类食品1.3560.603 从不0(0.0)1(1.0)1 很少54(69.2)71(74.0)124 经常24(30.8)24(25.0)48腌晒食品1.9520.390 从不9(11.5)12(12.5)21 很少67(85.9)77(80.2)144 经常2(2.6)7(7.3)9油炸食品4.4090.119 从不11(14.1)6(6.3)17 很少65(83.3)83(86.5)147 经常2(2.6)7(7.3)9烫热食品53.120<0.001 从不46(59.0)12(12.5)58 很少7(9.0)51(53.1)58 经常25(32.1)33(34.4)58霉变食品5.0930.077 从不59(75.6)68(70.8)127 很少19(24.4)22(22.9)41 经常0(0.0)6(6.3)6
(续下表)
(接上表)

变量对照组(%)病例组(%)合计检验值P消化系统疾病史0.3080.579 否59(75.6)76(79.2)135 是19(24.4)20(20.8)39肿瘤家族史0.5610.454 否53(67.9)60(62.5)113 是25(32.1)36(37.5)61癌变部位-- 上段-16(16.7)- 中段-72(75.0)- 下段-8(8.3)-分化程度-- 低分化-14(14.6)- 中分化-58(60.4)- 高分化-24(25.0)-期别 -- Ⅰ期-12(12.5)- Ⅱ期-38(39.6)- Ⅲ期-33(34.4)- Ⅳ期-13(13.5)-
*很少:<2次/周;经常:≥2次/周
2.2 病例组与对照组血清miR-320c表达量差异情况
病例组与对照组基线信息中,教育程度、水源、吸烟、饮酒、饮茶、肉蛋奶类、烫热食品食用情况在两组中分布不平衡。以miR-320c表达量正态转换数据作为应变量,将教育程度、吸烟、饮酒、肉蛋奶类、烫热食品食用情况作为协变量,协方差分析控制基线水平的差异,比较病例组与对照组miR-320c表达量的差异情况。结果显示:病例组与对照组miR-320c表达量差异具有统计学意义(P=0.008)(表3)。病例组血清miR-320c表达量高于对照组(图1)。
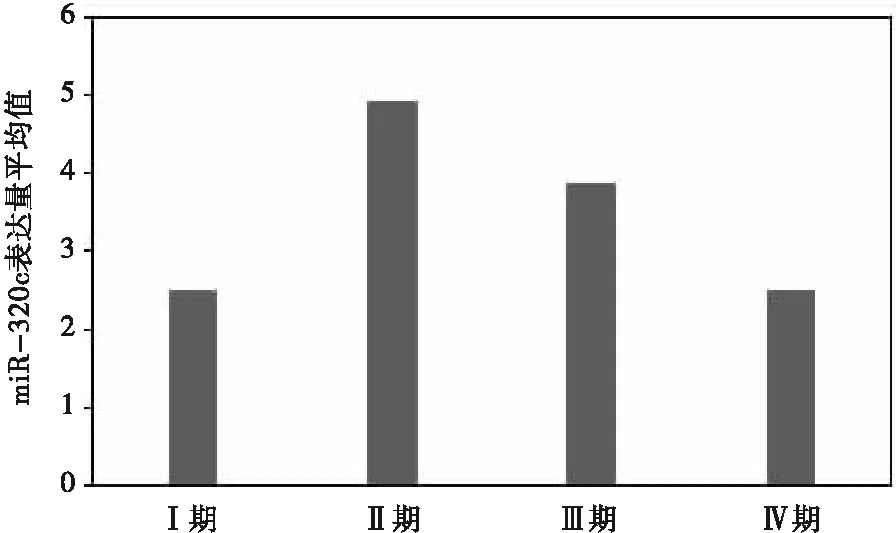
图1 病例组与对照组血清miR-320c表达量平均值
2.3 miR-320c与肿瘤分期、分化程度、发病部位的关系
不同肿瘤TNM分期组间基线信息比较,发现两组婚姻状况、饮茶情况、豆类食品食用情况差异有统计学意义,应用协方差分析控制两组婚姻状况、豆类食品食用情况基线水平的差异。分析显示:组间miR-320c表达量差异无统计学意义(P=0.793)(表3)。但由图B可见,miR-320c表达量在Ⅰ期、Ⅳ期的病例中相对较低,在Ⅱ、Ⅲ期病例中相对高且整体呈现类正态分布的趋势(图2)。

图2 不同肿瘤TNM分期miR-320c表达量平均值
不同分化程度组间基线信息比较,发现组间性别、肉蛋奶类、腌晒食品、烫热食品食用情况差异有统计学意义,应用协方差分析控制基线水平的差异。分析显示:三组间miR-320c表达量差异无统计学意义(P=0.864)(表3)。而由图C可见,miR-320c表达量有随着肿瘤分化程度升高而升高的趋势(图3)。
不同发病部位组间基线信息比较,发现组间油炸食品食用情况差异有统计学意义,应用协方差分析控制基线水平的差异。分析显示:三组间miR-320c表达量差异无统计学意义(P=0.318)(表3)。
表3病例组与对照组、不同肿瘤TNM分期、不同肿瘤分化程度miR-320c表达量差异的协方差分析

因素自由度均方FP病例组与对照组* 矫正模型62.5912.7900.013 组别16.7967.3190.008 教育程度10.3940.4240.516 吸烟10.8090.8710.352 饮酒10.0580.0630.802 肉蛋奶类10.4620.4980.481 烫热食品10.1950.2100.647肿瘤TNM分期* 矫正模型50.4430.5440.742 期别30.2810.3450.793 婚姻状况10.9551.1730.282 豆类食品10.4090.5020.480肿瘤分化程度 矫正模型60.6670.8300.550 分化程度20.1180.1470.864 性别11.5411.9190.169 肉蛋奶类13.0263.7680.055 腌晒食品10.0360.0450.832 烫热食品10.0050.0060.940发病部位 矫正模型39.2860.7950.500 发病部位213.5571.1610.318 油炸食品10.9580.0820.775
*水源、饮茶数据存在较大偏倚,未纳入分析
2.4 多变量ROC分析血清miR-320c对ESCC诊断价值
考虑协变量教育程度、吸烟、饮酒、肉蛋奶类、烫热食品食用情况因素情况下,对174例研究对象的血清miR-320c表达量水平建立多变量ROC曲线(图4),评价miR-320c的诊断价值AUC为0.856(95%CI:0.799~0.912)。当临界值取0.642时,灵敏度和特异度分别为71.9%和87.2%。

图4 miR-320c表达量诊断ESCC的受试者工作特征曲线
3 讨 论
食管癌是世界上最常见的恶性肿瘤之一。目前,我国广泛应用于高发区的碘染色内镜活组织检查,由于其医源性感染难以避免[7],病人依从性差等特点难以大范围推广实施。而外周血标志物检测创伤小,易于被患者接受,其在肿瘤筛查和诊断应用中受到广泛关注。因此寻找可用于诊断食管癌的新型生物标志物具有重要临床意义。
近年来不断有研究证实,外周血miRNAs与食管癌密切相关。血清中的miRNAs具有稳定性,能够抵抗强酸、强碱、高温、高压及RNAase的降解[13]。多数miRNAs具有高度保守性、组织特异性和时序性[14]。血清与血浆中miRNAs表达水平相比,差异无统计学意义(P>0.05)[15],且存在正相关的关系[16],血清/血浆中的miRNAs表达水平不存在性别与个体的差异[17]。相关文献已报道多种在食管癌患者血清中表达异常的miRNAs,Zhang等[18]发现血清miR-10a,miR-22,miR-100,miR-148b,miR-223,miR-133a,miR-127-3p可清楚地区分食管鳞癌患者和正常人,且受试者工作特征曲线下面积在0.8~0.9之间,特异度96%,敏感度78.5%。部分血清/血浆miRNA与食管癌患者TNM分期关系密切,Sun等[19]研究显示,晚期(Ⅲ,Ⅳ期)与早期(Ⅰ,Ⅱ期)ESCC患者血清中miR-367差异表达(P<0.005),且miR-367在晚期患者血清中高表达。ESCC患者血清中miR-613的降低与N分期关系密切[20]。
同样越来越多的研究证实,miR-320与消化道肿瘤密切相关。miR-320参与了肿瘤细胞增殖的调控,Sun等[10]发现在结肠癌中,miR-320通过抑制β-catenin的表达参与肿瘤细胞增殖的调控。同样,miR-320也参与了肿瘤细胞凋亡,Noto等[11]在对致瘤性CagA+幽门螺杆菌(helicobacter pylori,HP)感染后胃癌细胞的研究中则直接证明了miR-320可靶向抑制Bcl-2家族抗凋亡基因Mcl-1 (myeloid cell leukemia-1)的表达促进细胞凋亡。miR-320家族参与了消化道肿瘤的发生、发展,且发挥抑癌作用。然而,关于miR-320c与食管癌关系的研究,国内外鲜有报道。
血清/血浆相对于组织标本更易获得,且外周血miRNAs在早期诊断中可能具有广泛的应用前景[8]。本研究基于此,选取ESCC患者与对照组血清,检测血清miR-320c差异表达情况,探索其在ESCC诊断中的潜在应用价值。本课题是在我国特有的食管癌高发现场河南省林州开展的人群流行病学研究,样本来源于高发区自然人群,并且具有稳定性好, 依从性高的优势,是我国特有的人类生物医学资源库。
本研究结果显示,miR-320c在ESCC患者血清中显著高表达。不同肿瘤TNM分期及不同肿瘤分化程度患者之间血清miR-320c表达量无明显的统计学差异,但由图2可见,miR-320c表达量在Ⅰ期、Ⅳ期病例中相对较低,在Ⅱ、Ⅲ期病例中相对高且整体呈现类正态分布的趋势,此现象可能是因为随着肿瘤的发生发展,miR-320c出现异常表达,并且在肿瘤中期异常表达愈发明显;而由图3可见,miR-320c表达量有随着肿瘤分化程度升高而升高的趋势,但不同肿瘤分期与分化程度间血清miR-320c的异常表达未呈现统计学差异,本研究人员认为可能是由于病例组样本量少,各肿瘤TNM分期、分化程度亚组内样本量过少,未体现出统计学水平上的差异。故miR-320c表达与食管癌肿瘤TNM分期、分化程度关联方面的探究,还需要更大样本量的深入验证及分析。
对食管癌的危险因素研究[21]发现过量吸烟或饮酒是西方国家发生ESCC的主要危险因素,且二者均为剂量依赖性的高危因素,大约90%的ESCC与烟酒相关。饮食中富含水果和蔬菜与鳞癌的危险性降低显著相关。另外研究认为,总体的营养状态较差,特殊的饮食,例如饮用水或发霉的食物中含有的亚硝胺及其前体是食管癌的高危因素。另外也有研究提出, HP感染,胃粘膜萎缩,人乳头瘤状病毒(human papillomavirus,HPV)感染等可能与ESCC的发生有关,但证据并不确切。除环境因素外,ESCC的家族聚集性现象提示遗传因素和表观遗传因素可能在食管癌的发生、发展中也发挥一定的作用[22-23]。故本研究在研究对象入组时,对其基本信息、饮食习惯及家族患癌情况进行调查。经基线信息均衡性分析发现病例组与对照组相关危险因素信息不均衡,考虑此协变量的情况下,利用多变量(多项测量指标)观察值的ROC曲线评价miR-320c的诊断价值。AUC为0.856(95%CI:0.799~0.912),具有一定准确性;当临界值取0.642时,灵敏度和特异度分别为71.9%和87.2%。由此证明,血清miR-320c是较好的诊断标志物,对ESCC患者诊断具有潜在应用价值。
本研究存在一定的局限性:(1)本研究所选取的样本RNA虽然全部提取成功,但为保证数据的准确性,一个或多个复孔未检测到值,或复孔间数值差异太大者予以删除,造成整体数据部分缺失,为了保证组间可比性,本研究采用协方差分析平衡对照组和食管癌组的基线信息,但仍有可能由于数据的缺失造成其诊断价值的过高估计;(2)本研究结果未发现血清miR-320c与患者TNM分期、分化程度之间的关联性,可能与各组样本量过少有关,此方面仍需要多中心、大样本量的探索验证分析;(3)本文对血清miR-320c的诊断价值进行了探讨,虽结果证明其对ESCC患者的诊断价值较好,但仅探讨一种miRNA的诊断价值存在一定的片面性,还需要联合相关其他miRNAs构建更加可靠的诊断模型。并且,作为早期筛查、早期诊断的标志物,其灵敏度、特异度也期待在不同来源的大样本人群中得到进一步的验证;(4)作为探讨初筛标志物的研究,所选全部研究对象应来自自然人群,但本研究食管癌患者取自自行去医院诊治的患者,患者均有明显不适症状,人群过度代表食管癌患者,此方面可能造成诊断价值的过高估计。以上不足希望在之后的研究中弥补。
综上所述,本研究初步判断血清miR-320c作为ESCC诊断标志物具有潜在应用价值,但肿瘤的发生、发展是多种因素协同作用的结果,故还需联合其他生物、遗传、环境等相关因素,进一步进行大样本人群的科学验证。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[参考文献]
[1] Ferlay J. GLOBOCAN 2012: Oesophageal cancer estimated incidence, mortality and prevalence Worldwide in 2012[EB/OL]. http://globocan.iarc.fr,2017-10-12.
[2] Chen W, Sun K, Zheng R, et al. Report of cancer incidence and mortality in different areas of China, 2014[J]. China Cancer, 2018,27(1):1-14.
[3] Wei WQ, Yang J, Zhang SW, et al. Esophageal cancer mortality trends during the last 30 years in high risk areas in China: comparision of results from national death surveys conducted in the 1970’s,1990’s and 2004-2005[J]. Asian Pac J Cancer Prev,2011,12(7):1821-1826.
[4] Essadi I, Lalya I, Mansouri H. Esophageal carcinoma[J].N Engl J Med, 2015,372(15):1470-1471.
[5] Wei WQ, Chen ZF, He YT, et al. Long-term follow-up of a community assignment, one-time endoscopic screening study of esophageal cancer in China[J]. J Clin Oncol,2015,33(17): 1951-1957.
[6] Zheng R, Guo Y, Zhang S, et al. Cancer survival in China, 2003-2005: a population-based study[J]. Int J Cancer, 2015,136(8):1921-1930.
[7] 王洛伟,辛磊,林寒,等.中国消化内镜技术发展现状[J].中华消化内镜杂志,2015,32(8): 501-515.
[8] Park NJ, Zhou H, Elashoff D, et al. Salivary microRNA: discovery, characterization, and clinical utility for oral cancer detection[J]. Clin Cancer Res,2009,15(17): 5473-5477.
[9] Wittmann J, Jack HM. Serum microRNAs as powerful cancer biomarkers[J]. Biochim Biophys Acta, 2010,1806(2):200-207.
[10] Sun JY, Huang Y, Li JP, et al. MicroRNA-320a suppresses human colon cancer cell proliferation by directly targeting β-catenin[J]. Biochem Biophys Res Commun, 2012,420(4): 787-792.
[11] Noto JM, Piazuelo MB, Chaturvedi R, et al. Strain-specific suppression of microRNA-320 by carcinogenic helicobacter pylori promotes expression of the anti-apoptotic protein, Mcl-1[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305(11): G786-796.
[12] Byeong-Moo K, Michael YC.Non-canonical microRNAs miR-320 and miR-702 promote proliferation in dgcr8-deficient embryonic stem cells [J].Biochem Biophys Res Commun, 2012, 426(2):183-189.
[13] Fang C, Zhu DX, Dong HJ, et al. Serum microRNAs are promising novel biomarkers for diffuse large B cell lymphoma[J]. Ann Hematol,2012,91(4): 553-559.
[14] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell,2004,116(2): 281-297.
[15] Zhang Y, Liu D, Chen X, et al. Secreted monocytic miR-150 enhances targeted endothelial cell migration[J]. Mol Cell,2010,39(1): 133-144.
[16] Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A,2008,105(30): 10513-10518.
[17] Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res,2008,18(10): 997-1006.
[18] Zhang C, Wang C, Chen X, et al. Expression profile of microRNAs in serum: a fingerprint for esophageal squamous cell carcinoma[J]. Clin Chem,2010, 56(12): 1871-1879.
[19] Sun J, Song K, Feng X, et al. MicroRNA-367 is a potential diagnostic biomarker for patients with esophageal squamous cell carcinoma[J]. Biochem Biophys Res Commun, 2016,473(2): 363-369.
[20] Guan S, Wang C, Chen X, et al. MiR-613: a novel diagnostic and prognostic biomarker for patients with esophageal squamous cell carcinoma[J]. Tumour Biol,2015,37(4):4383-4391.
[21] Lin Y, Totsuka Y, He Y, et al. Epidemiology of esophageal cancer in Japan and China[J]. J Epidemiol, 2013, 23(4): 233-242.
[22] Wang LD, Zhou FY, Li XM, et al. Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1 and C20 or f54[J]. Nat Genet, 2010, 42(9): 759-763.
[23] 刘芳,谭榜宪,彭小东,等.四川北部地区AGT、XRCC1基因多态性与食管癌风险的关系[J].肿瘤预防与治疗,2016,29(1): 5-11.
