基于详细反应机理的直管中正庚烷燃烧特性研究
2018-04-26黄景怀
黄景怀,王 威
(北京航天动力研究所,北京 100076)
0 引言
液氧/煤油推进剂火箭发动机具有性能高、经济性好、无毒无污染等优点,是国内外重点研究的火箭发动机。真实的煤油组分繁多,交叉反应极其复杂。为了模拟煤油的燃烧反应,需要选择煤油的替代燃料及与之相对应的反应机理。替代燃料的选取需要遵循如下原则[1]:
1)两者热值相近;
2)两者H/C比接近。
正庚烷作为反应机理准确的一种常见烷烃,其与真实煤油的热值与H/C比对照如下:

煤油正庚烷热值(MJ/kg)44144817H/C22228
因此本文对正庚烷的化学反应动力学进行研究以了解长碳链烷烃的反应进程。
化学反应动力学是了解化学反应进程的非常有效的手段。研究化学反应动力学的主要目的是利用数值计算方法建立燃烧模型,从而实现对着火点、燃烧产物的变化的预测。化学反应机理则为燃烧模型的重要组成部分,通常化学反应机理分为四种:单步反应机理、骨架机理、详细机理以及简化机理。其中单步反应机理与骨架机理较为简单。单步反应机理不包括任何中间反应,试图通过一个或者两个方程来描述整个化学反应。骨架机理则涉及不同的组分,相比于单步反应机理要复杂一些,精确度更高。简化机理是在详细反应机理的基础上使用一定的假设简化得来。而详细机理则是最为复杂的,该类型的反应机理试图囊括所有的化学反应细节,因此组分多达数百种,涉及的基元反应多达数千个,由于详细机理尽可能的完整地描述了反应路径,因此研究人员还能够通过详细机理研究燃料之间的相互作用以及添加剂对着火的影响。
图1 正庚烷(n-heptane)分子结构Fig.1 Molecular structure of n-Heptane
正庚烷燃料的氧化过程随着燃烧室内的压力/温度变化而发生改变。其变化过程分为三个阶段:低温阶段:在此阶段内,反应速率随着温度的增加而逐渐上升;过渡阶段:在此阶段内,随着温度的增加,反应速率有所下降,即所谓的低温氧化阶段内的“负温度系数”(NTC)现象;高温阶段:在此阶段内,随着温度的继续升高,反应速率进一步加快,生成大量的烯烃和H2O2,在温度足够高时,H2与O2的分支反应决定了总的反应速率。
1 计算模型
利用详细正庚烷/空气燃烧反应机理对直管内的燃烧反应进行研究,得到了火焰附近一维的火焰结构;通过改变直管表面与空气之间的对流换热系数,得到了不同散热条件下燃烧器的工作特性,如温度分布、组分分布、燃烧效率等等。针对直管型燃烧器,研究了一维预混燃烧器中的化学反应。如图2所示。
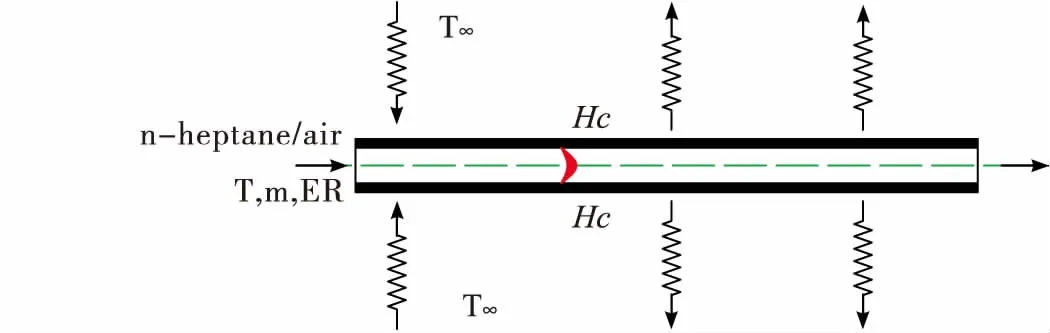
图2 直管燃烧器的一维计算模型Fig.2 1-D calculation model of straight tube combustor
在计算的过程中本文采用柱塞流模型(PFR),即假设流动是稳态的,在流动的径向方向各种物质分布均匀,在轴向上仅存在对流作用;流动为一维的,流体也为理想气体,忽略质量传递的影响。模型中所涉及到的控制方程包括质量守恒方程、气体组分守恒方程、能量方程以及动量方程:
动量方程
(1)
式中:p为绝对压力;F为气体作用在管壁上的摩擦力。
能量方程
(2)
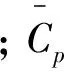
质量守恒方程
(3)
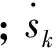
气态组分守恒方程
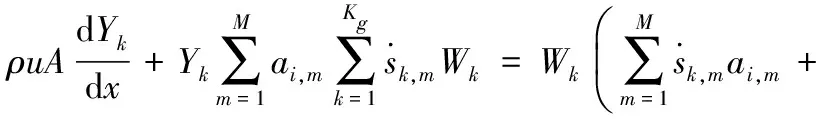
(4)
计算过程中使用了Lawrence Livermore Nation Laboratory (LLNL)开发的简化正庚烷/空气反应机理,机理中包含160种物质,1 540个基元反应。之前的研究人员利用此反应机理对各种装置进行了研究,并取得了大量的成果,显示该反应机理能够很好地模拟正庚烷的燃烧化学反应[2-3]。计算中所需要的参数包括各种物质的输运特性、热物性等。
在模型中,正庚烷/空气混合气从模型的左端进入燃烧器中。火焰稳定在直管燃烧器中,燃烧过程为稳态。在计算的过程中,所涉及的边界条件包括:质量流量(4.32 mg/s),当量比(1.78),入口温度(1 060 K),入口压强为1 atm。边界条件对于燃烧的影响在本文中进行了探讨。在燃烧化学反应中,热量的产生与化学反应进程有很大的关系,同时化学反应进程也受到温度的影响。燃烧器外部空气温度为300 K,对流换热系数Hc=50 W/m2-K,燃烧器壁面的热容量为0.077 cal/cm-K。模型总的网格数为5 190。计算过程采用CHEMKIN程序包完成。
2 结果分析与讨论
2.1 一维火焰结构
图 3为火焰附近温度以及重要的且性质相对稳定几种物质的变化曲线,包括CH4,CO,CO2,H2O,OH,H2O2,O2和H2等。在预混气体中,正庚烷逐渐转化为较小的分子,同时释放出大量的热量,提高了气体温度。在预热区域,CO,CO2,H2O以及H2的含量迅速地由0变化到一个较高的数值,CO与H2的含量在火焰附近达到最大;在火焰下游,CO的含量逐渐上升,而H2含量在一个短暂的下降后保持了稳定。在火焰下游,CO2与H2O的梯度非常大,显示在此处的放热非常强烈。在火焰下游,CO2的含量逐渐上升,而H2O则有所下降。在正庚烷的氧化还原反应中,伴随着燃烧产物的生成,还有大量的中间产物的出现,如OH自由基,H2O2,H2与CH4分子等。中间产物随着流动的进行继续发生化学反应,含量下降,某些性质更加稳定的中间产物在出口处仍有极低的残留。
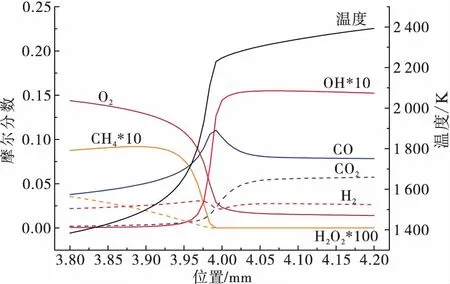
图3 正庚烷燃烧反应区及附近的火焰结构:mf=0.45 mg/s,ER=1.2,Hc=500 W/m2-KFig.3 Flame structure at and near n-Heptane combustion reaction zone as mf=0.45 mg/s,ER=1.2 and Hc=500 W/m2-K
经过计算,可以得到对反应速率影响最大的5个基元反应:
H+O2=O+OH
(R15)
CH3+HO2=CH3O+OH
(R43)
C3H6+H2=iC3H7+H
(R318)
C3H5-a+HO2=C3H5O+OH
(R599)
nC7H16+H=C7H15-3+H2
(R1071)
在正庚烷的燃烧过程中,气体温度与小分子产物有着很大的关系。小分子的中间产物消耗速度非常快。分析结果表明,正庚烷分子在火焰前的区域内即被脱氢反应快速地消耗掉,同时脱氢反应的产物在火焰前区域内进一步分解。较大的有机物分子进一步反应生成各种烷基自由基,并通过β位断链最终形成C1到C4的各种有机物。从表中可以看出,对总的反应进程影响最大的是H分子与O2分子的转化(R15:H+O2=O+OH),该反应也是OH的最主要的产生途径。而其他反应也在燃烧的过程中发挥着巨大作用,包括正庚烷的脱氢(R1071)、C3分子的转化(R318和R599)以及C1分子的转化等(R43)
2.2 入口参数对直管中燃烧反应的影响
在直管中,气体的流动状况对直管的影响十分显著,气体的流动情况构成了直管的边界条件。因此本节重点讨论了不同边界条件下直管中的燃烧状况。
图 4为燃烧器直管上的温度分布。图中当量比ER=1.2,改变燃料流量mf能够对温度分布产生影响。在ER不变的情况下,燃烧过程中气体的最高温度能够保持基本不变。而mf的增加直接改变了总的气体流量以及气体流速,因此能够使火焰向下游移动。从图 4中可以看出,在其他条件不变的情况下,温度最大值位置在mf的作用下逐渐偏向下游。通过对火焰位置进行分析,可以得到火焰位置与燃料流量之间的关系为KT=x/mf=14.22 m·s/g。图中所涉及到的模型并非绝热模型,因此在火焰的下游气体温度逐渐降低,且mf越大,温度的下降速率相对越慢。温度的下降速率可以以斜率来表示,温度斜率与mf的关系为PT=mf·(dT/dx)=10.43 K·g/m·s。
本节针对mf以及ER对燃烧效率η的影响进行了较为详细的研究。在计算η的过程中,需要综合考虑CO,H2,CH4以及C2H4的变化(式(5))。
(5)
图5为直管在各个状态下的燃烧效率的变化,图中横坐标为ER,不同的曲线指示相应的mf。从图中可以看出,随着ER的增加,燃料更加变得燃烧不完全,η从1.0逐渐降低至0.56。在ER<1.0时,η保持不变,此时燃烧较为完全,而在ER>1.0时逐渐下降。需要注意的是,当mf不同时,η的变化规律也有所变化:当mf=0.45 mg/s时,ER<1.0时η变化很小(接近于1.0),在ER继续增加后快速下降。mf增加时,η要更小一些,且从一开始变开始逐渐随着ER而下降。在曲线的两端,即ER=0.5与ER=1.5时,各个mf下燃烧效率较为接近。在直管中,相同的ER条件下,mf的增加能够提高气体的流动速度,从而减小混合气在直管内的停留时间,导致η的降低。
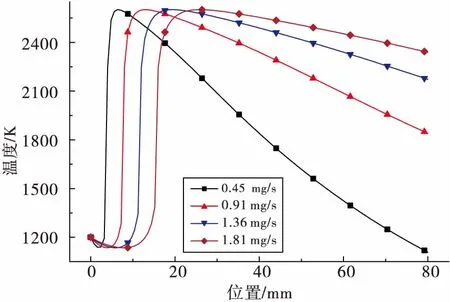
图4 轴线温度随着燃料流量的变化:当量比ER=1.2Fig.4 Variation of axes temperature with fuel mass flow rate (mf) as ER=1.2
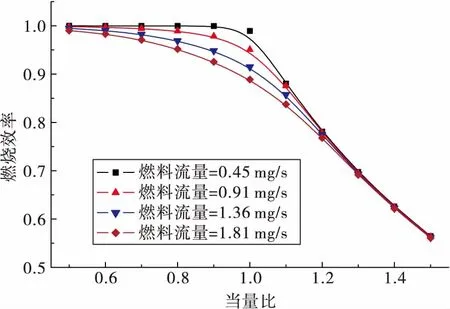
图5 直管中各个状态下的燃烧效率Fig.5 Combustion efficiency in straight tube in various states
2.3 对流换热系数对直管内燃烧的影响
本节分析了不同的壁面对流换热系数对燃烧的影响,其值由0 变化到 360 W/m2-K,即从绝热状态逐渐增加到火焰熄灭的状态。燃烧器的入口参数保持不变。
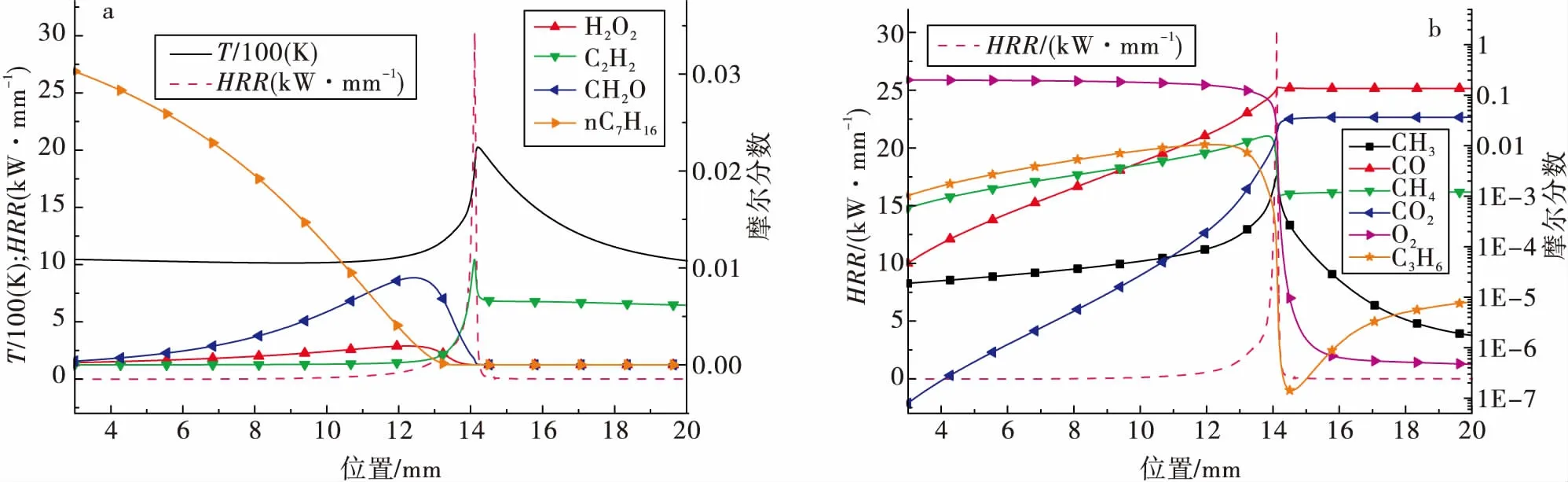
图6 火焰结构主要成分以及热量释放率:对流换热系数Hc=200 W/m2-KFig.6 Flame structure near n-Heptane combustion flame,major components and heat release rateas convective heat transfer coefficient Hc=200 W/m2-K
在本节中,通过仿真得到了对流换热系数为200 W/m2-K时,正庚烷燃烧火焰附近更加详细的火焰结构,包括主要的燃烧中间产物以及热量释放率(HRR)。在预热区域内,正庚烷与O2逐渐被消耗,并转化为C2H4,H2O2与 CH2O等主要产物,由于碳链的断裂需要吸收能量,因此温度有所降低,于此同时HRR逐渐上升。燃料分子分解后形成CO与CH4等。在火焰后区域,HRR快速上升,气体温度也达到最大值。在气体温度作用下,CH3自由基大量产生于火焰预热区内,而在火焰后区域内被快速消耗。从图 6 (b)中可以看出,C3H6在火焰区域内被快速消耗掉,之后则保持稳定,在这两个区域内,小分子的重组与生成是非常剧烈的。从火焰结构中(图 6)可以看出,在相同状况下,火焰的峰值位置与热量释放率(HRR)的峰值位置较为接近。在直管中,HRR反映了化学反应过程中的能量状况,因此HRR的增加一般会导致温度的上升。
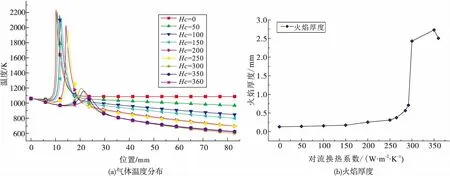
图7 对流换热系数(Hc)对直管内沿轴向的气体温度分布以及火焰厚度的影响Fig.7 Influence of convective heat transfer coefficient (Hc) on gas temperature distribution along axis of straight tube and flame thickness
随着对流换热系数的上升,燃烧器通过外表面向大气损失的热量也逐渐上升。图 7(a)为不同Hc下,直管内气体的温度分布。随着Hc的增加,气体温度也随之下降。前文中提到不同的基元反应对于燃烧的影响是不同的,具体而言,在较低的气体温度下,H2O2大量生成,而在较高的温度下,H2O2被分解,同时产生较多的热量[ ]。若是气体温度在热量损失的作用下快速下降,则直管内的反应速率降低。从图 7(a)中还可以看出不同工况下气体温度峰值的变化。随着Hc的增加,气体温度峰值的数值也逐渐下降,当Hc>300 W/m2-K时,温度峰值小于1 193.2 K (1 078.2 K);而当Hc=360 W/m2-K时,直管内进行的是低温氧化还原反应。此外,图 7(b)为火焰厚度的变化。火焰厚度由式(6))给出[3-5]。火焰厚度能够在一定程度上反映火焰结构,帮助研究人员了解火焰的燃烧以及传输特性,其中Tu与Tb分别为未燃气体与燃气的温度。分析表明,随着温度的下降,火焰厚度逐渐增加。在Hc=250 W/m2-K时,火焰厚度仅为0.3 mm。而在反应减弱的情况下,火焰厚度明显增加。当Hc=350 W/m2-K时,火焰厚度上升至2.7 mm。在火焰被拉伸时,热量损失加剧,更加容易熄灭。
(6)
图 8为不同Hc下直管轴线上的CH3与C3H6的分布。这两种物质的分布情况与R43以及R318紧密相关,对其进行考察能够用于预测总的化学反应速率。图 8(a)中显示,当Hc<250 W/m2-K时,即使是不同的Hc,CH3摩尔浓度在每个工况下的最大值也没有很大的变化,但峰值的位置仍向下游移动。然而当Hc>300 W/m2-K时CH3的摩尔浓度峰值急剧下降,仅为Hc=250 W/m2-K时的1/14,很显然,此时R43的反应速率比较低。图 8(b)中为C3H6的分布状况。不同于CH3,在Hc<250 W/m2-K时,C3H6在火焰区域内被完全消耗掉了,但是在火焰下游,由于化学平衡的作用,其摩尔分数有所上升。当Hc>300 W/m2-K时,C3H6消耗的很少,且在产物中仍有大量的残留。

图8 CH3与C3H6沿轴向上的摩尔浓度分布Fig.8 Molar axis concentration distribution of CH3(a) and C3H6(b)
3 结 论
利用正庚烷的详细化学反应机理,对直管进行了数值研究。正庚烷碳链较长,燃烧反应复杂,使用CHEMKIN程序计算了不同条件下,正庚烷在直管中的一维火焰结构、不同入口条件下的燃烧特性等。主要结论有:
1)正庚烷在火焰预热区之前便已消耗完并转化为其他物质,在预热区与反应区内有大量中间产物参与反应,并最终转化为产物,另有极少量中间产物残留并流动到火焰下游。在燃烧反应中,R15(H+O2=O+OH)对燃烧的影响最大。
2)固定当量比时,直管内的火焰温度保持不变,火焰位置与燃料流量之间的关系为KT=x/mf=14.22 m·s/g,火焰下游温度变化斜率与mf的关系则为PT=mf·(dT/dx)=10.43 K·g/m·s。在mf较小时,燃烧效率随着ER的增加在开始时保持稳定,并在ER>1.0后逐渐下降;而mf较大时,燃烧效率从一开始便逐渐下降。
3)随着对流换热系数的上升,直管内气体温度逐渐下降,而在Hc进一步增大到300 W/m2-K后,火焰无法维持。直管内的火焰厚度随着Hc的上升而逐渐增加。Hc=250 W/m2-K作为一个分界线,燃烧器的工作状态在此前后表现地完全不同。在大于此数值时,CH3与C3H6的反应较为微弱。
参考文献:
[1] 薛诚尤,聂万胜,何博.基于基元反应的总包机理建模及算法优化[J].火箭推进,2015,41(1):36-42.
XUE Chengyou,NIE Wansheng,HE Bo.Modeling and algorithm optimization of global reaction mechanism based on elementary reaction[J].Journal of rocket propulsion,2015,41(1):36-42.
[2] CURRAN H J,GAFFURI P,PITZ W J, et al.n-heptane,detailed mechanism,version 2 [EB/OL].[2017-11-27].https://combustion.llnl.gov.
[3] KATTA V R,AGGARWAL S K,ROQUEMORE W M.Evaluation of chemical-kinetics models for n-heptane combustion using a multidimensional CFD code[J].Fuel,2012,93:339-350.
[4] WESTBROOK C K.Chemical kinetics of hydrocarbon ignition in practical combustion systems[J].Proceedings of combustion institute,2000,28(2):1563-1577.
[5] VOSS S,MENDES M A A,PEREIRA J M C.Investigation on the thermal flame thickness for lean premixed combustion of low calorific H2/CO mixtures within porous inert media[J].Proceedings of combustion institute,2013,34(2):3335-3342.
[6] SOIKA A,DINKELACKEN F,EIPETRZ A.Measurement of the resolved flame structure of turbulent premixed flames with constant Reynolds number and varied stoichiometry[J].Symposium (international) on combustion,1998,27(1):785-792.
[7] O′YOUNG F,BILGER R W.Scalar gradient and related quantities in turbulent premixed flames[J].Combust flame,1997,109(4):682-700.
