大型艾美耳球虫生物学特性研究
2018-04-25柳南星方素芳顾小龙魏香蒲梁淑珍张丽云李慧峰
柳南星,方素芳,顾小龙,魏香蒲,梁淑珍,张丽云,李慧峰,崔 平*
(1.河北北方学院动物科技学院,河北张家口 075000;2.张家口市经开区农委,河北张家口 075000)
兔球虫病是由一种或数种艾美耳属(Eimeria)兔球虫感染兔后引起的一种寄生虫病[1],感染率高,危害大,尤其对断奶至3月龄仔兔影响严重,主要引起腹泻、消瘦、生长缓慢[2],甚至导致死亡,给养兔业带来重大损失[3]。兔球虫既可单独致病,也可与大肠埃希菌,沙门菌、产气荚膜梭菌、轮状病毒等肠道病原体混合感染,引起较高的发病率和病死率,是当前对我国养兔业危害较大的病原之一[4]。
大型艾美耳球虫(E.magna)是引起兔球虫病的主要球虫种类之一[5],会阻碍生长,降低饲料转化率,造成严重的经济损失。对该种球虫的研究,国内外报道甚少,且大多是在混合感染下的研究[6-7]。本研究拟采用不同剂量的纯种卵囊感染无球虫兔,从临床表现、增重及排卵囊量等方面对大型艾美耳球虫的生物学特性进行研究,为下一步选用本原始株选育早熟株奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物 无球虫兔,用河北北方学院动物寄生虫实验室自行繁育的24日龄断奶仔兔,提供经烤箱高温烘烤的兔饲料,并在饲料中添加40 mg/kg莫能菌素抗球虫药,自由饮水,应用饱和盐水漂浮法对粪便进行检测,检测不到球虫卵囊即为合格。试验前分笼、停药1周,并单笼饲养。
1.1.2 虫种 河北北方学院动物寄生虫实验室分离、保存的大型艾美耳球虫虫种。
1.1.3 抗球虫药物 莫能菌素(monensin),湖北远成原料添加剂有限公司产品;地克珠利(diclazuril),四川恒通动物制药有限公司产品;氯苯胍(robenidine),北京生泰尔生物科技有限公司产品。
1.2 方法
1.2.1 潜隐期、最短孢子化时间及卵囊大小的测定 将大型艾美耳球虫孢子化的卵囊接种给无球虫兔,接种后清理兔的粪便并粪检,5 d后每2 h检查1次粪便中是否有卵囊排出,直至查到有卵囊为止,即为潜隐期;在卵囊孵化时,每隔2 h~3 h吸出少许进行镜检,观察发育过程并确定卵囊的孢子化时间,每次观察不少于100个卵囊,在400倍显微镜下数码显微照相,单位以微米(μm)计。
1.2.2 致病性、免疫原性的试验分组及感染 将50只无球虫兔分8组进行试验,1组~7组为感染组(每组6只兔),各感染组每只兔分别接种孢子化卵囊1×102(第1组)、1×103(第2组)、5×103(第3组)、1×104(第4组)、3×104(第5组)、5×104(第6组)和1×105(第7组),第8组为不感染对照组(8只兔),25 d后,除对照组中的4只兔外,其余兔均给予3×104个原始株卵囊的攻虫量,每只兔每天称重1次。卵囊排出量分2次测算,第1次为首次接种后6 d~18 d,第2次为攻毒后7 d~15 d,增重量通过方差分析进行比较。
根据临床症状、体重、卵囊排出量的变化、病理剖检时眼观变化,从而确定大型艾美耳球虫的致病性与免疫原性。
临床:每天观察和记录各组兔的粪便情况、精神状态、食欲、饮欲等。
体重:每天对各组试验兔逐一称重,计算每组兔体重增长情况,并制表记录。
卵囊计数:自排卵日起,收集各组兔粪便,用麦克马斯特法(McMaster’s)计算每天每克粪便卵囊数(OPG),直到卵囊全部排完为止,制表记录。
剖检:肉眼观察各组在不同时间内肠管的病理变化。
1.2.3 对3种抗球虫药的药敏试验 将25只无球虫兔随机分为5组,每组5只,并编号,各组兔体重经t检验,差异不显著(P>0.05)。1组、2组、3组为人工感染组。4组(为感染不用药对照组)饲喂常规饲料,5组为不感染不用药空白对照组,1组饲喂添加莫能菌素40 mg/kg饲料,2组饲喂添加地克珠利1 mg/kg饲料,3组饲喂添加氯苯胍50 mg/kg饲料。饲喂含药饲料3 d后,所有试验兔称重记录,感染组兔每只接种1×104个孢子化卵囊。当有球虫卵囊排出时,收集粪便,McMaster’s法计数每克粪便卵囊数(OPG),记录各组兔耗料量,并计算每只兔平均耗料量和料肉比。
2 结果
2.1 大型艾美耳球虫的形态观察
大型艾美耳球虫原始株呈卵圆形,大小为35.7 μm±1.67 μm×24.5 μm±1.47 μm,卵囊形状指数为1.46±0.10。卵膜孔十分明显,呈堤状突出于卵囊壁之外,卵囊内有一个明显的外残体,孢子囊有斯氏体,内有一个呈颗粒状的内残体(图1)。
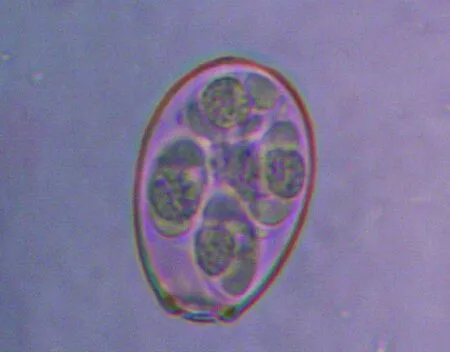
图1 分离得到的大型艾美耳球虫孢子化卵囊 (400×)Fig.1 Sporulated oocyst of Eimeria magna isolated(400×)
2.2 大型艾美耳球虫的潜隐期和孢子化时间
大型艾美耳球虫原始株的潜隐期为168 h,27℃下经过37 h后30%卵囊孢子化,42 h后85%卵囊孢子化。
2.3 致病性
2.3.1 不同接种剂量的每日排卵囊及总产卵囊量 除对照组外,各试验组均在接种后的6 d~7 d开始排卵,高剂量感染组卵囊出现的稍晚点,且高峰后排卵囊量突然下降。各组均在排卵后第3~4天卵囊排出达高峰,持续11 d~12 d后排卵基本结束。不同接种剂量试验兔的卵囊排出总量不同,其中接种5 000个孢子化卵囊排卵囊量最多为4.47×108,其次为100、1 000,接种30 000个卵囊的试验组兔排卵最少为2.54×108(图2和图3)。

图2 不同接种剂量的每日排卵囊量Fig.2 Daily oocyst outputs after inoculation with different doses
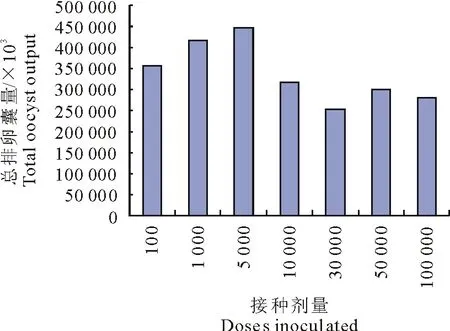
图3 不同接种剂量的总产卵囊量Fig.3 Total oocyst outputs after inoculation with different doses
2.3.2 临床症状 感染初期,各试验组兔精神、饮食欲均无明显的异常。感染后第3天,各组试验兔均表现不同程度的临床症状。其中,1、2、3组食欲基本正常,粪便变化不明显;4、5组感染后第4~5天食欲稍减退,饮欲亦减少,粪便在第5~7天时稍软,第9天后开始恢复,第14天时饮食和粪便基本恢复正常。6、7组在感染后第4~5天,2组兔精神沉郁,被毛蓬乱无光泽,饮欲、食欲减退,甚至废绝,在第6天接种10万卵囊的兔有死亡,剖检出现典型的大型艾美耳球虫病变。第6~9天时接种兔排软粪及稀粪,第10天后开始好转,食欲和饮欲都逐渐增加,但仍排稀软粪便,第12天以后食饮欲、粪便基本恢复正常。在整个试验过程中,对照组兔食欲正常,精神状态一直良好,粪便球形,颜色正常。大剂量接种组死亡2只兔,死亡率50%。
2.3.3 体重变化 对照组:体重一直呈上升趋势。
接种100个卵囊组:在感染后第4天和第8天出现2次体重下降,随后即恢复正常。
接种1 000个卵囊组:在感染后第7天、第8天出现体重下降,随后恢复正常。
接种5 000个卵囊组:在感染后第8~10天连续3 d体重下降,随后即恢复正常。
接种10 000个卵囊组:在感染后第7~8天出现下降,然后逐渐恢复正常。
接种30 000个卵囊组:感染后第8~9天出现下降,以后逐渐恢复。
接种50 000个卵囊组:在感染后第7~9天连续3 d出现体重下降,以后逐渐恢复正常。
接种10万个卵囊组:在感染后第5~9天体重出现下降,第10天开始回升,但生长较缓慢。
体重变化情况,详见图4。

图4 不同接种剂量的体重变化Fig.4 Weight gain changes with different inoculation doses
2.3.4 病理剖检变化 死亡兔剖检时可见肠壁血管充血,肠黏膜充血并有点状出血(图5)。有大量黏液和气体于肠道中(图6)。空肠、回肠黏膜抹片可见不成熟的卵囊,内容物抹片可见肠道中脱落的成熟卵囊(图7)。
综上所述,大型艾美耳球虫原始株的致病性较强,能够产生明显临床症状,严重影响家兔正常发育。
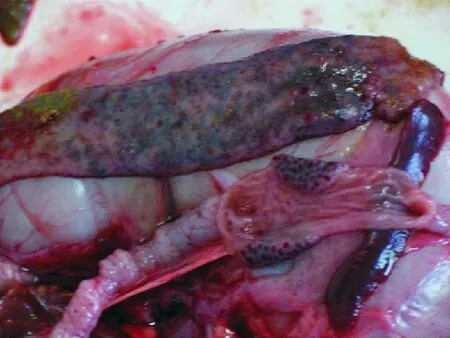
图5 肠壁血管充血,肠黏膜充血并有点状出血Fig.5 Congestion of intestine wall,intestine mucosa congestion and petechial hemorrhage
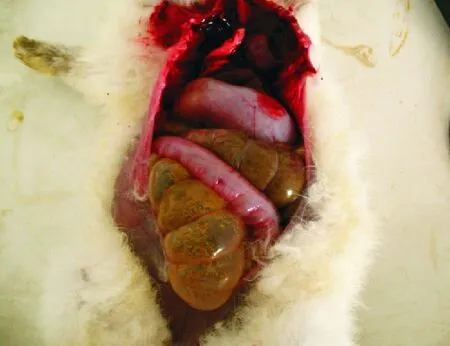
图6 肠道内充满气体和大量黏液Fig.6 Intestine lumen filled with gas and plenty of mucous

图7 肠道内容物抹片可见的成熟卵囊(400×)Fig.7 Mature oocysts on intestinal content smear (400×)
2.4 免疫原性
2.4.1 临床症状及体重变化 低剂量免疫(100个卵囊)可以对30 000个卵囊的攻毒产生完全的保护力。免疫组的兔粪便正常,精神状态,饮欲食欲良好,不免疫攻毒组的兔出现拉稀,精神委顿,食欲不振,平均增重出现负值,与不免疫不攻毒组差异极显著(P<0.01),死亡率为11%。100个/只免疫组增重与不免疫不攻毒组差异不显著(P>0.05)。
试验过程中发现,免疫组在攻虫4 d~10 d后,增重量显著降低(P<0.01),但未出现腹泻症状,这证明了先前接种的效果。第17天出现增重补偿效应。阳性对照组与先前至少接种1 000个原始株组的卵囊在增重上无显著差异(P>0.05)。观察到先前接种30 000、50 000、100 000个卵囊的兔组,攻虫后增重不显著(图8)。

图8 攻毒后不同接种剂量的增重Fig.8 Weight gain after challeng with different inoculation doses
2.4.2 卵囊排出量 不同虫量免疫攻虫组的OPG均很低,明显低于不免疫攻虫组,甚至不排卵,呈完全保护,免疫原性良好。
2.5 对3种抗球虫药的药敏特性
莫能菌素组、地克珠利组和不感染不用药对照组兔在整个试验期间采食、粪便、精神状态未见异常,生长较快,未出现死亡。氯苯胍组和感染不用药对照组兔在试验中陆续出现食欲下降,采食量减少,精神沉郁,继而出现腹泻,特别是感染不用药对照组最后腹泻加重(个别伴有腹胀),食欲更差以至废绝,粪少,兔体消瘦。第10天起兔拉稀逐渐减轻,精神状态有所好转,采食量也开始增加,未出现死亡,但至试验结束时,感染不用药对照组比用药的各个试验组的兔被毛蓬乱,体质消瘦。
在试验期间除空白对照组,各试验组在感染第7天均有卵囊排出,第10天达到高峰。结果表明,所选药物对大型艾美耳球虫原始株均不是高度敏感,相比之下莫能菌素抑制卵囊排出效果较好,地克珠利次之,氯苯胍最差。
在试验期间各组兔相对增重率由大到小依次是莫能菌素组99.1%,地克珠利组68.3%,氯苯胍组61.3%,感染不用药组59.8%;莫能菌素组兔的平均增重与不感染不用药对照组比较差异不显著(P>0.05),地克珠利组和氯苯胍组与不感染不用药组比较差异极显著(P<0.01)。说明莫能菌素能够较好地抑制大型艾美耳球虫对家兔生长发育的影响。
平均饲料转化率,即所消耗饲料量与增重量的比,由低到高分别为莫能菌素组1.50%、地克珠利组1.92%、氯苯胍组2.16%,均高于感染不用药组2.39%。说明莫能菌素对大型艾美耳球虫的治疗效果最好,家兔的生长发育最佳。详细结果见表1。
综上所述,大型艾美耳球虫原始株对莫能菌素最为敏感,地克珠利次之,氯苯胍最差。

表1 大型艾美耳球虫原始株对3种抗球虫药的敏感性
3 讨论
3.1 形态、潜隐期、孢子化时间
本研究中的大型艾美耳球虫原始株形态大小与文献中报道的基本一致,最小潜隐期可以作为鉴别在同一宿主体内不同虫种的依据[8]。同样,在相同条件下,最短孢子化时间也可作为种的特征。本试验测得大型艾美耳球虫最小潜隐期168 h;在25 g/L重铬酸钾液、27℃恒温条件下,最短孢子化时间为37 h。不同研究者对大型艾美耳球虫潜隐期测定值不尽相同,说明不同地理株可能存在一定差别,也可能和试验条件有关。
3.2 致病性
不同种的兔球虫具有不同的致病力,如穿孔艾美耳球虫(E.perforans)只有2代裂殖生殖,致病力较弱[9],而大型艾美耳球虫具有4 代裂殖生殖,致病力较强。感染大型艾美耳球虫卵囊引起的部分临床症状与Ryley报道的基本相同。试验组的体重均下降,推测是由于孢子化卵囊进入机体发生裂殖生殖破坏上皮细胞所致,球虫感染时的体重下降,在很多研究中都有报道[10-12]。
3.3 免疫原性
目前,对于兔球虫免疫原性的鉴定,主要是以免疫兔攻虫后的临床症状、增重水平及卵囊排出量3个方面的指标来衡量。Pakandl M[13]将11个种的兔球虫免疫原性进行划分,其中肠艾美耳球虫具有强免疫原性,中型艾美耳球虫、大型艾美耳球虫及无残艾美耳球虫具有中等免疫原性,而黄艾美耳球虫和梨形艾美耳球虫则被认为免疫原性较差[14]。本试验的结果与Pakandl M的划分相一致,大型艾美耳球虫原始株具有良好的免疫原性。
3.4 药敏特性
根据临床表现、排卵量、饲料转化率,试验用的3种抗球虫化学药物中,莫能菌素对大型艾美耳球虫原始株有良好效果,可作为防治家兔感染大型艾美耳球虫的首选药之一,但不属于高效抗球虫药[15],这与周文江等[16]等报道莫能菌素为高效抗球虫药在效果上有差别,可能与接种的虫种有关。地克珠利、氯苯胍无论是抑制卵囊排出、饲料转化率都较差,这与殷佩云[17]的结论相一致。
参考文献:
[1] 蒋 磊,刘庆梅.兔球虫病的诊断与防治[J].当代畜牧,2017(2):20-21.
[2] 姚 丽.家兔球虫病的综合防治技术探究[J].农技服务,2016(17):108.
[3] 马文顺.兔球虫病的诊断与治疗[J].中国畜牧兽医文摘,2016,32(4):218.
[4] 王 丹,焦雅清,李 超,等.不同日龄家兔对2种兔球虫易感性的对比研究[J].寄生虫与医学昆虫学报,2014,21(4):249-252.
[5] Kornas S,Kowal J,Wierzbowska I,et al.The Alice -"Follow the White Rabbit" -parasites of farm rabbits based on coproscopy,Ann[J].Parasitol,2015,61:257-261.
[6] 史晓春,林昆华.兔大型艾美耳球虫的致病性、临床及病理组织学研究[J].北京农业大学学报,1995,21(3):341-348.
[7] 闫文朝,王天琦,索 勋,等.家兔球虫病的研究进展[J].中国兽医科学,2010,11(40):1200-1205.
[8] 陈美珍,张 嘉,王寿昆,等.福建某獭兔场兔艾美耳球虫感染情况调查及种类鉴定[J].中国畜牧兽医,2015,42(8):2204-2209.
[9] 石团员,魏 巍,付 媛,等.穿孔艾美耳球虫、点滴复膜酵母与兔腹泻的关系[J].浙江农业学报,2015,27(2):160-164.
[10] Tao G, Wang Y, Li C,et al.High pathogenicity and strong immunogenicity of a Chinese isolate ofEimeriamagnaPérard,1925[J].Parasitol Int,2017,66(3):207-209.
[11] Tao G, Shi T, Tang X,et al.TransgenicEimeriamagnaPérard,1925 displays similar parasitological properties to the wild-type strain and induces an exogenous protein-specific immune response in rabbits (OryctolaguscuniculusL.)[J].Front Immunol,2017,8:2.doi: 10.3389/fimmu.2017.00002. eCollection 2017.
[12] Shi T,Tao G,Bao G,et al.Stable transfection ofEimeriaintestinalisand investigation of its life cycle,reproduction and immunogenicity[J].Front Microbiol,2016,7:807.
[13] Pakandl M.Coccidia of rabbit:a review[J].Folia Praha,2009,56(3):153-166.
[14] Pakandl M, Hlásková L, Poplstein M,et al.Immune response to rabbit coccidiosis:a comparison between infections withEimeriaflavescensandEimeriaintestinalis[J].Folia Parasitol,2008,55 (1):1-6.
[15] 陶鸽如,刘贤勇,索 勋.常用抗兔球虫药物的应用及问题分析[J].寄生虫与医学昆虫学报,2014(4):286-291.
[16] 周文江,周新初.球佳治疗兔球虫病的效果[J].上海实验动物科学,1998,18(2):107-108.
[17] 殷佩云.人工感染肠艾美耳球虫的药物预防试验[J].中国兽医杂志,2005,16(10):14-15.
