4株番木瓜根际解磷细菌发酵条件优化研究
2018-04-25吴海波王樱潼叶维雁刘惠民
吴海波 王樱潼 叶维雁 刘惠民
(1. 西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224;2. 广西壮族自治区亚热带作物研究所,广西 南宁 530001)
磷在植物的生长和发育过程中具有非常重要的作用,植物所需的磷只能通过其根系进行吸收,土壤中存在的根际细菌被认为是有效的解磷微生物[1]。土壤里90%以上的磷都是难溶性磷,基本不能够被植物吸收和利用,而化学磷肥的使用又无法很好地改善植物缺磷的现状,且长期使用还会引起一系列的生态问题[2-3]。在生产实践中,人们为了提高作物产量,每年都要向土壤中施入大量的可溶性磷肥,因而造成土壤板结,地力下降,环境污染,农产品品质下降等[4]。随着绿色环保理念的兴起,微生物菌肥因其绿色、无毒害、高效等特点受到广泛的研究和推广,逐渐取代了化学肥料在农林生产中的地位[5]。番木瓜 (Caricapapaya) 属番木瓜科 (Caricaceae) 番木瓜属 (Carica),是 “热带三大草本果树” 之一。番木瓜本身营养成分丰富,在食用、药用、保健等方面均具有重要价值,市场前景广阔[6-7]。目前,微生物菌肥在许多作物上的应用已得到诸多研究,但在番木瓜上的应用却鲜有研究。因此,开展番木瓜解磷细菌发酵条件优化研究,对研制微生物肥料以提高番木瓜的产量和品质具有重要的现实意义。
本研究以前期筛选出的番木瓜4株根际土壤解磷菌作为研究材料,在实验室条件下探讨它们各自的发酵条件及其最佳组合条件,以期为今后番木瓜专用微生物菌肥的研制和生产提供科学依据和理论指导。
1 材料与方法
1.1 实验材料
1.1.1供试菌株
供试菌株来源于前期从番木瓜根际土壤中筛选分离出的4株解磷菌,存放于-80 ℃冰箱。其中2株为解无机磷菌,标记为23、77号菌株,另外2株为解有机磷菌,标记为50、59号菌株。
1.1.2培养基
NA培养基培养细菌,并用于进行拮抗实验;蒙金娜无机磷培养基用于培养解无机磷细菌;蒙金娜有机磷培养基用于培养解有机磷细菌。
1.1.3菌株活化与培养
将冷冻保存于-80 ℃下的菌株取出,在37 ℃的水浴环境下解冻,至冻存管内菌液全部融化。在超净工作台上,将解冻后的菌液接种到NA斜面培养基上进行划线分离,然后置于37 ℃、无光条件下连续培养2~3 d,以获得大量的菌株资源。刮取两环斜面划线培养好的菌种,接入装有100 mL NA液体培养基的250 mL锥形瓶中,在37 ℃、160 r/min条件下连续培养1~2 d,以得到生长良好的菌株。
1.2 实验方法
1.2.1菌株间拮抗实验
分别将活化后的4株菌株在NA培养基上进行两两十字交叉划线,在37 ℃条件下培养1~2 d。每隔12 h观察细菌的生长情况,如2个菌株交叉处不能正常生长,则说明它们间存在拮抗作用;如2个菌株交叉处生长良好,说明这2个菌株间不存在拮抗作用[8]。
1.2.2菌株生长曲线及解磷能力测定实验
分别吸取4菌株0.2 mL菌液接入含10 mL NA液体培养基的试管内,每个菌株接种16个试管 (直径18 mm、长180 mm) 并做好标记,在37 ℃、160 r/min条件下进行培养。分别在第0、4、6、8、10、12、14、16、18、24、30、36、48、60、72、84 h时进行3次取样,测定600 nm处不同培养时长菌液吸光值,绘制各菌株生长曲线,据此确定各菌株在发酵培养时的最佳接种时间[9-10]。菌株解磷能力采用钼锑抗比色法进行测定。
1.2.3发酵条件优化实验
1) 单因素实验。分别将菌株以4 mL (8%) 的接种量接种到装有50 mL对应液体培养的100 mL锥形瓶中发酵培养,初始培养条件pH 7.0,温度37 ℃,转速160 r/min,时间5 d为其基础发酵条件 (CK),测定各菌株发酵后的解磷能力[11]。在其他基础培养条件不变的情况下,分别以温度、初始pH、摇床转速、装液量、接种量和发酵时间为单因素设置不同的实验梯度 (见表1),测定4株菌株的解磷能力。以上实验均重复3次。

表1 单因素实验设计Table 1 Single factor experiment design
2) 正交实验。根据单因素实验结果,对培养温度、装液量、摇床转速和接种量4个发酵条件进行了优化实验,实验采用正交实验L9(34),进行3次重复。发酵后测定各菌株的解磷能力。
2 结果与分析
2.1 菌株间的拮抗实验
各组合菌株间拮抗实验结果见表2。在对各菌株进行两两交叉划线后,其十字划线交叉处均能正常生长,表明各菌株间没有明显的拮抗作用。因此,本实验中所用的各菌株材料间彼此不存在明显的生物拮抗现象,可用于后续菌株混合发酵等相关生物学特性的研究。

表2 各菌株之间的拮抗作用Table 2 Antagonistic effects between each strain
注:“-” 表示菌株间无拮抗作用; “+” 表示同一种菌株间的拮抗实验。
2.2 各菌株生长曲线分析
4株菌株的生长曲线如图1所示,23、50和59号菌株生长调整期相对较短,发酵后约4 h进入对数生长期;而77号菌株生长调整期相对较长,前6 h都处于生长调整期,之后缓慢进入对数生长期。23号菌株在发酵第4~30 h为其对数生长期,此时细菌生长状态以及作用功效都处于最佳状态,因此该时间段可被选取作为研究菌株发酵培养条件的最佳接种时间;第30~48 h为其稳定期,此时细菌的增殖数和死亡数达到动态平衡状态,细菌的性状开始有不稳定的情况出现,有害物质开始产生;第48 h进入衰亡期,由于有害物质的产生以及培养基中营养物质的不断消耗,细菌开始出现死亡。与23号菌株不同,77号菌株进入对数生长期较慢 (第6~36 h),稳定期持续时间为12 h (第36~48 h),第48 h进入衰亡期。50号菌株的对数生长期为第4~24 h;稳定期为第24~30 h,持续时间仅有6 h,是4株菌株中稳定期时间最短的,可能是该菌株很可能对营养物质消耗较快,对生长环境要求较为苛刻;第30小时进入衰亡期。59号菌株对数生长期与50号菌株相同,稳定期为第24~36 h,第36 h进入衰亡期。
综上所述,虽然23号菌株和77号菌株、50号菌株和59号菌株分别为同种功能的解磷菌,但是它们均有其各自特定的生理特性,表现出不同的生长特征。在后续的实验中,均选取每一个菌株进入对数生长期的起始时间进行取样,以获得最佳发酵效果。另外,4株菌株的对数生长期重叠在第6~24 h,因此该时间段可作为后期各功能菌株混合发酵的最佳取样时间范围。
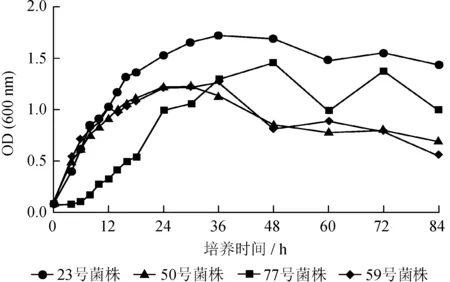
图14株解磷菌的生长曲线
Fig.1 Growth curves of 4 phosphate-solubilizing bacteria
2.3 不同培养条件对发酵的影响
2.3.1培养温度对各菌株摇瓶发酵的影响
如图2可知,培养温度对4株菌株的影响趋势一致,即在达到最佳培养温度前,随着温度的升高解磷能力逐渐增强;在最佳培养温度之后,随着温度的升高菌株的解磷能力逐渐减弱。23号菌株和77号菌株均在31 ℃时表现出最佳解磷能力,而50号菌株和59号菌株则在33 ℃时表现出最佳解磷能力,说明同种类型的菌对生长温度有着相同的要求,可能具有相似的生理代谢过程。而不同类型的菌则表现出一定的差异性,77号菌株和50号菌株在不同的温度梯度下均具有显著性差异 (P< 0.05),23号菌株和59号菌株在31~35 ℃间差异不显著,在其他温度差异显著 (P< 0.05)。

不同小写字母表示差异显著,不同大写字母表示差异极显著。
图2不同培养温度对4株根际菌解磷能力的影响
Fig.2 Effects of different culture temperatures on the phosphate-solubilizing ability of 4 rhizobacterial strains
2.3.2初始pH对菌株摇瓶发酵的影响
由于摇瓶发酵过程中培养基的pH值一直在不停变化,不方便测量,因此本实验选用培养基的初始pH作为参数[12],实验结果见图3。由图3可以看出,初始pH对4株菌株解磷能力的影响变化趋势一致,即在达到最佳初始pH前,随着初始pH的增加解磷能力逐渐增强;在最佳初始pH之后,随着初始pH的增加解磷能力逐渐减弱。由方差分析结果可知,4株菌株的最佳初始pH均为7.0,显著高于初始pH 6.0和8.0 (P< 0.05);除23号菌株外,其余3个菌株在初始pH 8.0时的解磷能力均极显著高于初始pH 6.0的解磷能力 (P< 0.01)。可见,中性初始pH条件下解磷菌的解磷效果最好,初始pH过高或过低均会不同程度地影响菌株的生长和繁殖,从而降低菌株解磷效果。
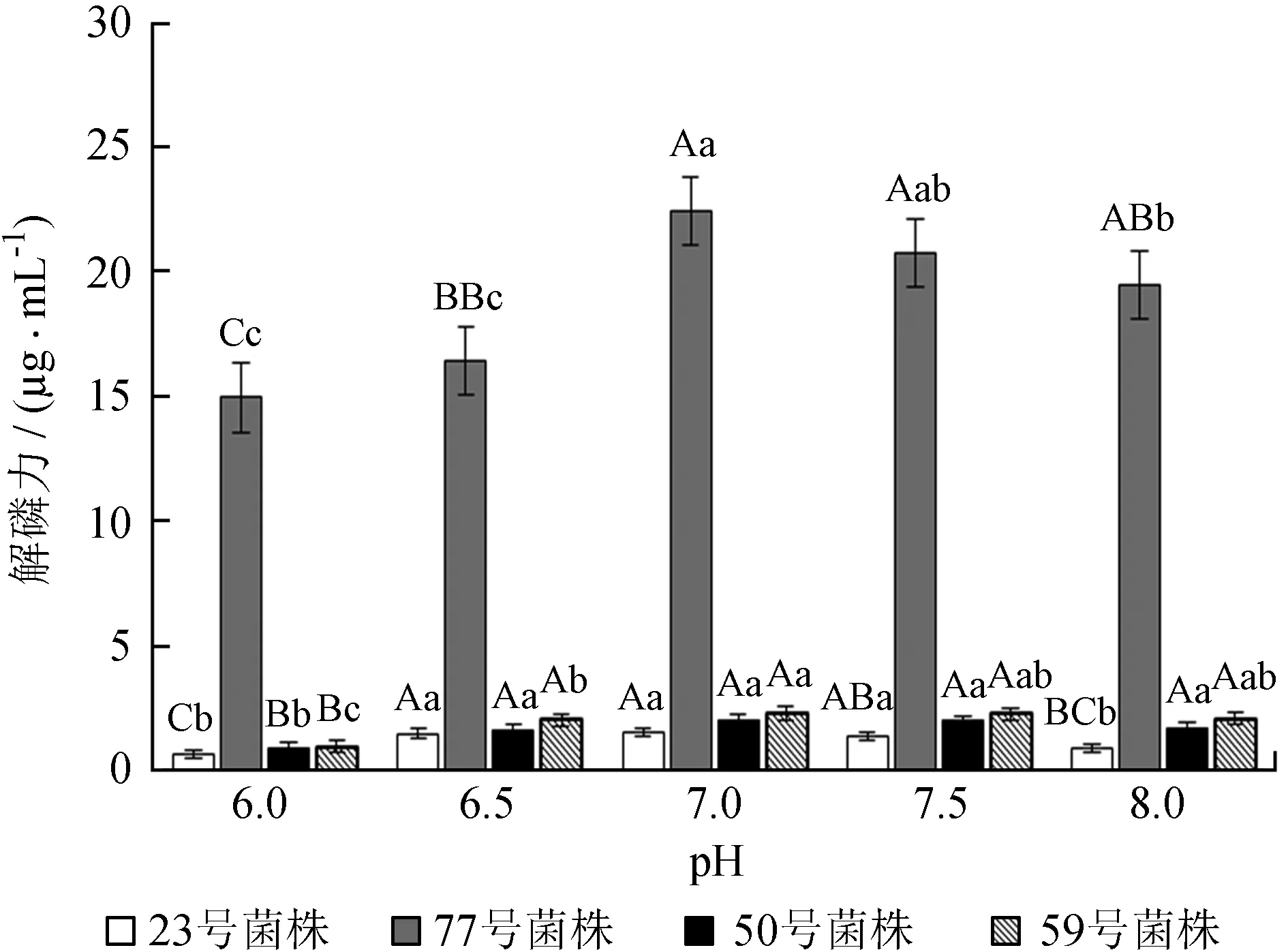
不同小写字母表示差异显著,不同大写字母表示差异极显著。
图3不同初始pH对4株根际菌解磷能力的影响
Fig.3 Effects of different initial pH on the phosphate-solubilizing ability of 4 rhizobacterial strains
2.3.3摇床转速对菌株摇瓶发酵的影响
由图4可以看出,4株菌株的解磷能力与转速在未达最佳摇床转速前呈正比关系,待达到最佳摇床转速后菌株的解磷能力与摇床转速呈反比。方差分析表明,23号菌株在摇床转速为160 r/min时解无机磷的能力最强,并极显著高于摇床转速为120、140 r/min时的解磷能力 (P< 0.01);77、50、59号菌株在摇床转速达180 r/min时解磷能力达到峰值,其中77号菌株的解磷能力极显著高于其他4个处理 (P< 0.01);50号菌株的解磷能力显著高于摇床转速为120、140、200 r/min时的解磷能力 (P< 0.05);59号菌株在所有摇床转速下均未表现出显著差异,说明摇床转速对该菌株解磷能力影响较小。

不同小写字母表示差异显著,不同大写字母表示差异极显著。
图4不同摇床转速对4株根际菌解磷能力的影响
Fig.4 Effects of different shaker speeds on the phosphate-solubilizing ability of 4 rhizobacterial strains
2.3.4装液量对菌株摇瓶发酵的影响
由图5可知,4株菌株解磷能力的变化趋势均随着装液量的增加而增强,待解磷能力达到最强后再随着装液量的增加而逐渐下降。其中,23、77、59号菌株在装液量为60 mL时的解磷效果最好,而50号菌株在装液量为50 mL时具有最佳解磷效果。方差分析结果表明,不同装液量对4株解磷菌的解磷能力均产生了不同程度的影响,其中77、59号菌株在60 mL装液量时的解磷能力极显著高于其他处理 (P< 0.01);23号菌株在60 mL装液量时的解磷能力显著高于装液量为30和70 mL时的解磷能力 (P< 0.05);50号菌株在50 mL装液量时的解磷能力显著高于装液量为30、60和70 mL时的解磷能力 (P< 0.05)。

不同小写字母表示差异显著,不同大写字母表示差异极显著。
图5不同装液量对4株根际菌解磷能力的影响
Fig.5 Effects of different liquid volumes on the phosphate-solubilizing ability of 4 rhizobacterial strains
2.3.5接种量对菌株摇瓶发酵的影响
由图6可知,4株菌株的解磷能力都是随着接种量的增大而出现先增强至峰值,然后再减弱的趋势。方差分析结果表明,77、59号菌株均在接种量为2 mL时解磷能力达到最佳,并极显著高于其他处理 (P< 0.01); 23、50号菌株在接种量为3 mL时解磷效果最好,其中23号菌株的解磷能力极显著高于其他处理 (P< 0.01),50号菌株的解磷能力显著高于接种量为4和5 mL时的解磷能力 (P< 0.05)。

不同小写字母表示差异显著,不同大写字母表示差异极显著。
图6不同接种量对4株根际菌解磷能力的影响
Fig.6 Effects of different inoculum density on the phosphate-solubilizing ability of 4 rhizobacterial strains
2.3.6培养时间对株菌摇瓶发酵的影响
由图7可知,4株菌株的解磷能力均随着培养时间的延长而增强,在发酵培养5 d时解磷能力达到最强,之后随着培养时间的延长而开始下降。方差分析结果表明,不同培养时间对4株菌株的解磷能力均具有不同程度的影响,其中23号菌株在培养5 d时的解磷能力显著高于培养第7 d时的解磷能力 (P< 0.05);77号菌株在培养5 d时的解磷能力极显著高于其他处理 (P< 0.01);50号菌株在培养5 d时的解磷能力极显著高于培养3、4 d时的解磷能力 (P< 0.01);而59号菌株的解磷能力在所有处理间均未表现出显著差异,说明在一定范围培养时间对该菌株的解磷能力影响不大。另外,4株菌株在发酵5 d时生长处于稳定期,此时菌株的代谢和作用能力都处于最佳状态。在发酵时间未达5 d时,菌株仍处于几何对数生长期,此时各菌体还没有生长到最佳状态,解磷能力亦未发挥到最好状态;而在第5天后各菌株进入衰亡期,由于菌体死亡量增加导致菌株的解磷能力逐渐下降。

不同小写字母表示差异显著,不同大写字母表示差异极显著。
图7不同发酵时间对4株根际菌解磷能力的影响
Fig.7 Effects of different incubation periods on the phosphate-solubilizing ability of 4 rhizobacteial strains
2.4 各个菌株最佳发酵条件组合
根据6个单因素的结果及分析,按照正交实验L9(34) 对23和77号菌株、50和59号菌株的培养温度、装液量、摇床转速和接种量4个发酵条件进行了优化实验,实验结果见表3~4,方差分析结果见表5。
从表3、表4和表5可知,4个发酵条件对23号菌株解磷能力影响的主次顺序为:D(接种量)>B(转速)>A(培养温度)>C(装液量),其中接种量影响达到极显著 (P< 0.01),培养温度和转速影响达到显著 (P< 0.05),而装液量影响不显著。23号菌株的最佳培养条件为A2B2C3D1,即培养温度33 ℃、摇床转速180 r/min、装液量60 mL、接种量3 mL。
4个发酵条件对77号菌株解磷能力影响的主次顺序为:A(培养温度)>C(装液量)>B(转速)>D(接种量),其中培养温度和装液量影响达到极显著 (P< 0.01),转速影响达到显著 (P< 0.05),接种量影响不显著 (P> 0.05)。77号菌株的最佳培养条件为A2B3C2D2,即培养温度33 ℃、摇床转速200 r/min、装液量50 mL、接种量3 mL。
4个发酵条件对50号菌株解磷能力影响的主次顺序为:A(培养温度)>D(接种量)>C(装液量)>B(转速),其中培养温度和接种量影响达到极显著 (P< 0.01),转速和装液量影响不显著 (P> 0.05)。50号菌株的最佳培养条件为A1B1C3D1,即培养温度31 ℃、摇床转速160 r/min、装液量60 mL、接种量1 mL。

表3 23和77号菌株发酵条件的正交实验结果Table 3 Orthogonal design and result for fermentation conditions of both strain 23 and strain 77

表4 50和59号菌株发酵条件优化的正交实验结果Table 4 Orthogonal design and result for fermentation conditions of both strain 50 and strain 59

续表4

表5 正交实验方差分析结果Table 5 Variance analysis of orthogonal experiment
4个发酵条件对59号菌株解磷能力影响的主次顺序为:A(培养温度)>B(转速)>C(装液量)>D(接种量),其中培养温度和转速影响达到显著 (P< 0.05),而装液量和接种量影响不显著。59号菌株的最佳培养条件为A1B1C1D3,即培养温度31 ℃、摇床转速160 r/min、装液量50 mL、接种量4 mL。
3 结论与讨论
目前,大部分细菌的培养常采用LB培养基[13],但本实验采用NA和LB两种类型的培养基分别对解磷菌进行活化研究时,发现NA培养基比LB培养基更利于解磷菌的生长,因此后续所有实验均采用NA培养基进行平板制作和种子液发酵培养。在拮抗实验中,任意2个菌株间均不存在拮抗作用,说明4株解磷菌能够在一起很好地生长,从生态意义上也反映出这些功能菌株生长在相同的植物根际土壤环境中,这与4株菌株从相同的根际土壤分离结果相一致。
为了扩大细菌的增殖并调整细菌生长的时期,同时在发酵培养时能接入活性好、功效强的菌株,对4株解磷菌进行了生长曲线的测定。结果发现4株菌株均在培养6~24 h后进入对数生长期,而一般实际操作中宜选取种子液对数生长期中后期进行取样,因此该时段可作为后期各功能菌株混合发酵的最佳取样时间范围。
目前,微生物菌肥的使用已越来越广泛,为了降低生产成本和增加产量,需要对菌肥生产和菌株培养的各个环节尽可能的进行优化,前人已做大量研究完成了对不同功能菌株的发酵条件优化[14-15]。考虑到实际生产中对解磷菌解磷能力影响较大的发酵条件,本研究主要选择了初始pH、培养温度、转速、装液量、接种量、培养时间等6个因素进行研究。在初始pH研究中,所有4个菌株的最佳初始pH值均为7.0,其次是初始pH为7.5,酸性初始pH则解磷能力相对较差,据此推测初始pH环境偏酸性将不利于菌株的生长,原因可能是细菌在发酵过程中会产生有机酸等代谢产物;而中性至略偏碱性的初始pH值菌株解磷能力较强,说明这些细菌很可能生长在中性至偏弱碱性的土壤环境中或至少在其根际部位土壤的pH值接近中性。在摇床转速优化研究中,摇床转速的快慢影响着培养液和菌群的混合程度以及溶氧量,实验结果得出当摇床转速是160 r/min时,23号菌株的解无机磷能力最强,当转速达180 r/min时,77、50、59号菌株氧的传递速率较快、溶氧量较大,此时的解磷能力最强,说明它们均需要氧气来维持自身的各种生命代谢活动,当达到一定转速时其溶氧量最适合菌株的生长,各种生命代谢活动也最为活跃。同样地,装液量的多少也影响着氧气的溶解量,装液量过高或者过低菌株的解磷能力都不强,据此结合摇床转速的单因素结果推测这4株菌株属于需氧型细菌。前期研究结果表明,对于需氧微生物溶氧量的过大或过小对菌株的代谢途径和酶的活性会产生影响,本实验尚不清楚溶氧量过大或过小对这4株菌株影响的是通过改变代谢途径还是降低了酶的活性,相关生物学过程及实验分析还有待进一步研究。针对接种量的研究,实验结果得出4个菌株的解磷能力都呈先增强再减弱的趋势,推测适当增加菌株的接种量有利于缩短微生物的生长周期,使得微生物能充分利用养分和空间,从而能够更好地生长。但是接种量过多则使得培养基的养分消耗过快和空间受到限制,也不利于细菌的生长。在培养时间的研究中,4株菌株均在发酵培养5 d时具有最高解磷能力,时间过短4株PGPR还在对数生长期,此时代谢生长未达到最大,时间过长细菌的生长周期进入衰亡期,有害物质积累,菌体活性和功能作用降低,产生自溶现象。
综合单因素实验结果,本研究中所有菌株均在初始pH 7.0和发酵培养5 d时具有最佳的解磷效果,所以在正交实验中仅考虑培养温度、摇床转速、装液量和接种量4个发酵条件。正交优化后的最优组合发酵条件参数与单因素优化时的最优发酵条件参数存在一定程度的差异,考虑到选择的4个发酵条件之间会存在交互影响,从而改变了之前单个变量实验时的最优条件值。培养温度和摇床转速正交实验结果与单因素实验结果相同,说明两者不存在交互作用;而装液量和接种量则表现出差异性,说明它们受到交互作用的影响。另外,不论是解有机磷菌还是解无机磷菌,它们的最佳发酵条件均存在不同程度的差异,说明虽然4株菌株生活在同一土壤生境中,但是每一个菌株均有其特定的最适生长条件。自然环境中正是由于不同类型的功能菌株存在于同一植物根际表面或根内,才使得植物能够适应多变的自然环境,从某种程度上很可能也反映了这4株解磷菌具有一定的相互协调、互补的能力。
[参 考 文 献]
[1] Walbridge M R. Phosphorus availability in acid organic solis of the lower north Carolina Coastel plain[J]. Ecology, 1991, 72(6): 2083-2100.
[2] Tao G C, Tian S J, Cai M Y, et al. Phosphate-solubilizing and mineralizing abilities of bacteria isolated from soils[J]. Pedosphere, 2008, 18(4): 515-523.
[3] Babana A H, Antoun H, Dicko A H. Effect of Pseudomonas sp. on wheat roots colonization by mycorrhizal fungi and phosphate-solubilizing microorganisms, wheat growth and P-uptake[J]. Intercontinental Journal of Microbiology, 2012, 1(1): 1-7.
[4] Adesemoye A O, Kloepper J W. Plant-microbes interactions in enhanced fertilizer-use efficiency[J]. Applied Microbiology and Biotechnology, 2009, 85(1): 1-12.
[5] 许芳芳, 袁立敏, 邵玉芳, 等. 肠杆菌FYP1101对盐胁迫下小麦幼苗的促生效应[J]. 微生物学通报, 2018, 45(1): 102-110.
[6] Almora K, Pino J A, Hernandez M, et al. Evaluation of volatiles from ripening papaya (CaricapapayaL. , var. Maradol Roja) [J]. Food Chemistry, 2004, 86(1): 127-130.
[7] Dawkins G, Hewitt H, Wint Y, et al. Antibacterial effects ofCaricapapayafruit on common wound organisms[J]. The West Indian Medical Journal, 2003, 52(4): 290-292.
[8] 刘青海, 姚拓, 马从, 等. 6株溶磷菌和4株固氮菌混合培养条件的研究[J]. 草原与草坪, 2011, 31(6): 1-6, 13.
[9] 罗洁. 类产碱假单胞菌对PVA的降解及镉吸附特性研究[D]. 株洲: 湖南工业大学, 2014.
[10] 俞海青. 噬菌体展示短肽亲和配基的筛选及其亲和色谱的研究[D]. 天津: 天津大学, 2003.
[11] 李蓉. 杉木PGPR菌分离筛选及其微生物复合菌肥研制[D]. 长沙: 中南林业科技大学, 2012.
[12] 李宁, 剧建格, 于宏伟, 等. 抗菌肽产生菌BrevibacilluslaterosporusS62-9最适发酵条件的优化[J]. 食品研究与开发, 2016, 37(3): 182-186.
[13] 代先祝, 梁晓丽, 邱勤. 低营养浓度培养基分离培养生物膜中的细菌及其鉴定[J]. 微生物学通报, 2010, 37(7): 951-955.
[14] 战光华, 李逢江. 微生物菌肥在农业中的主要应用分析[J]. 吉林农业, 2011(10): 82.
[15] 侯重文. 基因工程法构建乳糖酶高产菌株及发酵条件优化的研究[D]. 济南: 山东大学, 2014.
