野生与栽培红河橙叶表型性状比较研究
2018-04-25牟凤娟黄必娇李双智李一果
牟凤娟 黄必娇 李双智 李一果
(1. 西南林业大学林学院,云南 昆明 650224;2. 龙新乡林业工作站,云南 保山 678315;3. 昆明理工大学生命科学与技术学院,昆明市生物资源开发创新办公室,云南 昆明 650500)
红河橙 (Citrushongheensis) 为20世纪70年代发现的云南红河县特有野生大翼橙种类[1],主要分布于红河流域海拔800~2 000 m村寨周边地区,当地别名阿雷、树葫芦、枳壳。此大翼橙的翼叶宽而长,且长度可达本叶的2~3倍;总状花序具5~9小花,花大型,花径达3~3.5 cm,花丝分离,偶有单花。所有特征均表明红河橙的原始性,证明了云南是柑橘的重要起源地之一。其后,红河橙的新变种在元江县境内被发现,即元江大翼橙 (C.hongheensisvar.yuanjiang)[2],该变种的主要形态特征是具有更大的花、更多的雄蕊、更厚的果皮,以及稍小的翼叶。红河橙的树形挺拔、壮观,叶片光亮浓绿,当地哈尼族人民在房前屋后种植以绿化环境,并将其幼果用作中药 “枳壳”;由于富含精油,成熟叶片可用作牛羊肉调味的辛香调料。该物种在云南南部冬春干旱的条件下,生长发育良好,且存活年限较长,可为柑橘抗旱育种和砧木利用提供良好的材料。
目前关于红河橙的研究主要集中在该种在柑橘属中的系统地位[3-4]及分子遗传多样性[5-6]。红河大翼橙与柚 (C.maxima) 的遗传距离最近,其次为宜昌橙 (C.ichangensis),最远为柑桔 (C.reticulata),可能与柚的起源有着很重要的关系[3-4]。红河橙虽为分布较狭窄的特有种,但与一些典型稀有或濒危物种相比,居群间的ISSR分子标记仍表现出较高水平的遗传分化,其遗传多样性并不低[5-6]。
物种在居群、个体、组织细胞及分子等不同水平均可体现其遗传变异[7],同一物种不同个体间或是居群间存在各种形式及程度不同的形态变异,这些变异往往是各种生物、非生物因子控制下自然选择在强度和方向上差异的综合产物,即物种的表型多样性是遗传多样性与其环境多样性的综合体现[8]。物种形态变异往往具有一定的生态适应意义,所以从形态学或表型性状上可对物种的遗传变异进行有效估计[9-11]。植物叶片性状变异与整个植物和生态系统的结构、功能相关[12-13],植物叶片在居群间的形态变异更能反映遗传基础上植物与其生境的相互作用,可从中获得植物适应和进化的信息[14]。与其他大翼橙相比较,红河橙翼叶极为发达,可利用其叶片各项特征表现差异对红河橙的遗传多样性及其生态适应进行探讨。本研究首次对红河橙的野生居群进行调查,并对红河大翼橙栽培和野生居群叶表型进行多样性研究,旨在为该特有野生柑橘遗传资源的利用及物种保护等研究提供参考依据。
1 材料与方法
1.1 研究材料
采集元江县境内栽培居群 (YJ) 及新平县境内野生居群 (XP) 植株的成熟叶片,叶片至少2年以上生长期,无病虫害危害痕迹,备用。
1.2 研究方法
对红河橙2个居群的生长环境及个体生长状况进行调查,包括地理位置、土壤、水分、光照及植株高度、长势等。采用随机抽样方法,每个居群中每个植株的不同部位抽取至少10枚新鲜成熟叶,编号。测量叶总长 (TLL)、翼叶长 (LWL)、翼叶宽 (WWL)、本叶长 (LL)、本叶宽 (WL) 等5项叶片形态指标,并计算翼叶长/叶总长 (LWL/TLL)、本叶长/叶总长 (LL/TLL)、翼叶长/本叶长 (LWL/LL)、本叶长/翼叶长 (LL/LWL)、翼叶长/宽 (LWL/WWL)、本叶长/宽 (LL/WL)、翼叶宽/本叶宽 (WWL/WL)、本叶宽/翼叶宽 (WL/WWL) 共8项特征值。
将叶表型数据录入Excel 2009中,计算各特征值的平均值、标准差和变异系数。用Excel 2009和SPSS 19.0对红河橙叶的各项表型指标进行方差分析及差异显著性检验。
2 结果与分析
2.1 生境特点
栽培居群位于云南省元江县那诺乡村寨周边,山地土壤肥沃、阳光充沛;个体分布稀疏,植株生长较为高大健壮,主干明显、枝叶茂密。野生居群位于新平县磨盘山森林公园,石山土壤肥沃、荫蔽潮湿;个体分布相对集中,植株长势相对较弱,主干分枝多、枝叶稀疏。
2.2 叶表型特征分析
2.2.1叶表型形态特征值变异
由图1~2可知,红河橙栽培居群有8个表型平均值均大于野生居群居群,即TLL、LWL、WWL、LL、WL、LWL/TLL、LWL/LL、WWL/WL,可能的原因是栽培居群中由于水肥和光照条件较为优越,导致其表现值均较野生居群的大;而野生居群有5个叶表型平均值稍大于栽培居群,即LL/TLL、LL/LWL、LWL/WWL、LL/WL和WL/WWL,这说明新平野生居群中这5个叶表型的表现值均稍大于元江栽培居群。

图1红河橙5个叶表型平均值及其标准差
Fig.1 Average and standard deviation of 5 leaf morphological characters ofC.hongheensis
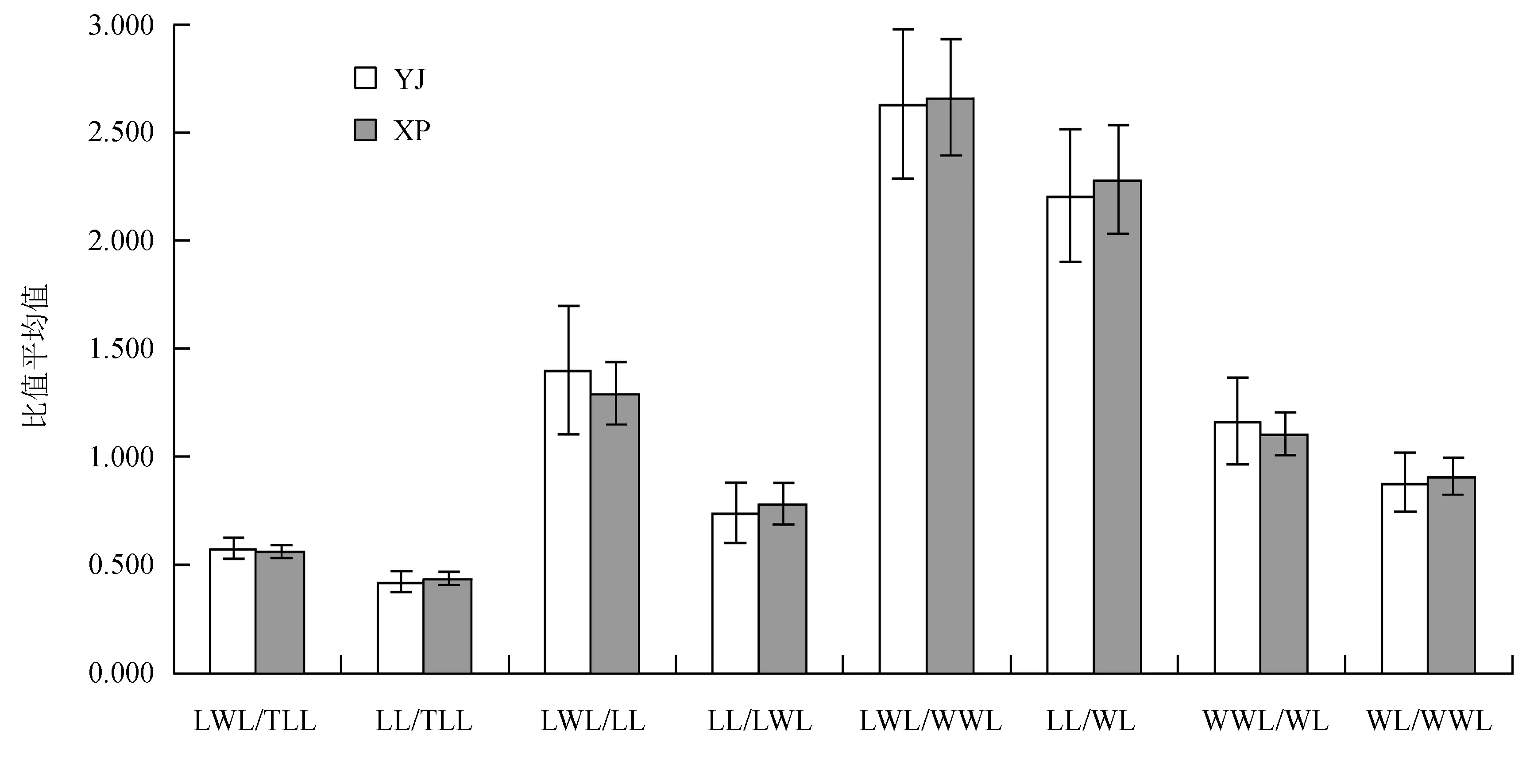
图2红河橙8个叶表型平均值及其标准差
Fig.2 Average and standard deviation of 8 leaf morphological characters ofC.hongheensis
2.2.2叶表型特征变异分析
由图3可知,红河橙的叶表型变异系数范围为5.08%~21.12%,其中栽培居群LWL/LL变异系数最大,而野生居群中LWL/TLL的变异系数最小,说明该叶表型在新平野生居群中的表现最稳定。同一居群内红河橙各叶表型变异程度不同,如栽培居群内LWL/LL变异系数最大 (21.12%),LWL/TLL变异系数最小 (8.23%);野生居群中变异系数最大的是WWL (18.94%),LWL/TLL的变异系数最小 (5.08%)。LWL/TLL在2个居群中的变异系数均最小,说明该表型特征在居群内表现最稳定。
13个叶表型特征的变异系数在栽培和野生居群中分别是LWL/LL为21.12%和11.09%、LL为20.75%和15.36%、WL为20.36%和17.93%、LL/LWL为18.94%和12.26%、WWL/WL为17.23%和8.91%、LWL为16.26%和16.07%、WL/WWL为15.69%和9.41%、TLL为15.63%和14.73%、WWL为13.92%和18.94%、LL/WL为13.87%和10.96%、LWL/WWL为13.15%和10.10%、LL/TLL为11.27%和6.52%、LWL/TLL为8.23%和5.08%。除WWL外,其余12个表型变异系数均是栽培居群大于野生居群。
2.3 叶表型居群间的差异
由表1可知,TLL、LWL、WWL、LL、WL、LWL/LL在居群间的差异达极显著水平 (P< 0.01);LWL/TLL、LL/TLL、LL/LWL、WWL/WL在居群间的差异达显著水平 (P< 0.05);而LWL/WWL、LL/WL、WL/WWL在居群间的差异不显著,说明其受环境异质性的影响较小。

图3红河橙13个叶表型的变异系数
Fig.3 Coefficient of variation of 13 leaf characters ofC.hongheensis
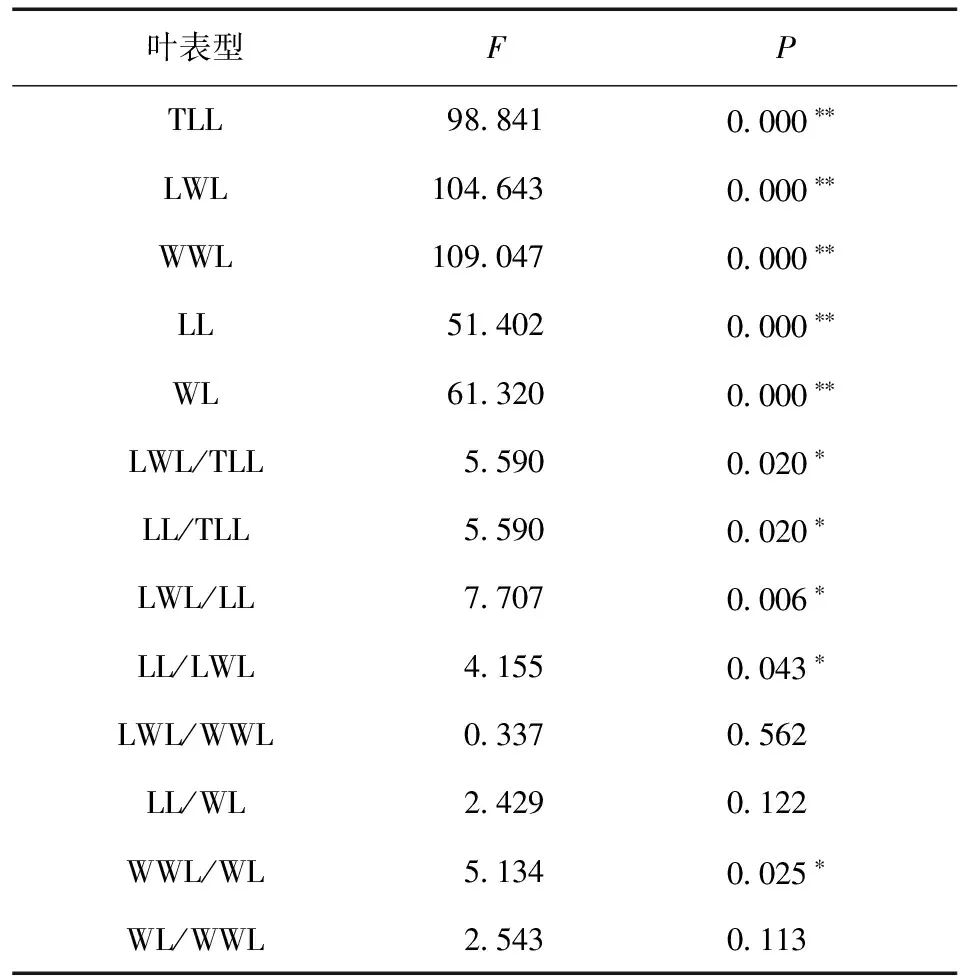
表1 红河橙居13个叶表型单因素方差分析F检验Table 1 F-test of ANOVA of 13 leaf characters of C.hongheensis
注:*表示差异显著;**表示差异极显著。
3 结论与讨论
红河橙13个叶表型性状中,变异系数最大的是WL (23.51%),其次WWL (21.96%)、LL (21.92%)、LWL (21.77%)、TLL (20.23%),最小的是LWL/TLL (6.82%),而分布于版纳地区的大翼厚皮橙 (C.macropteravar.kerrii) WWL变异最大 (29.64%),其次为LWL (22.96%)、WL (22.46%)、LL (20.97%)、LWL/LL (20.73%)、TLL (20.09%),最小为LWL/TLL (10.39%)[15],云南境内宜昌橙在9个居群中WWL变异最高,而LWL/TLL最低[16]。在所有叶表型特征中,红河橙、大翼厚皮橙和宜昌橙的LWL/TLL变异系数均最小,说明LWL/TLL表现最稳定,可作为种类鉴定的可靠指标之一。
物种在居群间变异可真实反映其在不同生境中的适应状况,变异大小在某种程度上说明了该物种对不同生态环境适应的广泛程度,即变异越大,其适应的环境就越广[17-18]。红河橙TLL、LWL、WWL、LL、WL、LWL/LL在居群间的差异极显著 (P< 0.01),其中红河橙栽培居群TLL、LWL、WWL、LL、WL平均值均大于野生居群,主要原因是2个居群的生境差异较大。栽培居群位于元江县那诺乡,为村寨周围栽种,没有任何遮挡,阳光充裕,水肥充足,树体高大,叶片较大;而野生居群位于新平县磨盘山的原始森林内,为陡坡阴湿环境,所有植株均被其他植物所遮蔽,长势较弱,叶片均较小。
目前,佛山市已建立相关食品安全追溯系统,包括以“检测+追溯”为核心的食品安全监管体系的构建,“电子支付+检测追溯+食品安全责任保险”项目的开展,“放心肉菜示范超市”创建活动的开展,“互联网+智慧菜市场”的推行等。但现有的食品安全追溯系统在满足健康中国战略和食品安全战略要求方面仍有不足,缺乏对数据质量问题、标准不一问题、数据孤岛问题等,不能使数据与市民生活实现有效对接,挖掘、发挥其真正的价值。
红河橙同一叶表型特征变异系数在不同居群中存在较明显的变化,即栽培居群和野生居群间的变异程度不同。红河橙栽培居群13个表型性状 (除了WWL) 变异系数均大于野生居群,说明栽培居群的遗传多样性普遍高于野生居群。推测其可能原因是栽培居群的遗传资源来自不同地方或长期人为选择的结果,致使其遗传性较高;亦或是野生居群个体数量较少,且大多植株均为极少数植株的自然繁殖后代,致使其遗传多样性较低。
ISSR分子标记证明红河橙居群间表现出较高水平的遗传分化,其遗传多样性并不低[5],并推测其较高遗传分化可能为生境片段化和有限基因流的结果[6]。杨杨等[5]认为红河橙多在村落房前屋后零星栽植,且多为人为移栽,同一居群中会有来自不同地区的植株,这可能是造成这个种类分布区狭窄却具有高水平遗传多样性的原因之一。本研究发现红河橙叶片形态的变异系数范围为6.82%~23.51%,物种多样性较高,与杨杨等[5]的研究结果相一致。
致谢:感谢云南大学陆树刚教授和中国科学院昆明植物研究所彭华研究员在调查过程中的悉心指导。
[参 考 文 献]
[1] 叶荫民, 刘晓东, 丁素琴, 等. 云南红河橙: 柑桔属大翼橙亚属的一个新种[J]. 植物分类学报, 1976, 14(4): 57-59.
[2] 暴卓然, 梁明清, 陈云铎, 等. 元江大翼橙: 柑桔属红河橙的新变种[J]. 园艺学报, 1988, 15(3): 145-147.
[3] 刘勇, 孙中海, 刘德春, 等. 柚类种质资源AFLP与SSR遗传多样性分析[J]. 中国农业科学, 2005, 38(11): 2308-2315.
[4] 刘勇, 刘德春, 吴波, 等. 采用SSR标记对中国柚类资源及近缘种遗传多样性研究[J]. 农业生物技术学报, 2006, 14(1): 90-95.
[6] Yang Y, Pan Y Z, Gong X, et al. Genetic variation in the endangered Rutaceae speciesCitrushongheensisbased on ISSR fingerprinting[J]. Genetic Resources and Crop Evolution, 2010, 57(8): 1239-1248.
[7] Moritz C, Hillis D M. Molecular Systematics: Context and Controversies[M]// Hills D M, Moritz C, Mable B K. Molecular Systematics. 2nd ed. Sunderland: Sinauer Associates, 1996.
[8] 顾万春. 统计遗传学[M]. 北京: 科学出版社, 2004.
[9] Schaal B A, Leverich W J, Rogstad S H, et al. A comparison of methods for assessing genetic variation in plant conservation biology[M]. New York: Oxford University Press, 1991.
[10] 中国科学院生物多样性委员会. 生物多样性研究的原理与方法[M]. 北京: 中国科学技术出版社, 1994.
[11] 蒋志刚. 保护生物学[M]. 杭州: 浙江科学技术出版社, 1997.
[12] 张林, 罗天祥. 植物叶寿命及其相关叶性状的生态学研究进展[J]. 植物生态学报, 2004, 28(6): 844-852.
[13] 王英姿, 洪伟, 吴承祯, 等. 灵石山米槠林优势种群不同叶龄叶属性的研究[J]. 福建林学院学报, 2009, 29(3): 203-209.
[14] 刘晓, 岳明, 任毅. 独叶草叶片性状表型多样性研究[J]. 西北植物学报, 2011, 31(5): 950-957.
[15] 牟凤娟, 李一果, 李双智, 等. 大翼厚皮橙叶片及种子形态变异研究[J]. 西南林业大学学报, 2016, 36(3): 54-59.
[16] Mou F J, Ma K, Ma S Z, et al. Morphological diversity of leaf and its geographic differentiation ofCitruscavalerieifrom Yunnan[J]. Pakistan Journal of Botany, 2016, 48(6): 2343-2350.
[17] 李斌, 顾万春, 卢宝明. 白皮松天然群体种实性状表型多样性研究[J]. 生物多样性, 2002, 10(2): 181-188.
[18] 李梅, 韩海荣, 康峰峰, 等. 山西灵空山辽东栎种群叶性状表型变异研究[J]. 北京林业大学学报, 2005, 27(5): 10-16.
