ALDH1蛋白表达与胶质瘤干细胞体外分化相关性的研究
2018-04-25王鹏宋伟正毛庆陈米娜刘艳辉
王鹏 宋伟正 毛庆 陈米娜 刘艳辉
胶质母细胞瘤是一种具有高度恶性和侵袭性的脑肿瘤,2年及5年生存率仅为26﹪~ 33﹪和4﹪~ 5﹪[1]。目前已有大量研究证实胶质母细胞瘤中存在着分化的肿瘤细胞和一部分未分化的干(祖)样细胞—胶质瘤干细胞,后者是导致标准化治疗后肿瘤复发和患者预后不佳的重要原因[2]。胶质瘤干细胞的概念不仅是基于对细胞形态的观察,而且更是基于对细胞功能的测定,对这种细胞的分离和研究需要依赖于一些特异的分子标志物。国外有学者提出乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)可作为筛选胶质瘤干细胞的功能性分子标记[3],但有学者却观察到ALDH1表达于成熟的神经胶质细胞和肿瘤细胞,是细胞分化的标志,对其干细胞标记作用提出质疑[4]。在国内,笔者首先报道了在胶质瘤干细胞中ALDH1蛋白仅表达于分化前的细胞[5],但因该研究只进行定性观察,缺乏一定说服力。本实验拟通过设立对照组并应用免疫荧光细胞化学染色和Western blot半定量分析进一步探讨ALDH1蛋白的表达与胶质瘤干细胞分化的关系。
材料和方法
一、胶质瘤干细胞标本
收集9例胶质母细胞瘤实体组织进行体外细胞培养,获取CD133+胶质瘤干细胞标本。具体方法详见笔者以往的报道[5]及参考文献[14]。实验计划上报医院伦理委员会批准,患者及家属入院时均签订医学实验告知书。
二、实验方法
(一)试剂和设备
1.主要试剂:Neurobasal培养基、Accutase细胞消化液、N-2、B-27、荧光二抗和DAPI封片剂(美国Invitrogen公司);胎牛血清(郑州佰安生物工程公司);青霉素-链霉素-两性霉素B混合溶液(北京索莱宝科技公司),丙烯酰胺/甲叉双丙烯酰胺(美国Sigma-Aldrich公司),β-巯基乙醇、吐温-20四甲基乙二胺和过硫酸铵(美国Bio-rad公司),ALDH1抗体(四川大学生物治疗国家重点实验室惠赠)。
2.主要设备:恒温细胞培养箱(德国Binder公司),倒置显微镜(德国Leica公司),垂直蛋白电泳仪(美国Amersham公司),蛋白湿转系统(美国Bio-rad公司),X胶片显影机(美国Kodak公司),荧光显微镜(日本Olympus公司)。
(二)细胞分组与形态观察
将9例CD133+胶质瘤干细胞分为分化组与对照组。分化组细胞采取10﹪胎牛血清诱导,操作过程如下:将2 ml Accutase液加入培养皿中,37 ℃下静置10 min。收集悬浮的细胞,以90×g的速度离心5 min。在沉淀内加入分化培养基(含10﹪胎牛血清),吹打10次,铺于皿底,37 ℃下培养。对照组细胞继续于无血清环境下传代培养。镜下逐日查看各组细胞的形态。
(三)免疫荧光细胞化学染色
将两组细胞行ALDH1荧光抗体染色,具体方法详见参考文献[5]。应用ImageJ软件(1.51版)统计各组标本ALDH1阳性细胞的数量,计算阳性细胞率。阳性细胞判定标准:细胞胞浆内见可见红色荧光。
(四)蛋白质印迹实验(Western blot)
将两组细胞行Western blot,检测ALDH1的相对蛋白含量。具体方法如下:将两组细胞移入6孔板中,分别培养5 ~ 7 d。吸出残液,PBS润洗数次,每孔加入300 μl裂解液,放置于4 ℃层析柜内,轻摇30 min。超声仪中破碎细胞3 ~ 4次,充分震荡,4 ℃下以18 000×g的速度离心20 min。取上清液行SDS-PAGE,初始电压为80 V,样品进入分离胶后加大电压至125 V,待溴酚蓝抵达分离胶底部时终止电泳,使用预染蛋白Marker (SM0671)帮助辨识条带的大小。可预先使用BCA定量试剂盒和酶标分析仪行蛋白定量检测以确定上样量。待蛋白分离后,将凝胶和PVDF膜移入转膜仪内,300 V及300 mA下转膜60 min。取出PVDF 膜,加入5﹪的脱脂乳常温下作用60 min。加入ALDH1抗体(1:1000),4 ℃低温层析柜水平摇床放置过夜。TBST液清洗,加入HRP(1:20000)常温静置60 min。TBST清洗,加入发光底物作用2 min,X线显影机中曝光。扫描胶片并用ImageJ软件(1.51版)统计条带灰度,以β-actin为内参,通过计算ALDH1灰度与β-actin灰度的比值获得ALDH1的相对蛋白含量。
(五)统计学分析方法
使用SPSS软件(17.0版)对结果进行统计分析,GraphPad软件(7.0版)绘制直方图。其中,ALDH1阳性细胞率和相对蛋白含量均以±s表示。两组间ALDH1阳性细胞率的比较采用Wilcoxon符号秩检验,两组间ALDH1相对蛋白含量的比较采用独立样本t检验,以P < 0.05为差异有统计学意义。
结 果
一、光镜下分化组与对照组细胞的特点
分化组细胞呈完全贴壁生长,形态多样,无聚集现象(图1a);对照组细胞呈团状聚集,形态较为一致,细胞密度高(图1b)。
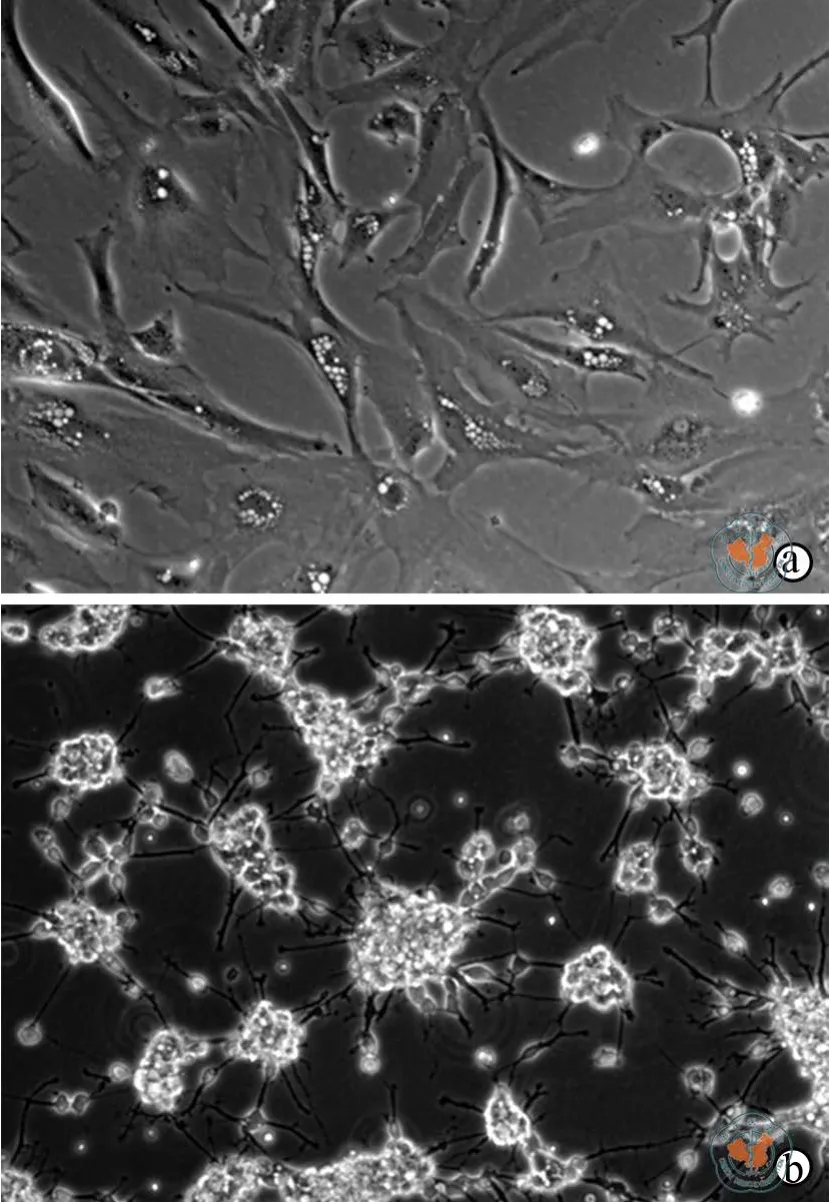
图1 倒置显微镜下观察分化组与对照组细胞形态
二、分化组与对照组细胞ALDH1蛋白的半定量分析
荧光显微镜下,分化组细胞的ALDH1蛋白总体呈阴性表达(图2a);对照组细胞的ALDH1蛋白呈明显阳性表达,荧光主要位于细胞聚集区的顶部(图2b)。柱状图分析显示分化组各细胞标本的ALDH1阳性率均低于对照组(图3)。其中,分化组平均的ALDH1阳性细胞率为18.78﹪±6.03﹪,对照组平均为81.23﹪±3.19﹪,Wilcoxon符号秩检验显示两组的阳性细胞率差异具有统计学意义(表1)。
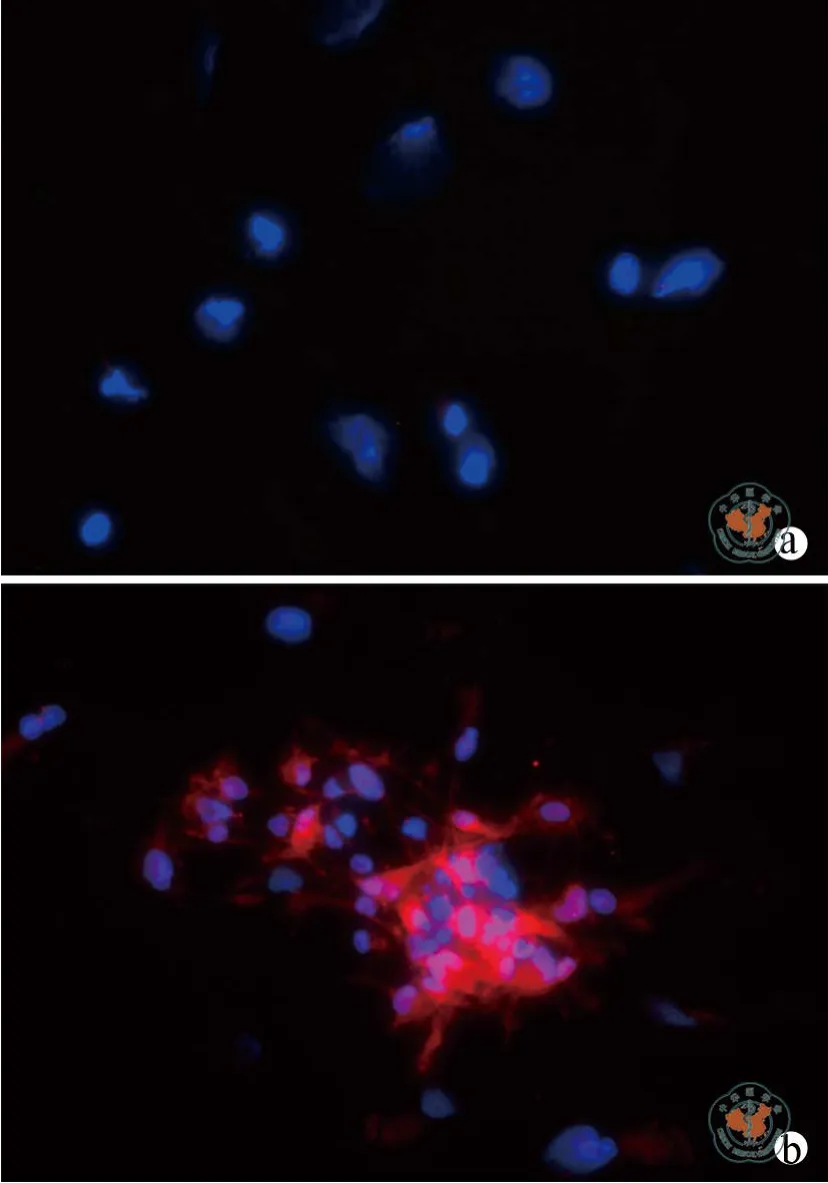
图2 荧光显微镜下观察分化组与对照组细胞ALDH1蛋白的表达(×200)

图3 分化组与对照组中各细胞标本ALDH1阳性细胞率的比较
Western blot结果显示对照组在胶片55 kDa水平处可见ALDH1蛋白条带,分化组此处条带明显减弱或消失(图4)。经扫描及以β-actin为内参计算灰度比值,分化组的ALDH1相对蛋白含量为0.035±0.009,对照组为 0.390±0.108,配对样本t检验显示分化组的ALDH1相对含量显著低于对照组,差异有统计学意义(表1)。
表1 分化组与对照组细胞ALDH1蛋白的表达情况(±s)
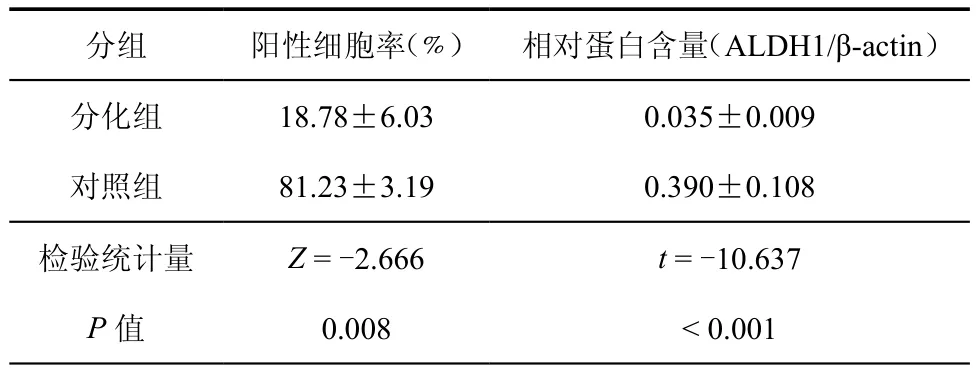
表1 分化组与对照组细胞ALDH1蛋白的表达情况(±s)

图4 Western blot检测分化组与对照组细胞的ALDH1相对蛋白含量
讨 论
ALDH1是一种细胞质酶,相对分子质量为55 kDa,包括 ALDH1A1、ALDH1A2和 ALDH1A3 3 个亚型[6]。其中,ALDH1A1是优势亚型,ALDH1主要通过其发挥生理作用[7]。目前的研究表明ALDH1是多种不同来源的肿瘤干(祖)细胞通用的功能性分子标记[8-11]。在神经肿瘤中,笔者以往的研究通过定性观察发现ALDH1仅表达于未分化的胶质瘤干细胞[5],国外学者Rasper等[3]和Choi等[12]也指出多种颅内原发肿瘤中存在着ALDH高表达的肿瘤原始细胞,这种ALDH1+细胞具有脑肿瘤干细胞的特性。但是德国学者Adam等[4]却观察到ALDH1A1在成熟的星形胶质细胞和分化的胶质肿瘤细胞中有着强烈的表达,标志着细胞分化,对ALDH1可作为胶质瘤干细胞的标志物提出疑问。
为进一步分析ALDH1蛋白表达与细胞分化的相关性,本实验以原代培养的胶质瘤干细胞为研究对象,采用10﹪的胎牛血清对其中一部分细胞进行诱导分化,并以继续在无血清条件下培养的细胞为对照。胎牛血清可使神经干细胞发生一定倾向性分化,细胞迅速贴壁并快速增殖,原有特性消失,形成神经元和胶质细胞。在含5﹪和10﹪胎牛血清的培养基中,神经干(祖)细胞增殖减少并明显向神经胶质细胞分化[13]。本研究中,分化组细胞经胎牛血清诱导后表现出了明显的异质性,形态显著改变,外形多样,完全贴壁生长,无聚集现象,这与Zhou等[14]报道的结果相似。对照组细胞则继续呈团状聚集,形态较为一致,细胞密度高,呈现出干细胞样生长的特点。
在ALDH1蛋白检测中,免疫荧光染色的结果显示分化组内仅个别细胞的胞浆内可见微量的蛋白荧光。而对照组中,多数细胞的胞浆内均可见中量至大量的蛋白荧光,荧光主要集中于细胞聚集区的顶部,底部及周边区域细胞荧光有所减弱,这可能因为贴壁培养下聚集区底部及周边区域的细胞存在着一定分化[15]。柱状图分析显示分化组各细胞标本的ALDH1阳性率均低于对照组,说明两组细胞ALDH1蛋白的表达在各标本间不存在不一致性。Western blot的结果进一步证实对照组各细胞标本均显著表达ALDH1蛋白,实验中可在55 kDa水平处发现明显的蛋白条带;而分化后细胞的ALDH1表达降低,其55 kDa水平的条带显影减弱,个别甚至观察不到。经统计学分析,分化组的ALDH1阳性细胞率和相对蛋白含量均显著低于对照组。
上述的实验结果表明ALDH1蛋白表达在分化的胶质瘤细胞中有明显下降,与Adam等[4]的实验结果不同。笔者认为产生这一差异的原因可能有:(1)Adam等的研究直接检测了肿瘤组织ALDH1的表达情况,而本实验的研究对象为原代培养的肿瘤细胞,二者细胞所处的微环境存在不同,可能影响了细胞表型。(2)尽管实验均使用单克隆抗体,但不排除交叉反应等抗体的非特异性结合仍在一定程度上干扰了研究结果。(3)Adam等的实验仅应用了免疫组织化学法检测肿瘤组织蛋白表达,缺乏其他蛋白检测技术的进一步验证。以上问题的答案还有待于后续的研究来揭示。
综上所述,本实验半定量分析了在不同培养环境下胶质瘤干细胞的ALDH1蛋白表达情况,进一步证实了ALDH1蛋白主要表达于未分化细胞,经诱导分化后细胞的ALDH1含量呈显著下降,提示在体外研究中ALDH1主要存在于较为原始的肿瘤细胞,作为可能的胶质瘤干细胞标志物仍有进一步研究价值。
1 Batash R, Asna N, Schaffer P, et al. Glioblastoma multiforme, diagnosis and treatment; recent literature review[J]. Curr Med Chem, 2017,24(27):3002-3009.
2 Auffinger B, Spencer D, Pytel P, et al. The role of glioma stem cells in chemotherapy resistance and glioblastoma multiforme recurrence[J].Expert Rev Neurother, 2015, 15(7):741-752.
3 Rasper M, Schaefer A, Piontek G, et al. Aldehyde dehydrogenase 1 positive glioblastoma cells show brain tumor stem cell capacity[J].Neuro Oncol, 2010, 12(10):1024-1033.
4 Adam SA, Schnell O, Poeschl J, et al. ALDH1A1 is a marker of astrocytic differentiation during brain development and correlates with better survival in glioblastoma patients[J]. Brain Pathol, 2012,22(6):788-797.
5 王鹏, 毛庆, 王翔, 等. 胶质母细胞瘤中CD133+细胞的贴壁培养和乙醛脱氢酶1的表达[J]. 四川大学学报(医学版), 2011, 42(3):413-416.
6 Flahaut M, Jauquier N, Chevalier N, et al. Aldehyde dehydrogenase activity plays a key role in the aggressive phenotype of neuroblastoma[J]. BMC Cancer, 2016, 16(1):781.
7 Tomita H, Tanaka K, Tanaka T, et al. Aldehyde dehydrogenase 1A1 in stem cells and cancer[J]. Oncotarget, 2016, 7(10):11018-11032.
8 Roudi R, Korourian A, Shariftabrizi AA. Differential expression of cancer stem cell markers ALDH1 and CD133 in various lung cancer subtypes[J]. Cancer Invest, 2015, 33(7):294-302.
9 Dolle L, Best J, Empsen C, et al. Successful isolation of liver progenitor cells by aldehyde dehydrogenase activity in naive mice[J].Hepatology, 2012, 55(2):540-552.
10 Yang L, Ren Y, Yu X, et al. ALDH1A1 defines invasive cancer stemlike cells and predicts poor prognosis in patients with esophageal squamous cell carcinoma[J]. Mod Pathol, 2014, 27(5):775-783.
11 Wang YC, Yo YT, Lee HY, et al. ALDH1-Bright epithelial ovarian cancer cells are associated with CD44 expression, drug resistance, and poor clinical outcome[J]. Am J Pathol, 2012, 180(3):1159-1169.
12 Choi SA, Lee JY, Phi JH, et al. Identification of brain tumour initiating cells using the stem cell marker aldehyde dehydrogenase[J]. Eur J Cancer, 2014, 50(1):137-149.
13 Lu HX, Yang ZQ, Jiao Q, et al. Low concentration of serum helps to maintain the characteristics of NSCs/NPCs on alkali-treated PHBHHx film in vitro[J]. Neurol Res, 2014, 36(3):207-214.
14 Zhou XP, Zheng C, Shi Q, et al. Isolation, cultivation and identification of brain glioma stem cells by magnetic bead sorting[J]. Neural Regen Res, 2012, 7(13):985-992.
15 Pollard SM, Yoshikawa K, Clarke ID, et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens[J]. Cell Stem Cell, 2009,4(6):568-580.
