人脐带间充质干细胞在Balb/c裸鼠体内的分布情况研究
2018-04-25谢长峰马炜彭浩杨晓菲曾桂芳刘云城刘沐芸胡祥
谢长峰 马炜 彭浩 杨晓菲 曾桂芳 刘云城 刘沐芸,4 胡祥
人脐带间充质干细胞(human umbilical cordderived mesenchymal stem cells,hUCMSCs)由于其独特的免疫学表型,不表达HLA-Ⅱ类分子和共刺激分子,不引起同种异体淋巴细胞增殖反应[1],因而移植入宿主体内的MSCs可避免宿主的免疫排斥,通过细胞间相互作用和旁分泌等作用抑制过度活跃的T细胞增殖及过度免疫[2],从而达到免疫重建的作用,进而为临床上应用于自身免疫病提供了理论基础。软琼脂克隆实验证实hUCMSCs在体外无致瘤性,体外共培养实验也证实hUCMSCs对肿瘤细胞的增殖没有影响[3]。hUCMSCs对裸鼠移植瘤的生长没有促进作用,不同代次的hUCMSCs接种于免疫缺陷鼠也不具有致瘤性[4]。这些研究为hUCMSCs的临床应用提供了重要的安全性数据,但hUCMSCs的体内过程究竟如何,目前所知尚少。本研究采用一种亲脂性近红外荧光染料DiR标记hUCMSCs,探索hUCMSCs给药后在小鼠体内的分布情况,为阐释hUCMSCs的体内过程提供基础。
材料和方法
一、材料
注射用hUCMSCs(深圳市北科生物科技有限公司,批号:1280200012502000);CO2恒温培养箱(日本三洋公司);久保田5120离心机(日本久保田公司);荧光染料DiR(美国Caliber life Science公司,批号 13D0708-15339);FACS Calibur流式细胞仪(美国BD公司);IVIS Spectrum小动物活体成像仪(美国PerkinElmer公司);雄性SPF级Balb/c裸小鼠(18 ~ 22 g,购自广东省医学实验动物中心,合格证号:44007200042000);动物饲养于屏障环境中的IVC笼内。本实验使用的动物经过实验动物伦理委员会的批准,批准号为BK-2017-01。
二、方法
1. hUCMSCs荧光标记:DiR染料以无水乙醇配制成5 mmol/L贮存液,分装,-20℃冻存,临用时取出解冻复温后使用。以贴壁法[3]制备hUCMSCs,以生理盐水配制成2×107个/ml,加入DiR染料使其终浓度为 300 μmol/L[5],置于 37 ℃、5 ﹪ CO2恒温培养箱孵育30 min,300×g 10 min离心2次,弃上清液,以生理盐水重悬为1×107个/ml。
2.生长曲线:细胞接种于96孔板,分别于0,24,48,72,96,120 h 以 MTT 比色法[6]测定 DiR 标记和未标记hUCMSCs的生长曲线,每个检测点设3个复孔。
3.细胞表面抗原流式分析:对DiR标记后体外培养3 d和未标记hUCMSCs的细胞表面抗原进行流式分析[3]。
4.多向诱导分化:对DiR标记和未标记hUCMSCs进行成骨、成脂、成软骨定向诱导分化能力检测[3]。
5.给药:实验组小鼠尾静脉注射给予DiR标记hUCMSCs 2×106个/只,对照组给予生理盐水0.2 ml。
6.活体成像:给药小鼠采用5﹪戊巴比妥钠0.2 ml/只腹腔注射麻醉。分别于细胞注射后15 min、4 h、24 h、48 h、72 h、1 周、2 周、4 周进行动物活体成像,并于 15 min、4 h、24 h、48 h、72 h、1 周、4 周处死部分动物,取心、肝、脾、肺、肾进行器官成像。采用710 nm波长激发,760 nm波长检测。
三、统计学分析方法
结 果
一、DiR染色后的细胞生长情况
培养期间,DiR标记和未标记hUCMSCs均贴壁生长,胞体呈长梭形或扁平状,细胞呈旋涡状生长。在培养的 0、24、48、72、96 和 120 h,MTT 法测得的DiR标记hUCMSCs和未标记hUCMSCs的细胞增殖差异无统计学意义(表1,P > 0.05),二者生长曲线基本重合。
二、细胞流式检测结果
细胞流式检测结果显示,DiR标记和未标记hUCMSCs均强表达 CD90、CD73、CD105,弱表达CD45、CD34、CD79a、CD14 和 HLA-DR(图1 ~ 2)。
三、DiR染色后的hUCMSCs多向诱导分化结果
成骨诱导分化的第28天,DiR标记和未标记hUCMSCs组在倒置显微镜下均可观察到细胞间钙化基质的沉积(图3c,图3b),未加成骨诱导培养基的对照组未见细胞间钙质沉积(图3a)。
表1 细胞接种后不同时间DiR标记和未标记hUCMSCs细胞增殖的MTT比色法检测结果比较(±s)

表1 细胞接种后不同时间DiR标记和未标记hUCMSCs细胞增殖的MTT比色法检测结果比较(±s)

图1 未标记hUCMSCs免疫表型细胞流式检测
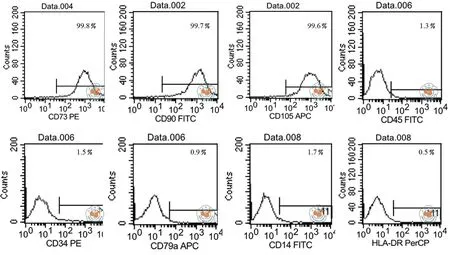
图2 DiR标记hUCMSCs免疫表型细胞流式检测
成脂诱导分化的第21天,DiR标记和未标记hUCMSCs组在倒置显微镜下均可观察到细胞内红色脂滴形成(图4c,图4b),未加成脂诱导培养基的对照组未见脂滴形成(图4a)。
成软骨诱导分化的第21天,DiR标记和未标记hUCMSCs组在倒置显微镜下均可观察到细胞间蓝色软骨基质的明显沉积(图5c,图5b),未加成软骨诱导培养基的对照组细胞间蓝色斑块沉积不明显(图5a)。
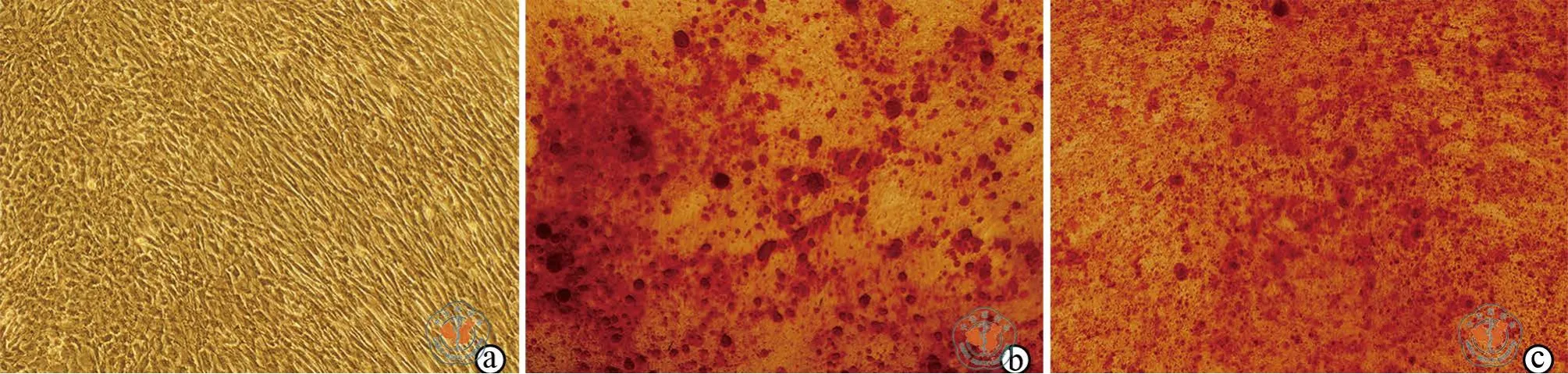
图3 倒置显微镜下观察DiR标记hUCMSCs的成骨诱导分化(茜素红染色,×100)
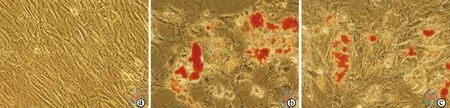
图4 倒置显微镜下观察DiR标记hUCMSCs的成脂诱导分化(油红O染色,×400)
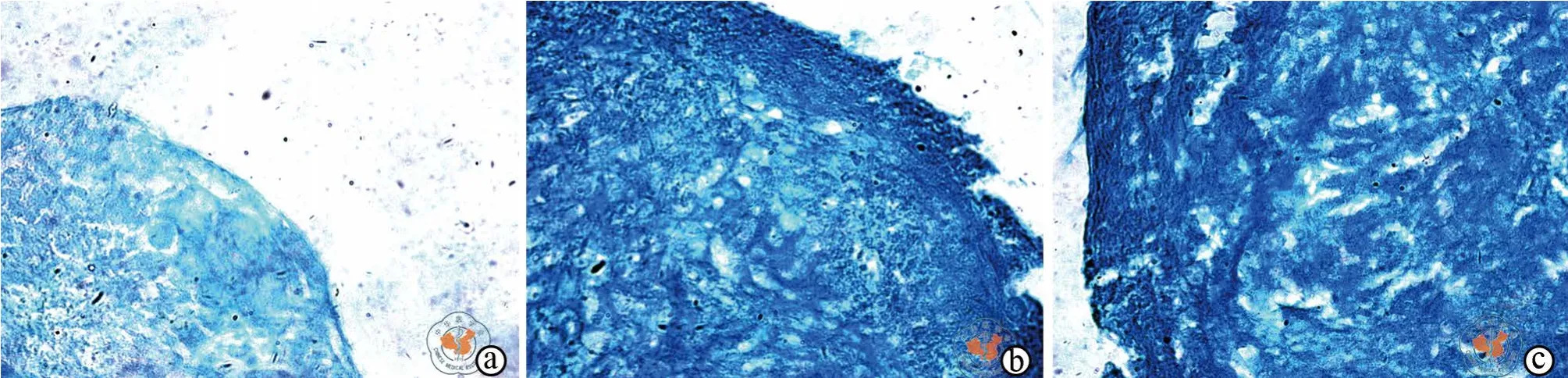
图5 倒置显微镜下观察DiR标记hUCMSCs的成软骨诱导分化(阿尔辛蓝染色,×100)
四、荧光成像结果
DiR标记hUCMSCs尾静脉注射给药后,15 min裸鼠背侧和腹侧成像均可见胸部强烈荧光,器官成像结果显示荧光主要集中在肺脏;4 h裸鼠背侧和腹侧成像均可见胸部和上腹部强烈荧光,器官成像结果显示荧光主要集中在肺脏和肝脏;24 h裸鼠背侧和腹侧成像均可见胸部和上腹部强烈荧光,器官成像结果显示荧光主要集中在肺脏、肝脏和脾脏;48 h裸鼠背侧成像可见颈部以下较强弥漫性分布荧光,腹侧成像可见荧光主要集中在胸、腹部,器官成像结果表明荧光主要集中在肺脏、肝脏和脾脏;72 h裸鼠背侧成像可见头颈部散在荧光及胸腹部较强弥漫性分布荧光,腹侧成像可见小鼠口鼻、前肢趾爪、后肢上部、尿道口及肛周散在较弱荧光,胸、腹部可见较强荧光,器官成像结果表明荧光主要集中在肺脏、肝脏和脾脏,肠道内容物呈蓝黑色,未显示出荧光;1周裸鼠背侧和腹侧成像均可见胸腹部荧光,器官成像结果表明荧光主要集中在肝脏、肺脏和脾脏;4周裸鼠背侧和腹侧成像均未见荧光,器官成像结果发现肝脏、脾脏和肺脏仍有荧光存在;对照组无论哪个时间背侧、腹侧还是器官成像均无荧光(图6)。
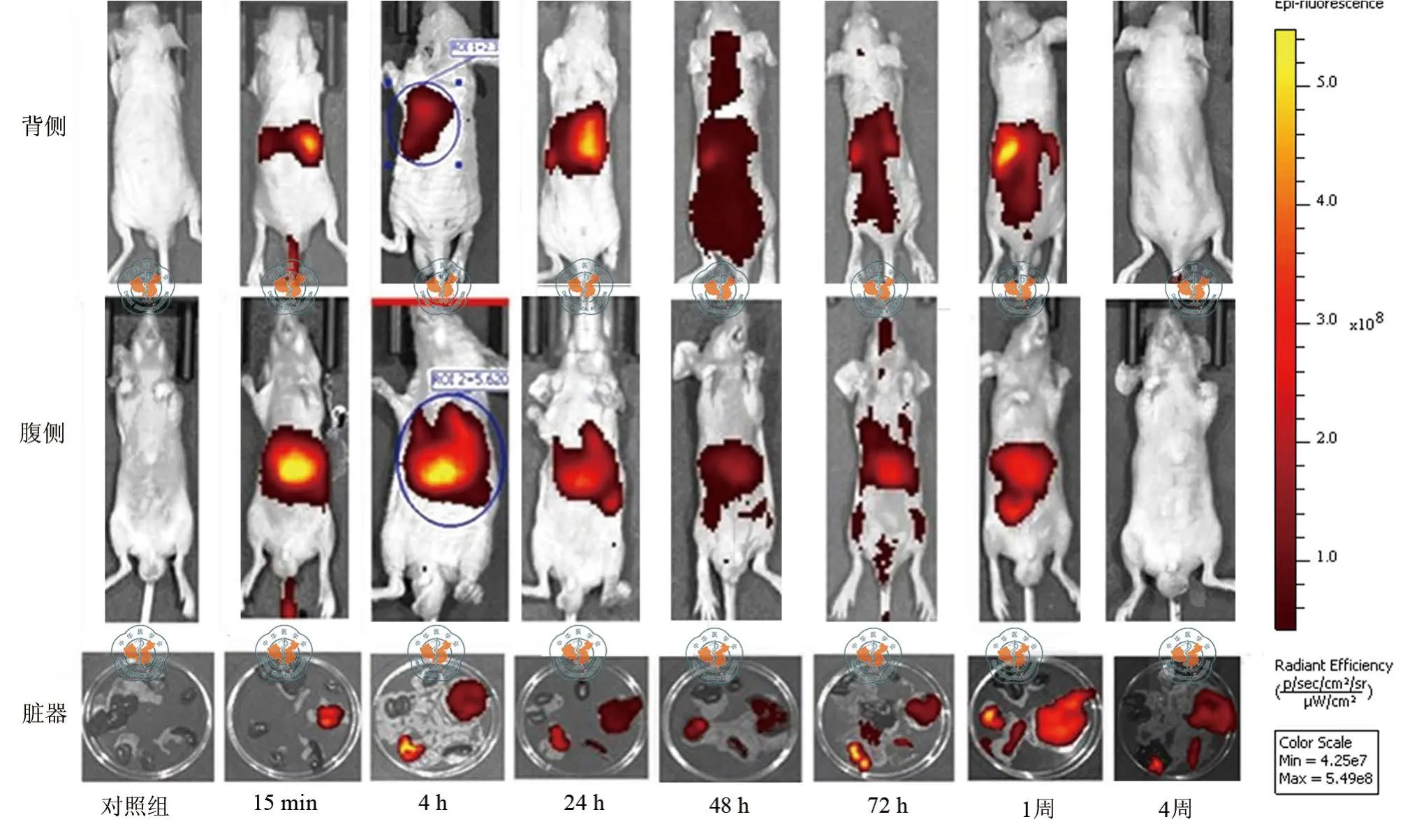
图6 DiR标记hUCMSCs注射给药后小鼠荧光成像
讨 论
干细胞示踪一直是个世界范围内的难题。目前的干细胞标记示踪方法主要有Hoechst和Dil等胞浆标记物,胸腺嘧啶同位素、5-溴脱氧尿嘧啶核苷标记等核酸标记物,插入细胞并表达特异性标志物的报告基因标记,Y染色体标记示踪、常染色体标记示踪、循环细胞标记示踪、光学成像、核医学分子显像活体示踪及磁共振细胞成像活体示踪等细胞标记和成像技术[7-8]。各种标记示踪方法各有其优缺点。
DiR是一种亲脂性荧光染料,染色标记方法简单易行。染色时DiR插入细胞膜磷脂双分子层,在整个细胞膜上扩散,可使整个细胞膜染色,710 nm波长激发后发射760 nm近红外荧光,可与动物皮毛、肌肉的自发荧光区分开来,从而可用于细胞的小动物体内示踪[5]。DiR标记细胞分裂时,染料随细胞膜被平均分配给分裂的子代细胞;染色后,DiR染料不在标记细胞与非标记细胞之间转移;DiR标记细胞的裂解物也不会在动物特定部位显示荧光[9]。这些特性使得DiR成为细胞活体示踪的一种优秀染料。
本实验采用DiR标记hUCMSCs注射给药后研究hUCMSCs在Balb/c裸鼠体内的分布行为。DiR标记hUCMSCs与未标记hUCMSCs在体外培养的生长行为一致;DiR标记对细胞流式常用的PE、FITC、APC、PerCP荧光染料检测结果没有明显干扰,对hUCMSCs的细胞表型没有影响;同时DiR标记也不影响hUCMSCs的多向诱导分化能力。
DiR标记hUCMSCs贴壁生长、细胞形态呈长梭形、细胞表型强表达 CD90、CD73、CD105,弱表达 CD45、CD34、CD79a、CD14和 HLA-DR,具有向成骨、成脂、成软骨细胞的诱导分化能力,符合国际干细胞学会对于间充质干细胞的标准要求[10]。
DiR标记hUCMSCs尾静脉注射后,15 min时荧光主要集中分布在裸鼠的肺部;4 h主要集中分布在肺脏和肝脏,分布浓度肺脏>肝脏;24 h以后主要分布在肺脏、肝脏及脾脏,分布浓度肺脏>肝脏 >脾脏;48 ~72 h时,荧光略呈弥漫性分布,裸鼠口鼻、趾、爪、尿道口、肛周及小鼠肢体皮肤均有荧光分布,提示部分标记细胞可能死亡裂解,染料随呼吸、尿液排泄污染了上述部位,然而内容物颜色异常的肠道并未显示出较强荧光,肝脏颜色变深并显示强烈荧光,器官分布浓度肺脏>肝脏>脾脏;1周和2周活体成像荧光持续减弱(2周仅做了活体成像,数据未列),4周时大部分动物体表已观察不到荧光,但剖取器官后肺脏、肝脏和脾脏仍有较强荧光,分布浓度肝脏>脾脏>肺脏。以上结果提示,尾静脉注射后hUCMSCs首先分布在裸鼠的肺部,然后部分细胞从肺部迁移出来分布到肝脏,再有部分细胞迁移分布到脾脏,随时间推移,肺部hUCMSCs逐渐向肝脏和脾脏迁移和分布,肝脏和脾脏分布逐渐增多,肺脏分布逐渐减少。推测尾静脉注射后,hUCMSCs经上、下腔静脉回流到裸鼠心脏,由于hUCMSCs细胞直径较大(约15 μm),所以肺循环时绝大部分hUCMSCs被截留在肺脏,因而存在明显的首过效应;自肺脏迁移出来的hUCMSCs被肝脏和脾脏内皮系统截留形成再次分布,最终hUCMSCs主要归巢在肝脏、脾脏和肺脏,观察至第4周时仍有较多细胞存活。细胞在体内逐渐被代谢掉,可能肝脏是主要的代谢器官,代谢物随呼吸、尿液、粪便排出体外。
本研究初步揭示了hUCMSCs静脉注射后在Balb/C裸鼠体内的动态分布及归巢,但hUCMSCs在分布部位的最终分化和转归仍不清楚。hUCMSCs具有免疫调节能力和组织再生功能,在炎症微环境下具有向受损组织趋化的能力[11],相比正常动物,其在疾病模型动物的分布应有所不同;由于人与小动物的毛细血管及网状内皮系统不同,人体网状内皮系统对其截流可能较少,因此hUCMSCs在人体的组织分布也应有所不同,可能较小动物更为分散;此外由于对炎症微环境的趋化,hUCMSCs在患者与健康人的组织分布也应有所不同,有可能更多地分布在组织受损部位。未来将开展更多的研究以及更长时间的观察,来进一步阐释hUCMSCs在动物甚至人体的体内过程。
1 Baksh D, Song L, Tuan RS. Adult mesenchymal stem cells:characterization, differentiation, and application in cell and gene therapy[J]. J Cell Mol Med, 2004, 8(3):301-316.
2 吴世凯, 丁长才, 柏芸等. 成体干细胞临床应用研究[J]. 现代生物医学进展, 2010, 10(14):2763-2767.
3 曾桂芳, 谢长峰, 徐绍坤, 等. 人脐带间充质干细胞对肿瘤细胞生长及软琼脂克隆形成的影响[J/CD]. 中华细胞与干细胞杂志(电子版),2016, 6(2):97-104.
4 谢长峰, 杜杰, 曾桂芳, 等. 人脐带间充质干细胞对裸鼠的促瘤和致瘤性研究[J/CD]. 中华细胞与干细胞杂志(电子版), 2016, 6(6):356-362.
5 Kalchenko V, Shivtiel S, Malina V, et al. Use of lipophilic near-infrared dye in whole-body optical imaging of hematopoietic cell homeing[J]. J Biomed Opt, 2006, 11(5):050507.
6 曾四平. MTT法测定mir-129对肾癌细胞SN12-PM6生长曲线的实验研究[J]. 齐齐哈尔医学院学报, 2014, 35(20):2965-2966.
7 段峰, 王茂强. 干细胞标记示踪技术的研究进展[J]. 国际医学放射学杂志, 2009, 32(6):563-566.
8 牛艳君, 李莹, 白仲添, 等. 干细胞标记及示踪技术的应用研究[J]. 基础医学与临床, 2015, 35(4):528-530.
9 Youniss FM, Sundaresan G, Graham LJ, et al. Near-infrared imaging of adoptive immune cell therapy in breast cancer model using cell membrane labeling[J]. PLoS ONE. 2014, 9(10): e109162
10 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stem cells.The International Society for Cellular Therapy position statement[J]. Cytotheapy, 2006, 8(4):315-317.
11 Costa MHG, McDevitt TC, Cabral JMS, et al. Tridimensional configurations of human mesenchymal stem/stromal cells to enhance cell paracrine potential towards wound healing processes[J]. J Biotechnol, 2017, 262:28-39.
