人源EC-SOD在毕赤酵母中的构建与表达
2018-04-24林士森刘玮洁林靖颖杨楠楠刘树滔
林士森, 刘玮洁, 林靖颖, 杨楠楠, 刘树滔
(福州大学生物工程研究所, 福建 福州 350002)
0 引言
胞外超氧化物歧化酶(extracellular superoxide dismutase, EC-SOD)是一类含Cu、 Zn原子的SOD酶类, 可高效催化超氧阴离子自由基歧化为H2O2与O2, 能够清除体内多余的氧自由基[1], 在组织损伤修复、 口腔癌、 肺损伤等方面的治疗有明显效果[2-4], 具有较高潜在价值. 但EC-SOD在生物体内的含量远低于其它SOD同工酶, 目前主要从动物主动脉和肺部中提取, 提取工艺繁琐且最终获取量较低, 不利于工业化生产应用[5-6]. 工业生产中为了解决产量少的问题, 通常利用基因工程技术构建高效表达菌株, 便于制备大量EC-SOD投入于生产应用. 但在许多表达系统中, 如细菌表达系统, 存在无法对真核蛋白进行正确的加工处理、 表达蛋白常以包涵体形式存在等一系列问题[7-8]; 在哺乳动物系统中, 其表达重组蛋白结构与天然蛋白高度相似但表达量较低[9]. 因此采用甲醇营养型毕赤酵母表达体系, 表达的目的蛋白能够分泌至胞外, 有利于工业上的分离纯化, 其表达的蛋白能够形成二硫键、 糖基化修饰等高级结构, 且表达量高, 与天然蛋白相似, 为人源EC-SOD的获取提供了极大的便利[10].
目前已有构建EC-SOD表达菌株的少量报道, 在酵母表达系统的研究中[11], 其发酵液通过超滤浓缩后, EC-SOD表达量也仅有0.45 mg·mL-1, 酶活力为760 U·mg-1, 可见其构建的表达菌株并不能满足工业化需求, 并且N端存在多余氨基酸(谷氨酸、 苯丙氨酸), 使重组蛋白与天然EC-SOD的N端结构存在一定差异. 本研究在前人基础上, 致力于改善酶活较低, N端非天然产物等问题, 以人源EC-SOD基因为出发点, 对比毕赤酵母最适密码子并对其修改, 以期显著提高毕赤酵母的表达水平, 且与天然EC-SOD结构更加相似. 研究利用基因工程技术构建EC-SOD毕赤酵母表达菌株, 并对其表达的EC-SOD进行性质分析与酶活力测定.
1 材料与方法
1.1 菌株与质粒
pUC57由上海生工公司合成; 扩增菌株JM109、 表达菌株PichiapastorisX33及表达载体pPICZαA购自美国Invitrogen公司.
1.2 主要药品与试剂
DNA marker DL5000、 DL2000, 限制性内切酶EcoR I、SacI、XhoI、SalI、 PCR mix等购自日本Takara公司; UNIQ-10柱离心式质粒小量抽提试剂盒、 琼脂糖胶回收试剂盒、 Protein Molecular Weight Marker等购自上海生工生物工程公司、 美国Thermo Fish公司; 酵母提取物及胰蛋白胨等为美国Sigma公司产品; DEAE离子交换树脂为日本TOSOH公司产品; 其余试剂药品均为分析纯.
1.3 实验方法
1.3.1 表达载体的构建
由上海生工公司合成的含有人源EC-SOD密码子优化后基因(687 bp)的pUC57质粒, 质粒设计中在基因前后加入XhoⅠ(上游)和EcoRⅠ(下游)两个酶切位点, 同时引入2个碱性氨基酸Lys 和Arg以实现目的蛋白的胞外分泌. 最终确定引物上游为CTCGAGAAAAGATGGACTGGTGA及下游引物为GAATTCTTAAGCAGCCTTACATTCAG.
将pPICZαA质粒用EcoRⅠ和SalⅠ双酶切切开, 并从pUC57质粒上使用相同切下含有目的片段的序列(使用EcoRⅠ和SalⅠ酶切后序列大于目的基因序列, 但由于在设计基因序列中尾端含有终止密码子, 所以多余序列不影响表达)连接至pPICZαA载体上, 筛选重组质粒pPICZαA-EC-SOD, 转E.coli.(JM109), 筛选表达菌株JM109-EC-SOD提取质粒经EcoRⅠ与XhoⅠ双酶切并PCR验证筛选出目的菌株, 进一步使用SacⅠ线性化重组质粒进入毕赤酵母X33, 提取酵母基因组DNA经验证筛出目的菌株.
1.3.2 毕赤酵母的诱导与表达
目的蛋白的实验参考Invitrogen公司毕赤酵母表达手册说明书. 重组菌株Pichia.(X33) 置于YPD 培养基中, 30 ℃摇培24 h后, 按1%的接种量转接至不含葡萄糖的YP培养基中培养, 待OD600= 3.0~5.0开始诱导(诱导前取样), 按1%(体积分数)的诱导剂量添加甲醇, 每隔24 h补加甲醇至终体积分数为1%并取样1 mL测酶活, 在诱导第6天和第7天后酶活趋于稳定, 无明显增加, 因此只需诱导5 d.
1.3.3 EC-SOD初步分离纯化
由于目的蛋白理论等电点为6.4左右, 在pH值为8的条件下, 能使杂蛋白吸附到DEAE弱阴离子交换树脂上, 目的蛋白不能被吸附, 从而起到分离的作用. 因此将发酵液离心后, 取上清3 L进行硫酸铵沉淀, 用30 mL pH值为8的缓冲液溶解沉淀, 并用截留相对分子质量为3 500 u隔夜透析. 使用柱体积30 cm×φ1 cm的层析柱, 以1 mL·min-1流速上样5 mL样品, 收集穿透峰并用OD280检测及酶活测定, 验证其中含有重组蛋白EC-SOD.
1.3.4 EC-SOD活性定性检测
对发酵液12 000 r·min-1离心10 min, 收集上清, SDS-PAGE 观察分析. 上清液与初步分离纯化样品采用盐酸羟胺法测定SOD酶活力[12], NBT活性电泳染色[13].
2 结果分析
2.1 表达载体的构建与验证
以pPICZαA质粒为真核表达载体, 构建EC-SOD基因毕赤酵母表达质粒, 经EcoRⅠ,XhoⅠ双酶切(见图1)及PCR验证(见图2). 箭号处为目的基因, 且重组质粒经测序检验含有目的基因, 这些结果均表明目的片段已成功连接至表达载体上.
随后将重组质粒使用SacⅠ线性化后, 电转化至毕赤酵母X33中, 在Zeocin抗性平板挑取单菌落培养并提取酵母基因组DNA, 进行PCR验证(见图3).
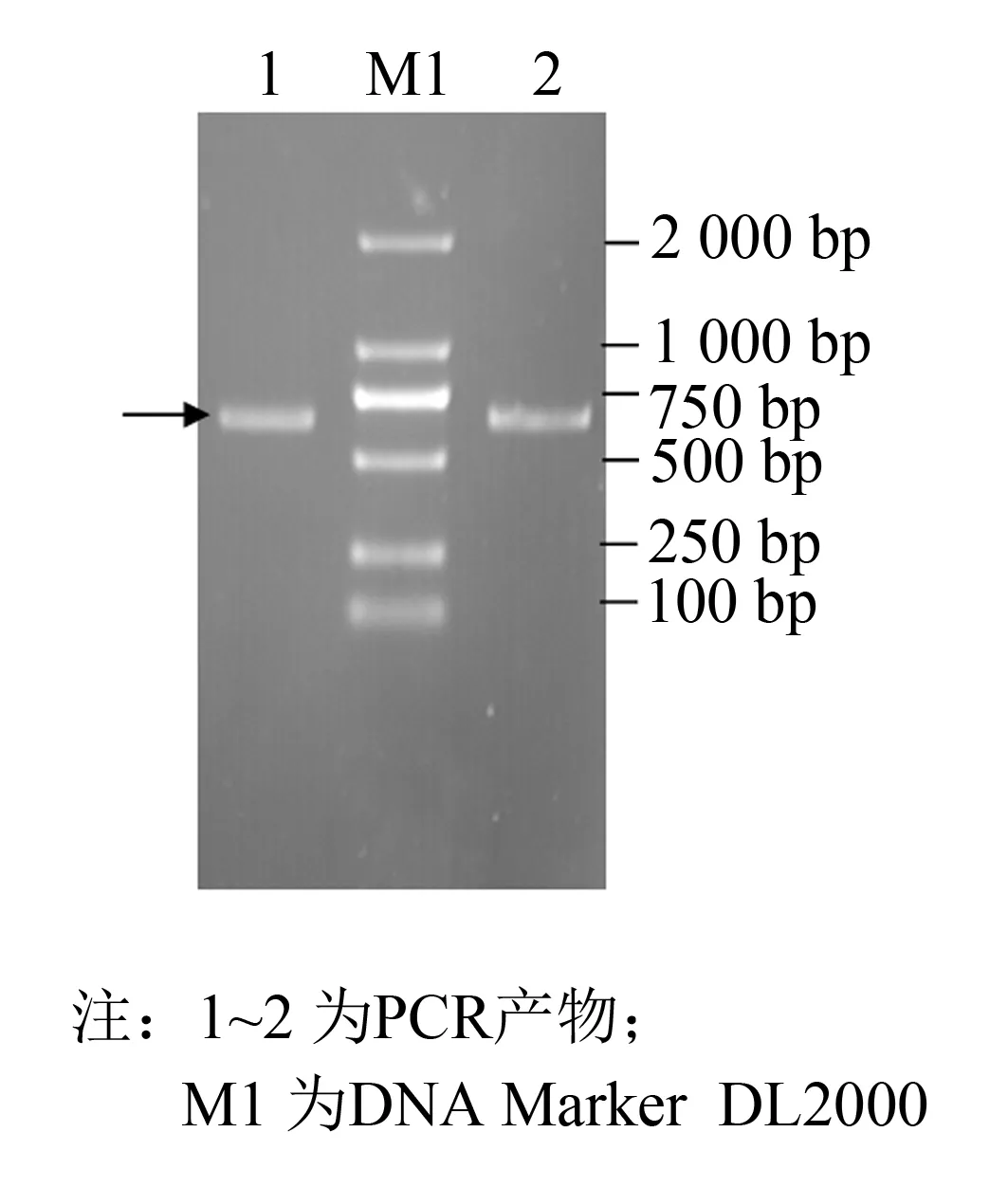
图1 重组质粒PCR产物Fig.1 PCR identification of the recombinant
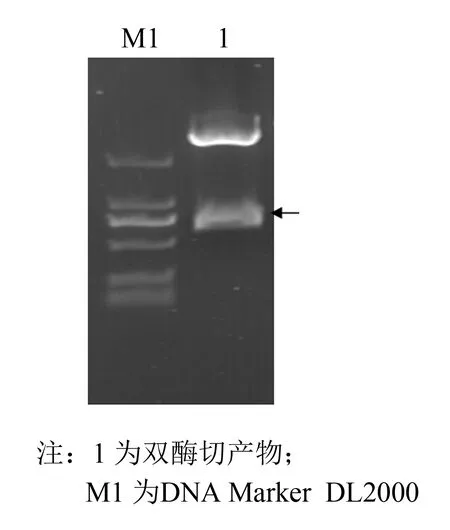
图2 重组质粒双酶切Fig.2 Enzyme digestion identification of the recombinant
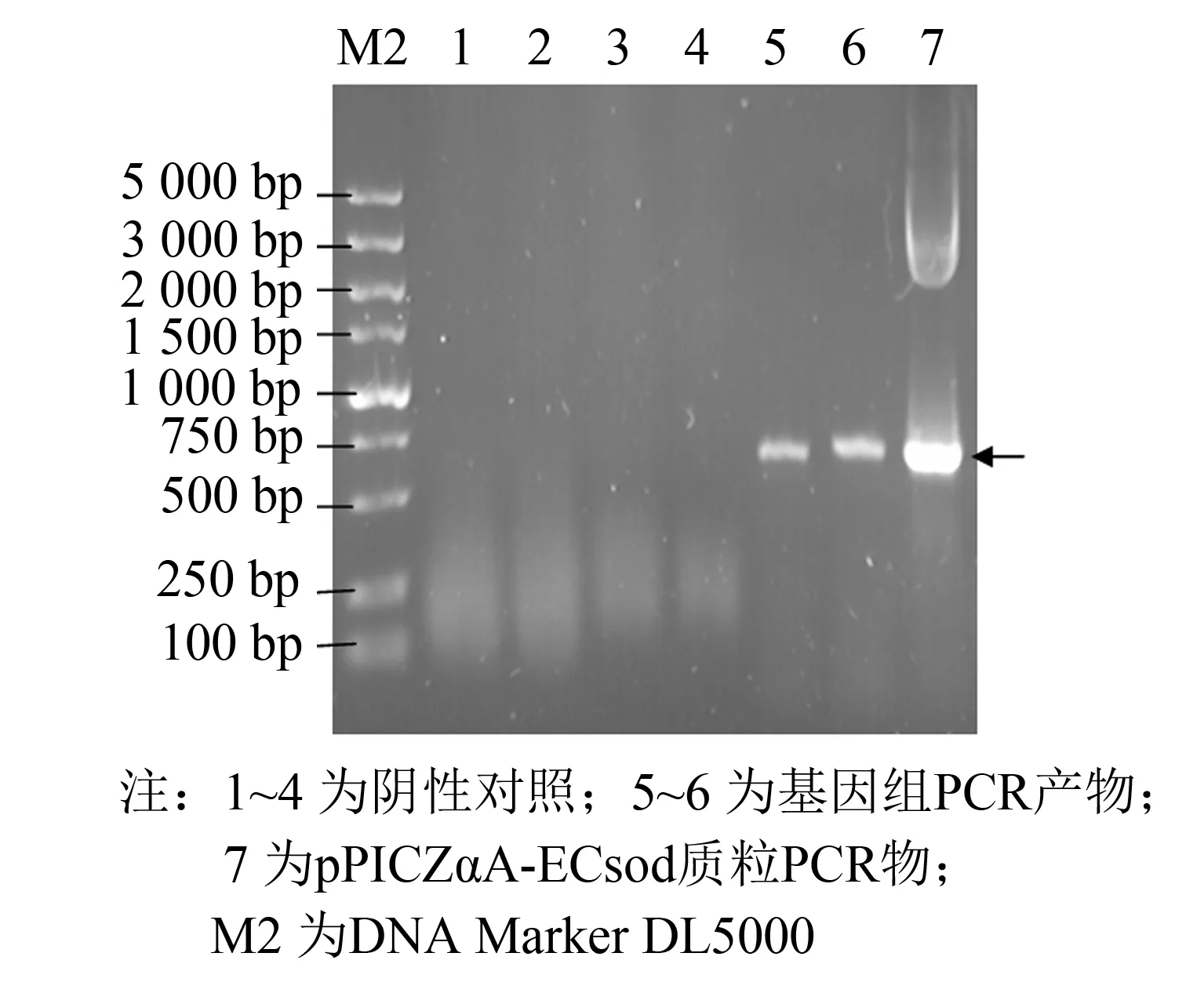
图3 酵母基因组PCR验证电泳图Fig.3 PCR identification of the chromosome of Pichia pastoris
2.2 rcEC-SOD诱导与表达及活力鉴定
25 mL培养基在100 mL三角瓶中培养并诱导5 d, 收集每日菌液离心取上清, 进行SDS-PAGE分析(见图4), 并使用盐酸羟胺法测定SOD酶活. 结果表明, 最终活力为178 U·mL-1, 比活为508 U·mg-1, 酶活随诱导天数增加而升高(见图5).
图4为毕赤酵母X33重组菌株表达产物的SDS-PAGE电泳图. 电泳结果显示, 在相对分子质量为17与40 ku处, 诱导前未表达EC-SOD, 诱导后出现EC-SOD的蛋白条带(见图4上下箭头部分), 且蛋白质条带伴随着诱导时间的增加而逐渐加深.
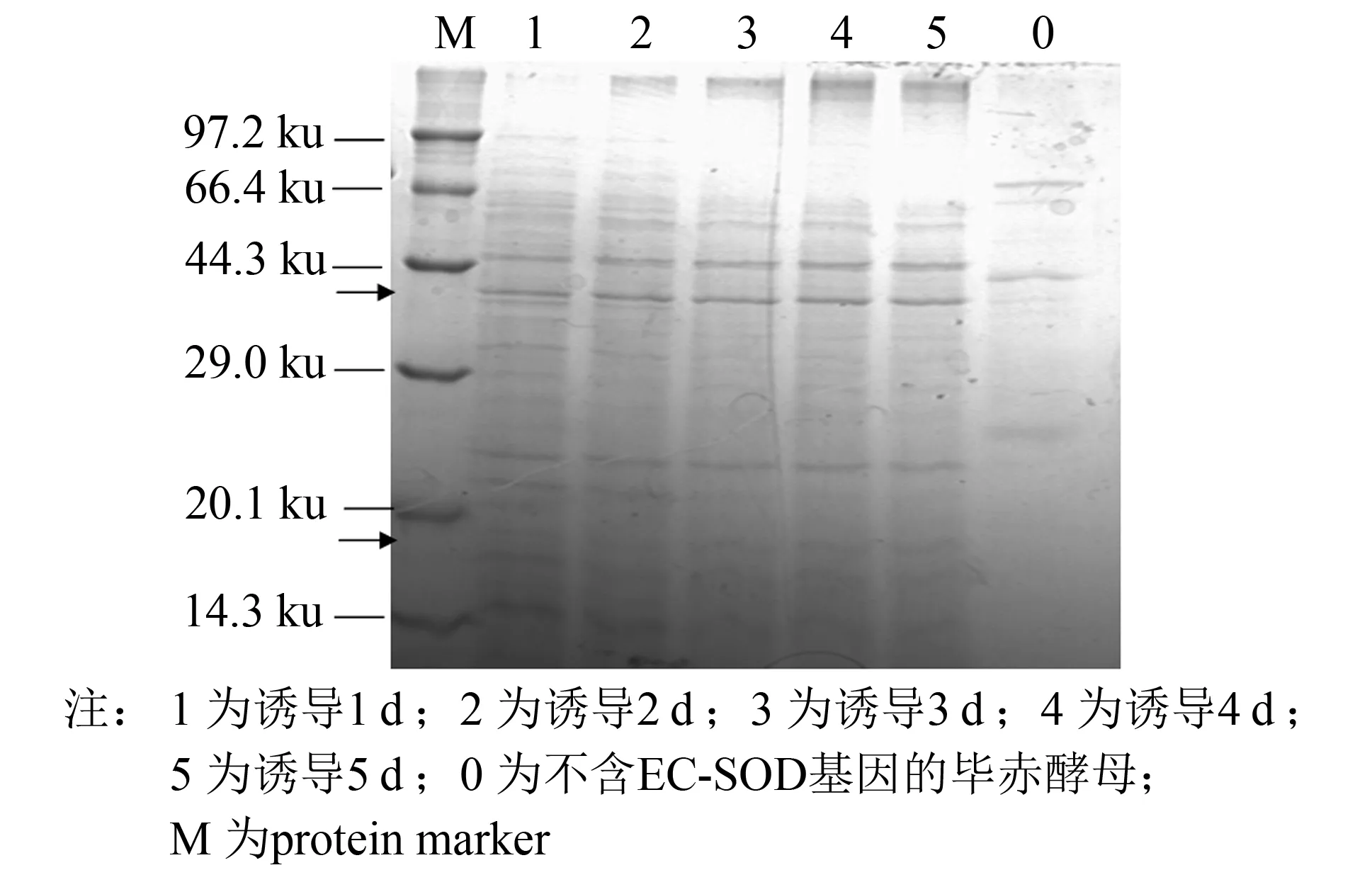
图4 毕赤酵母EC-SOD-X33发酵液上清电泳图Fig.4 SDS-PAGE analysis of the supernatant from Pichia pastoris
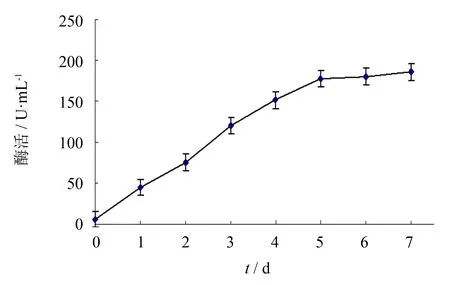
图5 毕赤酵母诱导过程中酶活变化趋势图Fig.5 Activity change trend of EC-SOD during the induction of Pichia pastoris for 5 days
2.3 rcEC-SOD初步分离纯化
发酵液上清经过硫酸铵沉淀, 透析后使用DEAE弱阴离子交换树脂进行初步分离纯化, 在pH=8.0时上样收集穿透峰, 用1 mol·L-1NaCl溶液洗脱杂蛋白. 纯化结果如图6所示, 箭头处为穿透峰, 经酶活测定穿透峰中含有大量EC-SOD, 洗脱峰中未检测到酶活性, 说明其中不含有EC-SOD. 收集穿透峰进行SDS-PAGE, 结果如图7所示, 穿透样品在17与40 ku处出现EC-SOD的蛋白条带, 进一步证实EC-SOD富集在穿透峰.
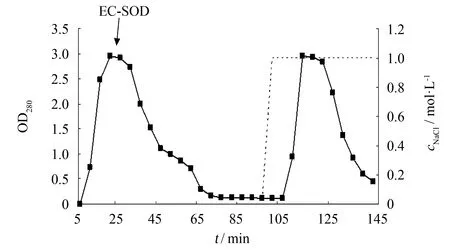
图6 EC-SOD-X33 DEAE弱阴离子交换树脂初步分离Fig.6 Purification of EC-SOD in DEAE resin
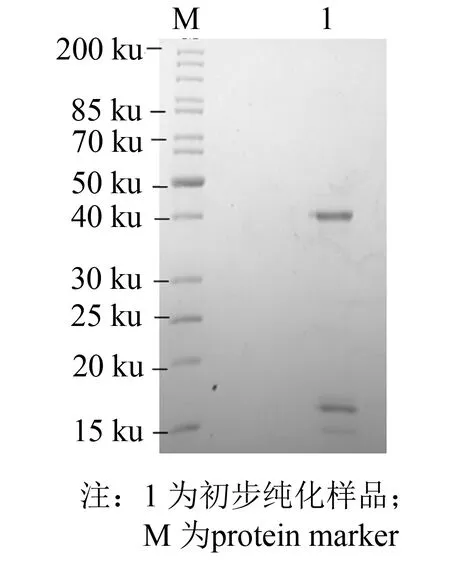
图7 EC-SOD-X33 DEAE弱阴离子交换树脂初步分离Fig.7 Preliminary preparation with DEAE resin
2.4 rcEC-SOD活性电泳染色
为进一步验证纯化后蛋白活性, 进行氯化硝基四氮唑蓝(NBT)法活性定性检测. 取发酵液上清与过DEAE弱阴离子树脂初步分离纯化液进行Native-Page凝胶电泳后, 利用NBT法对PAGE胶进行活性定性检测. 结果如图8、 9所示, 在没有EC-SOD的位置为蓝紫色背景, 发白位置出现清晰透明的SOD活性染色条带, 证实纯化的蛋白具有SOD酶活性.
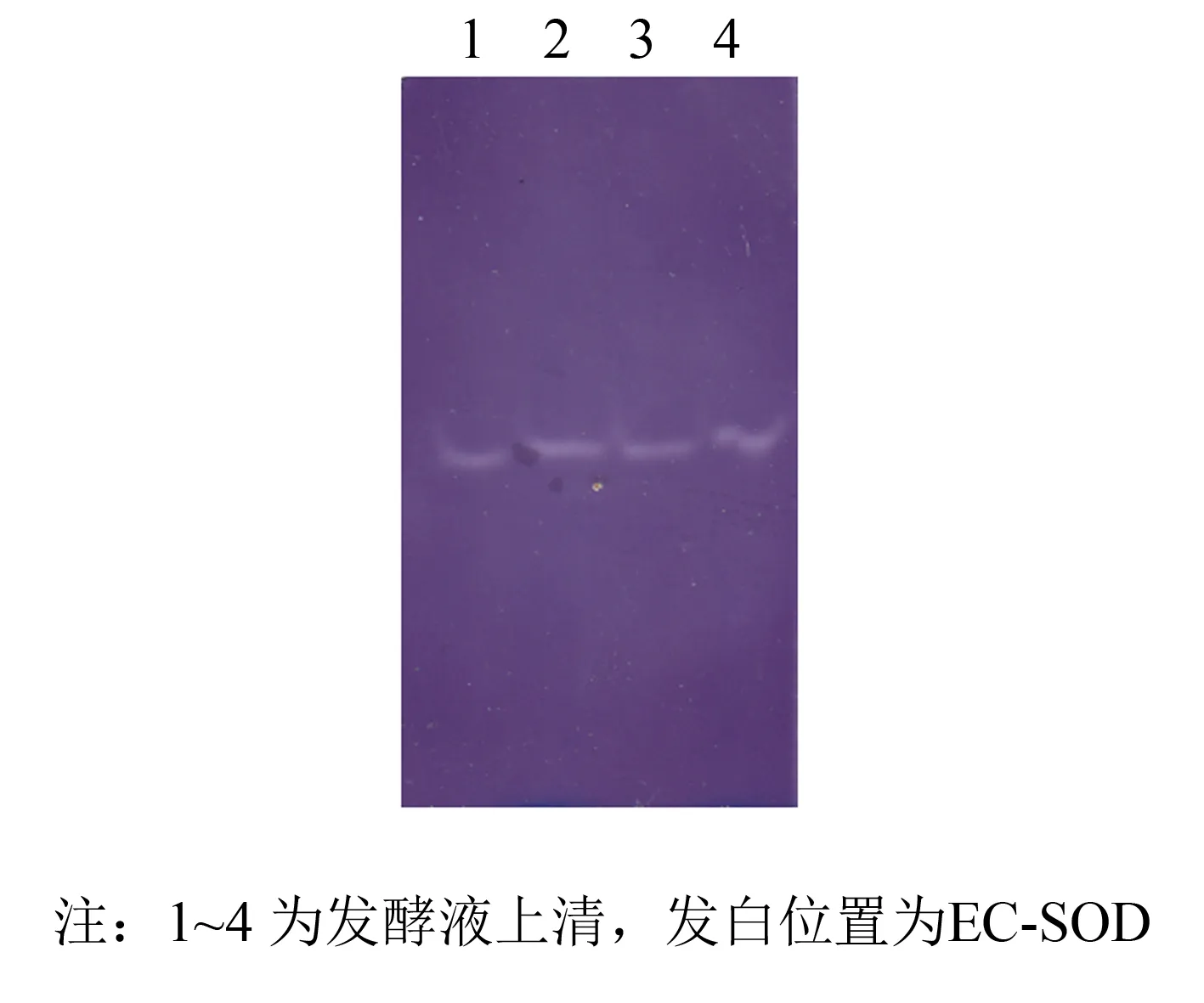
图8 发酵上清液NBT活性染色Fig.8 Supernatant in native-page and stain with NBT

图9 初步分离纯化蛋白活性染色Fig.9 Preliminary preparation in native-page and stain with NBT
3 讨论
实验在毕赤酵母表达系统中, 成功构建重组pPICZαA质粒, 并在Pichiapastoris中成功胞外分泌表达, 分泌出的EC-SOD蛋白具有活性高、 易分离纯化、 与天然蛋白相似的特点.
在毕赤酵母构建EC-SOD表达菌株的相关研究中, 已经有学者做过相关实验[11], 将发酵液浓缩后进行性质分析, 浓缩后比活约为760 U·mg-1, 该实验采用ELISA法定量出EC-SOD的蛋白含量, 所以比活相当于纯化后的蛋白比活. 但该研究未对EC-SOD基因进行密码子优化, N端存在多余的氨基酸(谷氨酸、 苯丙氨酸), 因此表达量与结构特性等方面有待提高.
本研究在前人研究的基础上加以改进, 首先对天然EC-SOD的基因序列进行密码子优化, 从理论上能够提高酵母的表达水平, 并删去N端信号肽, 直接连接毕赤酵母中的KEX2水解酶. 其次在序列设计中, 实验设计的蛋白序列与天然的EC-SOD一致, 拥有极其相似的生理活性. 经酶活与蛋白量测定, 在25 mL摇瓶上清液的比活约为508 U·mg-1, EC-SOD蛋白表达量为0.19 mg·mL-1, 5 L发酵罐中比活约909 U·mg-1, 经DEAE初步纯化后, 比活约为1 700 U·mg-1. 因此, 本实验中发酵上清液(未浓缩)的蛋白表达量和酶活都与前人实验中浓缩后的结果相近, 甚至更好. 由于实验设计的EC-SOD的N端序列与天然一致, 因此在比活力上得到显著提升. 通过NBT染色实验, 进一步验证重组菌株表达出具有活性的EC-SOD蛋白.
在实验的最终发酵产物中, 发现可能视为单体(17 ku)与二聚体(40 ku)的重组蛋白同时存在, 也可能是杂蛋白形式存在, 但并未对其作出验证, 需通过后续实验进一步分析. 通过文献查阅得知, 天然的EC-SOD主要是以四亚基形式存在, 亚基之间是靠疏水作用结合[14-15], 因此在SDS-PAGE仅能打断分子间的二硫键. 相关研究也表明重组表达的EC-SOD具有单体与二聚体结构共存的现象, 并且在Cu/Zn SOD中也存在类似单体与二聚体共存的情况[16], 由此可推断EC-SOD在溶液中可能存在多聚体结构.
参考文献:
[1] TIBELL L, AASA R, MARKLUND S L. Spectral and physical properties of human extracellular superoxide dismutase a comparison with CuZn superoxide dismutase[J]. Archives of Biochemistry and Biophysics, 1993, 304(2): 429-433.
[2] LAURILA J P, CASTELLONE M D, CURCIO A,etal. Extracellular superoxide dismutase is a growth regulatory mediator of tissue injury recovery[J]. Molecular Therapy the Journal of the American Society of Gene Therapy, 2009, 17(3): 448-454.
[3] YEN C C, LAI Y W, CHEN H L,etal. Aerosolized human extracellular dismutase prevents hyperoxia-induced lung injury[J]. PloS One, 2011, 6(10): e26870.
[4] 张超贤, 郭李柯, 郭晓凤. EC-SOD和GSTM1 基因多态性及吸烟与口腔癌风险关系研究[J]. 卫生研究, 2012, 41(4): 555-561.
[5] PETERSEN S V, OURY T D, OSTERGAARD L,etal. Extracellular superoxide dismutase (EC-SOD) binds to type I collagen and protects against oxidative fragmentation[J]. The Journal of Biological Chemistry. 2004, 279(14): 13705-13710.
[6] FATTMAN C L, ENGHILD J J, CRAPO J D,etal. Purification and characterization of extracellular superoxide dismutase in mouse lung[J]. Biochem Biophys Res Commun. 2000, 275(2): 542-548.
[7] SON Y J, BAE J Y, CHONG S H,etal. Expression, high cell density culture and purification of recombinant EC-SOD inEscherichiacoli[J]. Appl Biochem Biotechnol, 2010, 162(6): 1585-1598.
[8] 朱希强, 袁勤生. 重组人EC-SOD包涵体的稀释复性及重折叠后蛋白的纯化[J]. 中国生物制品学杂志, 2005, 18(3): 252-255.
[9] KIM S, KIM H Y, KIM J H,etal. Enhancement of potency and stability of human extracellular superoxide dismutase[J]. BMB Rep, 2015, 48(2): 91-96.
[10] CEREGHION G P L, CEREGHINO J L, LLGEN C,etal. Production of recombinant proteins in fermenter cultures of yeastPichiapastoris[J]. Current Opinion in Biotechnology, 2002, 13(4): 329-332.
[11] CHEN H L, YEN C C, TSAI T C,etal. Production and characterization of human extracellular superoxide dismutase in the methylotrophic yeastPichiapastoris[J]. Agricultural and Food Chemistry, 2006, 54(21): 8041-8047.
[12] ZHANG C, BRUINS M E, YANG Z Q,etal. A new formula to calculate activity of superoxide dismutase in indirect assays[J]. Analytical Biochemistry, 2016, 503: 65-67.
[13] 罗广华, 王爱国. 植物SOD的凝胶电泳及活性的显示[J]. 植物生理学通讯, 1983(6): 44-45.
[14] PETERSEN S V, OURY T D, VALNICKOVA Z,etal. The dual nature of human extracellular superoxide dismutase: one sequence and two structures[J]. Proceedings of the National Academy of Sciences, 2003, 100(24): 13875-13880.
[15] OURY T D, CRAPO J D, VALNICKOVA Z,etal. Human extracellular superoxide dismutase is a tetramer composed of two disulphide-linked dimers: a simplified, high-yield purification of extracellular superoxide dismutase[J]. Biochemical Journal, 1996, 317(Pt 1): 51-57.
[16] 杨志强, 张晨, 敖伟, 等. 毕赤酵母表达重组人源Cu/Zn SOD的分离纯化与稳定性表征[J]. 中国食品学报, 2011, 11(5): 108-113.
