菊苣酸对蛋白质氧化损伤的作用
2018-04-24肖海芳杨淑青王旭光宋元达
肖海芳,杨淑青,王旭光,王 静,宋元达,*
活性氧(reactive oxygen species,ROS)是生物体的正常代谢产物,主要存在于细胞线粒体中。适量ROS对于维持机体细胞正常的生理功能至关重要。当机体处于氧化应激和疾病状态时,体内ROS生成增多,过多的ROS攻击蛋白质、脂质和DNA等生物大分子,进而破坏细胞结构和功能,最终导致神经退行性疾病、炎症、癌症和动脉粥样硬化等疾病的发生[1-5]。
蛋白氧化已成为反映和衡量生命过程中氧化应激和氧化损伤的重要手段[6]。蛋白发生降解以及蛋白羰基的形成是蛋白氧化的主要特征[7-8]。研究发现许多疾病如阿尔茨海默症、糖尿病、心脑血管等均与蛋白羰基化水平升高有关[9-12]。蛋白质的侧链氨基酸(尤其是脯氨酸、精氨酸、赖氨酸和苏氨酸)被氧化后发生羰基化;自由基通过α-酰胺途径和谷酰基残基氧化途径诱导蛋白质肽链发生氧化断裂,生成蛋白羰基化衍生物;半胱氨酸、组氨酸和赖氨酸残基的亲核侧链与脂质过氧化产物醛类物质(如4-羟基壬烯醛、丙二醛和2-丙烯醛)及还原糖反应产物活性羰基衍生物的二级反应也会产生羰基化合物[13]。目前,蛋白质羰基化水平是应用最多、最广泛的蛋白氧化指标[14-15]。检测蛋白羰基水平的方法很多,其中较为灵敏的方法是采用二硝基苯肼(dinitrophenylhydrazine,DNPH)对羰基进行衍生,形成稳定的2,4-二硝基苯基腙,该物质能够吸收紫外光,因此可通过分光光度法进行检测[16]。另外,还可采用特异性Anti-DNP抗体,通过免疫印迹法(Western blot)检测蛋白羰基表达[17]。
食用植物中存在的天然抗氧化剂对于预防氧化应激相关疾病具有重要意义。菊苣酸作为天然多酚类化合物,已被证明能够清除自由基,具有较强的抗氧化能力[18]。然而目前仍未见从生物大分子角度探讨菊苣酸抗氧化作用的报道。因此,本研究采用Cu2+/H2O2和2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine)dihydrochloride,AAPH)两种不同的自由基诱导体系,分别产生羟自由基和烷氧自由基,诱导牛血清白蛋白(bovine serum albumin,BSA)、小鼠肝脏蛋白和脑蛋白3 种蛋白模型氧化损伤,探讨菊苣酸对蛋白质氧化损伤的影响。
1 材料与方法
1.1 动物、材料与试剂
健康SPF级雄性昆明小鼠20 只,体质量(20±2)g,购自第四军医大学实验动物中心,生产许可证号:SCXK(陕)2007-001。
考马斯亮蓝R250 西安沃尔森生物技术有限公司;放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)裂解液 碧云天生物技术研究所;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、硫酸链霉素 科邦生物有限公司;DNPH、三羟甲基氨基甲烷 美国Amresco公司;二抗 美国Santa Cruz公司;0.45 μm孔径聚偏二氟乙烯(polyvinylidene chloride film,PVDF)膜 美国Millipore公司;BCA蛋白定量试剂盒、化学发光检测试剂盒(electrical chemiluminescence immunoassay,ECL) 美国Thermo Fisher公司;甘氨酸 德国Merck公司;菊苣酸(纯度≥98%)、BSA、AAPH、Anti-DNP抗体 美国Sigma公司;其他化学试剂均为分析纯。
1.2 仪器与设备
DY89-Ⅱ型匀浆机 宁波新芝生物科技股份有限公司;5419R型高速离心机、移液枪 德国Eppendorf公司;PowerPac 220V电泳供电装置、165-8001型垂直电泳槽、221BR型Trans-Blot SD半干转印槽、ChemiDox XRS凝胶成像系统 美国Bio-Rad公司;-80 ℃低温冰箱 日本SANYO公司;PHS-3C型pH计 上海雷磁仪器厂;恒温水浴锅 北京科伟永兴仪器有限公司;BP211D型万分之一天平 德国Sartorius公司;VORTEX-5型漩涡混合器 江苏海门其林贝尔仪器制造有限公司;QYC110台式恒温振荡器 上海福玛实验设备有限公司;生化分析型超纯水机 成都优普净化科技有限公司。
1.3 方法
1.3.1 组织蛋白的提取
本实验中所有动物的处理,遵循山东理工大学实验室动物管理办法的规定。小鼠于20~22 ℃、相对湿度45%~50%条件下饲养,以基础饲料喂养,自由饮水,实验前将小鼠禁食过夜,次日颈椎脱臼处死,迅速取出肝脏组织和脑组织,置4 ℃生理盐水中反复漂洗,剔除脂肪及结缔组织,用滤纸吸干水分。称取0.1 g肝脏或脑组织,迅速剪碎,置于玻璃匀浆器中,加入1 mL RIPA细胞裂解液及10 μL PMSF溶液,冰水浴中匀浆,继续裂解10 min,然后于4 ℃、15 000 r/min离心10 min,取上清液,即为组织总蛋白。采用BCA蛋白定量试剂盒测定组织总蛋白浓度。
1.3.2 菊苣酸对Cu2+/H2O2诱导蛋白氧化损伤的影响
Cu2+与H2O2反应能够产生羟自由基,引起蛋白质氧化[6]。取0.6 mg/mL的BSA溶液(以100 mmol/L 磷酸盐缓冲液溶解)或组织蛋白(肝脏组织和脑组织)放入多支1.5 mL的离心管中,向实验组离心管中分别加入不同浓度的菊苣酸溶液,混合均匀。封口膜封口后置于37 ℃水浴中孵育,30 min后取出,分别向各离心管中加入一定浓度的H2O2和CuSO4溶液,使其终浓度分别为25 mmol/L和0.1 mmol/L;对照组不加H2O2和CuSO4溶液,以同体积的pH 7.4磷酸盐缓冲液代替。将各离心管于37 ℃水浴中继续孵育,90 min后分别检测各蛋白样品氧化损伤程度。
1.3.3 菊苣酸对AAPH诱导蛋白氧化损伤的影响
蛋白样品与菊苣酸的孵育方法同1.3.2节。将AAPH溶液置于37 ℃水浴2 min,使其热分解。实验组分别向各孵育后的样品中加入一定体积浓度为500 mmol/L的AAPH溶液,使其终浓度为50 mmol/L;对照组不加AAPH溶液,以同体积的pH 7.4磷酸盐缓冲液代替。将各样品于37 ℃水浴锅中继续孵育4 h,分别检测蛋白样品氧化损伤程度。
1.3.4 SDS-PAGE检测蛋白损伤程度
分别向1.3.2节和1.3.3节处理好的蛋白样品中加入十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,混匀,置于95 ℃水浴中反应10 min,使蛋白变性。取等量各变性后的蛋白样品,经10%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)90 min后,置于0.1%考马斯亮蓝R250染色液中染色30 min,脱色后采用ChemiDox凝胶成像系统对胶片成像,Quantity One软件对条带灰度进行半定量分析。
1.3.5 Western blot检测蛋白羰基化水平
分别取1.3.2节和1.3.3节处理好的蛋白样品进行SDS-PAGE电泳,方法同1.3.4节。电泳结束后,剥离凝胶,于电转槽中恒压10 V半干式转印至PVDF膜上。将转印后的PVDF膜放入2 mol/L的盐酸溶液中浸泡10 min,再将其放入20 mmol/L的DNPH盐酸溶液中衍生30 min。洗涤数次后将膜置于5%脱脂奶粉的TBST封闭液中室温封闭2 h。TBST洗膜数次后,将膜放入稀释的Anti-DNP一抗中孵育,4 ℃过夜。TBST洗涤后放入稀释的二抗中,室温轻摇孵育2h。上述PVDF膜经TBST洗涤后采用ECL发光液于ChemiDox凝胶成像系统成像,Quantity One软件对条带灰度进行半定量分析。
1.4 数据统计分析
实验数据以 ±s表示,采用SPSS 16.0统计软件进行Duncan’s多重比较分析,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 菊苣酸对BSA氧化损伤的影响
2.1.1 菊苣酸对Cu2+/H2O2诱导BSA氧化损伤的影响
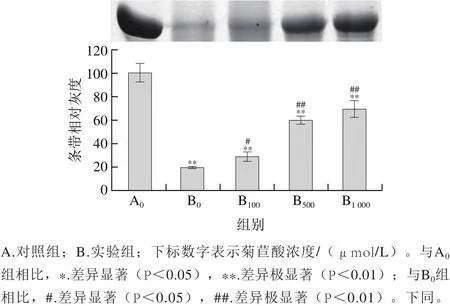
图1 菊苣酸对Cu2/诱导BSA氧化损伤的影响(SDS-PAGE检测)Fig. 1 Effect of chicoric acid on Cu2+/H2O2-induced oxidative damage to BSA (detected by SDS-PAGE)
与对照组相比,BSA经Cu2+/H2O2单独诱导后,图1中BSA条带明显变浅(P<0.01),图2中BSA羰基化水平明显升高(P<0.01),说明Cu2+/H2O2诱导体系产生的羟自由基使BSA发生明显的氧化降解和羰基化修饰。与Cu2+/H2O2单独处理组相比,菊苣酸预先孵育组的BSA条带灰度明显升高(P<0.01),羰基化水平明显下降(P<0.01),并且浓度越高,菊苣酸的作用效果越显著;其中,1 000 μmol/L菊苣酸几乎能够完全抑制Cu2+/H2O2诱导的BSA氧化损伤。以上结果说明,100~1 000 μmol/L菊苣酸对Cu2+/H2O2诱导的BSA氧化损伤具有保护作用。

图2 菊苣酸对Cu2+/H2O2诱导BSA羰基化的影响(Western blot检测)Fig. 2 Effect of chicoric acid on Cu2+/H2O2-induced carbonylation of BSA (detected by Western blot)
2.1.2 菊苣酸对AAPH诱导BSA氧化损伤的影响
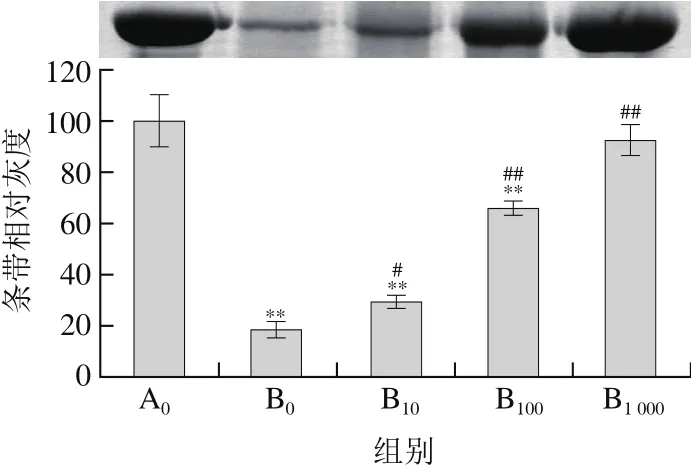
图3 菊苣酸对AAPH诱导BSA氧化损伤的影响(SDS-PAGE检测)Fig. 3 Effect of chicoric acid on AAPH-induced oxidative damage to BSA (detected by SDS-PAGE)
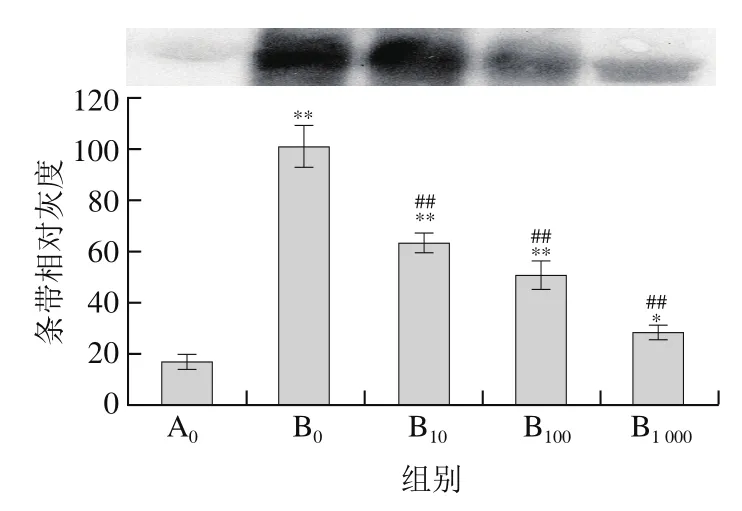
图4 菊苣酸对AAPH诱导BSA羰基化的影响(Western blot检测)Fig. 4 Effect of chicoric acid on AAPH-induced carbonylation of BSA(detected by Western blot)
在不同的诱导体系中抗氧化物的活性存在差异,为进一步探讨菊苣酸在其他诱导体系中对BSA氧化损伤的影响,本实验采用热分解的含氮化合物AAPH诱导BSA发生氧化损伤。由图3可见,经50 mmol/L AAPH单独诱导后,大部分BSA被氧化降解;由图4可见,与对照组相比,BSA羰基化水平也明显升高(P<0.01),说明AAPH能够诱导BSA氧化损伤。采用10~1 000 μmol/L菊苣酸预处理后:由图3可见,BSA蛋白条带灰度与AAPH单独处理组相比明显加深(P<0.01);由图4可见,羰基化水平明显下降(P<0.01);另外,随着浓度的增加,其菊苣酸对BSA的作用效果越明显。上述结果说明菊苣酸对AAPH诱导的BSA氧化损伤也具有明显的保护作用。
2.2 菊苣酸对小鼠组织蛋白氧化损伤的影响
动物肝脏和脑组织中蛋白含量较高,本实验选用小鼠肝脏蛋白和脑蛋白作为蛋白模型,以羰基化水平为检测指标,进一步探讨菊苣酸对组织蛋白氧化损伤的影响。
2.2.1 菊苣酸对小鼠肝脏蛋白氧化损伤的影响
2.2.1.1 菊苣酸对Cu2+/H2O2诱导小鼠肝脏蛋白氧化损伤的影响
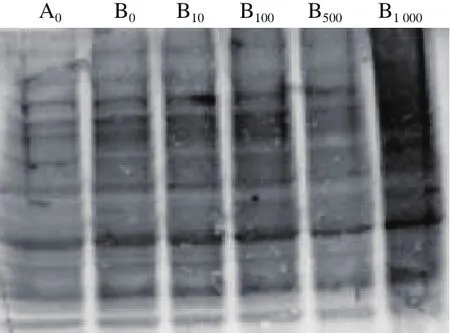
图5 菊苣酸对Cu2/诱导小鼠肝脏蛋白羰基化的影响Fig. 5 Effect of chicoric acid on Cu2+/H2O2-induced protein carbonylation in mouse liver
蛋白羰基化条带灰度越高,说明其氧化损伤程度越高。由图5可以看出,Cu2+/H2O2单独作用能引起肝脏蛋白羰基化水平的明显升高。与Cu2+/H2O2单独组相比,经10~100 μmol/L菊苣酸预先孵育后,Cu2+/H2O2诱导体系中的小鼠肝脏蛋白羰基化水平无明显变化,但500 μmol/L菊苣酸能明显降低小鼠肝脏蛋白的羰基化水平;当菊苣酸浓度增加为1 000 μmol/L时,小鼠肝脏蛋白的羰基化水平与其他各处理组相比均明显升高。上述结果表明,菊苣酸在一定浓度范围内能够对Cu2+/H2O2诱导小鼠肝脏蛋白氧化损伤具有保护作用,但高浓度菊苣酸表现出促氧化作用。
2.2.1.2 菊苣酸对AAPH诱导小鼠肝脏蛋白氧化损伤的影响
由图6可以看出,AAPH单独处理后,小鼠肝脏蛋白的羰基化水平明显升高。10 μmol/L菊苣酸对AAPH诱导的小鼠肝脏蛋白羰基化修饰无明显抑制作用,而菊苣酸在100~1 000 μmol/L浓度范围内能够有效抑制AAPH诱导小鼠肝脏蛋白羰基的产生,对小鼠肝脏蛋白氧化损伤具有明显的保护作用,且菊苣酸浓度越高对AAPH诱导体系中小鼠肝脏蛋白的保护效果越好。
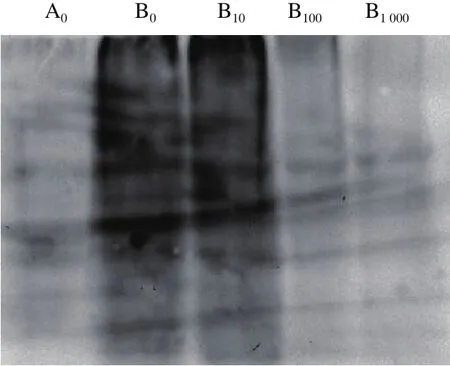
图6 菊苣酸对AAPH诱导小鼠肝脏蛋白羰基化的影响Fig. 6 Effect of chicoric acid on AAPH-induced protein carbonylation in mouse liver
2.2.2 菊苣酸对小鼠脑蛋白氧化损伤的影响
2.2.2.1 菊苣酸对Cu2+/H2O2诱导小鼠脑蛋白氧化损伤的影响

图7 菊苣酸对Cu2+/小鼠脑蛋白羰基化的影响Fig. 7 Effect of chicoric acid on Cu2+/H2O2-induced protein carbonylation in mouse brain
由图7可以看出,与空白组相比,经Cu2+/H2O2诱导体系单独处理的小鼠脑蛋白羰基化水平明显升高。经10、100 μmol/L菊苣酸预先孵育后,小鼠脑蛋白羰基化程度明显下降,说明该浓度范围内菊苣酸对Cu2+/H2O2诱导体系中的小鼠脑蛋白具有保护作用。当菊苣酸浓度分别增加至500、1 000 μmol/L时,小鼠脑蛋白羰基化水平反而明显升高,甚至超过Cu2+/H2O2单独处理组。这一结果说明,在Cu2+/H2O2诱导体系中浓度过高的菊苣酸对小鼠脑蛋白表现出促氧化作用。
2.2.2.2 菊苣酸对AAPH诱导小鼠脑蛋白氧化损伤的影响
由图8可见,经终浓度为50 mmol/L的AAPH诱导后,小鼠脑蛋白羰基化程度明显升高。浓度为10 μmol/L的菊苣酸对AAPH诱导的小鼠脑蛋白羰基化无明显抑制作用,但经浓度分别为100、1 000 μmol/L的菊苣酸预先孵育后,小鼠脑蛋白的羰基化程度明显下降。上述结果说明,在AAPH诱导体系中浓度为100~1 000 μmol/L菊苣酸表现出抗氧化作用,对小鼠脑蛋白具有明显的保护作用。

图8 菊苣酸对AAPH诱导小鼠脑蛋白羰基化水平的影响Fig. 8 Effect of chicoric acid on AAPH-induced protein carbonylation in mouse brain
3 讨 论
Cu2+与H2O2反应生成羟自由基,AAPH热分解产生烷过氧自由基,两种反应体系均能诱导生物大分子蛋白质发生氧化损伤。大量研究显示,天然抗氧化剂能够抑制自由基对蛋白的氧化损伤[6,19-21]。本实验利用上述两种典型的氧化诱导体系,在预实验的基础上,分别以BSA、小鼠肝脏蛋白和脑蛋白为蛋白模型,研究菊苣酸对蛋白质氧化损伤的影响。
本研究结果表明,无论是通过SDS-PAGE观察蛋白降解情况,还是Western blot检测蛋白羰基化水平,菊苣酸在100~1 000 μmol/L浓度范围内能够抑制Cu2+与H2O2诱导体系对BSA的氧化损伤;低浓度菊苣酸对羟自由基引起的小鼠肝脏蛋白和脑蛋白氧化损伤具有保护作用,但在高浓度时菊苣酸表现出促氧化作用。与Cu2+/H2O2反应体系不同,在AAPH诱导体系中,高浓度菊苣酸对BSA、小鼠肝脏蛋白和小鼠脑蛋白均表现出较强的保护作用。菊苣酸之所以在两种反应体系中表现出不同的作用效果,可能是由两种体系中自由基的性质及在生物大分子上的作用位点不同引起[22]。
据文献[23-24]报道,VC和VE分别与Cu2+共同作用,均能引起蛋白和DNA的氧化损伤;类黄酮类物质能够与过渡金属反应,加速羟自由基的生成[25-26];高剂量注射VC后,豚鼠血清脂质过氧化水平升高[27]。上述研究结果均表明,许多抗氧化剂在某些情况下能够表现出促氧化效应。在Cu2+与H2O2诱导体系中,高浓度菊苣酸对小鼠组织蛋白表现出促氧化作用,可能与Cu2+与H2O2反应体系本身有关。Cu2+与H2O2反应产生羟自由基的原理为[28]:Cu2++H2O2→Cu++HO2·+H+,H2O2+Cu+→OH·+OH-+Cu2+。由反应式能够看出,Cu2+向Cu+的转变是生成羟自由基的限速步骤,高浓度菊苣酸加入后可能促进了Cu2+向Cu+的转变,进而加速羟自由基的产生,促进蛋白质氧化,这一推测有待于进一步研究证实。前期研究也曾发现,菊苣酸能够诱导3T3-L1前脂肪细胞内ROS的产生[29]。另外,在Cu2+/H2O2诱导体系中,高浓度菊苣酸对BSA和小鼠组织蛋白表现出不同的作用效果,这一差异可能与小鼠组织蛋白的成分较为复杂有关。菊苣酸促氧化的作用机制还需要进一步深入探讨。
参考文献:
[1] FANG C, BOURDETTE D, BANKER G. Oxidative stress inhibits axonal transport: implications for neurodegenerative diseases[J]. Molecular Neurodegeneration, 2012, 7(1): 29. DOI:10.1186/1750-1326-7-29.
[2] VALAVANIDIS A, VLACHOGIANNI T, FIOTAKIS K, et al.Pulmonary oxidative stress, inflammation and cancer: respirable particulate matter, fibrous dusts and ozone as major causes of lung carcinogenesis through reactive oxygen species mechanisms[J].International Journal of Environmental Research and Public Health,2013, 10(9): 3886-3907. DOI:10.3390/ijerph10093886.
[3] CONROY S K, MCDONALD B C, SMITH D J, et al. Alterations in brain structure and function in breast cancer survivors: effect of postchemotherapy interval and relation to oxidative DNA damage[J].Breast Cancer Research and Treatment, 2013, 137(2): 493-502.DOI:10.1007/s10549-012-2385-x.
[4] SULTANA R, BUTTERFIELD D A. Oxidative modification of brain proteins in Alzheimer's disease: perspective on future studies based on results of redox proteomics studies[J]. Journal of Alzheimer's Disease,2013, 33: 243-251. DOI:10.3233/JAD-2012-129018.
[5] VENDROV A E, VENDROV K C, SMITH A, et al. NOX4 NADPH oxidase-dependent mitochondrial oxidative stress in aging-associated cardiovascular disease[J]. Antioxidants & Redox Signaling, 2015,23(18): 1389-1409. DOI:10.1089/ars.2014.6221.
[6] 李爱春. 富氢水对骨骼肌运动性氧化应激损伤与选择性抗氧化作用机制研究[D]. 苏州: 苏州大学, 2012: 6-8.
[7] YUZEFOVYCH L V, MUSIYENKO S I, WILSON G L, et al.Mitochondrial DNA damage and dysfunction, and oxidative stress are associated with endoplasmic reticulum stress, protein degradation and apoptosis in high fat diet-induced insulin resistance mice[J]. PLoS ONE, 2013, 8(1): e54059. DOI:10.1371/journal.pone.0054059.g007.
[8] ARYAL B P, JEONG J, RAO V A. Carbonylation and degradation of cardiac myosin binding protein C serves as an indicator of doxorubicin-induced cardiotoxicity[J]. Cancer Research, 2015, 75:1825-1825. DOI:10.1158/1538-7445.
[9] SHEN L, CHEN Y, YANG A, et al. Redox proteomic profiling of specifically carbonylated proteins in the serum of triple transgenic Alzheimer’s disease mice[J]. International Journal of Molecular Sciences, 2016, 17(4): 469. DOI:10.3390/ijms17040469.
[10] HSU C, YANG H, HO J, et al. Houttuynia cordata aqueous extract attenuated glycative and oxidative stress in heart and kidney of diabetic mice[J]. European Journal of Nutrition, 2016, 55(2): 845-854.DOI:10.1007/s00394-015-0994-y.
[11] ASADI H, ABOLFATHI A A, BADALZADEH R, et al. Effects of ramadan fasting on serum amyloid A and protein carbonyl group levels in patients with cardiovascular diseases[J]. Journal of Cardiovascular and Thoracic Research, 2015, 7(2): 55-59. DOI:10.15171/jcvtr.2015.12.
[12] MADISETTY M K, KUMARASWAMI K, KATKAM S, et al.Assessment of oxidative stress markers and carotid artery intimamedia thickness in elderly patients without and with coronary artery disease[J]. Indian Journal of Clinical Biochemistry, 2016, 31(3):278-285. DOI:10.1007/s12291-015-0530-0.
[13] DALLE-DONNE I, ROSSI R, GIUSTARINI D, et al. Protein carbonyl groups as biomarkers of oxidative stress[J]. Clinica Chimica Acta,2003, 329(1/2): 23-38. DOI:10.1016/S0009-8981(03)00003-2.
[14] FERNANDO N, WICKREMESINGHE S, NILOOFA R, et al. Protein carbonyl as a biomarker of oxidative stress in severe leptospirosis,and its usefulness in differentiating leptospirosis from dengue infections[J]. PLoS ONE, 2016, 11(6): e0156085. DOI:10.1371/journal. pone.0156085.
[15] BROCARDO P S, MCGINNIS E, CHRISTIE B R, et al. Timecourse analysis of protein and lipid oxidation in the brains of Yac128 Huntington's disease transgenic mice[J]. Rejuvenation Research, 2016,19(2): 140-148. DOI:10.1089/rej.2015.1736.
[16] PILLON N J, CROZE M L, VELLA R E, et al. The lipid peroxidation by-product 4-hydroxy-2-nonenal (4-HNE) induces insulin resistance in skeletal muscle through both carbonyl and oxidative stress[J].Endocrinology, 2012, 153(5): 2099-2111. DOI:10.1210/en.2011-1957.
[17] VÁSQUEZ-GARZÓN V R, ROUIMI P, JOUANIN I, et al. Evaluation of three simple direct or indirect carbonyl detection methods for characterization of oxidative modifications of proteins[J]. Toxicology Mechanisms and Methods, 2012, 22(4): 296-304. DOI:10.3109/15376 516.2012.657258.
[18] SCHLERNITZAUER A, OIRY C, HAMAD R, et al. Chicoric acid is an antioxidant molecule that stimulates AMP kinase pathway in L6 myotubes and extends lifespan in Caenorhabditis elegans[J]. PLoS ONE, 2013, 8(11): e78788. DOI:10.1371/journal.pone.0078788.
[19] 相启森, 孟旭, 乔燕, 等. 鼠尾草酸对自由基诱导蛋白质氧化损伤的保护作用[J]. 食品科学, 2013, 34(15): 281-284. DOI:10.7506/spkx1002-6630-201315058.
[20] 孟旭, 刘学波. 茶多酚协同荷叶碱的抗氧化活性及其对结肠癌细胞的抑制作用[J]. 食品科学, 2014, 35(19): 119-124. DOI:10.7506/spkx1002-6630-201419025.
[21] 姚雯, 杨天衡, 刘学波. 血根碱清除自由基及抑制生物大分子氧化的作用[J]. 食品科学, 2014, 35(9): 137-141. DOI:10.7506/spkx1002-6630-201409028.
[22] MAYO J C, TAN D X, SAINZ R M, et al. Protection against oxidative protein damage induced by metal-catalyzed reaction or alkylperoxyl radicals: comparative effects of melatonin and other antioxidants[J].Biochimica et Biophysica Acta, 2003, 1620(1): 139-150. DOI:10.1016/S0304-4165(02)00527-5.
[23] GAETKE L M, CHOW C K. Copper toxicity, oxidative stress,and antioxidant nutrients[J]. Toxicology, 2003, 189(1): 147-163.DOI:10.1016/S0300-483X(03)00159-8.
[24] KATO Y, KITAMOTO N, KAWAI Y, et al. The hydrogen peroxide/copper ion system, but not other metal-catalyzed oxidation systems,produces protein-bound dityrosine[J]. Free Radical Biology and Medicine, 2001, 31(5): 624-632. DOI:10.1016/S0891-5849(01)00623-2.
[25] CAO G, SOFIC E, PRIOR R L. Antioxidant and prooxidant behavior of flavonoids: structure-activity relationships[J]. Free Radical Biology and Medicine, 1997, 22(5): 749-760. DOI:10.1016/S0891-5849(96)00351-6.
[26] PROCHÁZKOVÁ D, BOUŠOVÁ I, WILHELMOVÁ N. Antioxidant and prooxidant properties of flavonoids[J]. Fitoterapia, 2011, 82(4):513-523. DOI:10.1016/j.fitote.2011.01.018.
[27] KAPSOKEFALOU M, MILLER D D. Iron loading and large doses of intravenous ascorbic acid promote lipid peroxidation in whole serum in guinea pigs[J]. British Journal of Nutrition, 2001, 85(6): 681-687.DOI:10.1079/BJN2001319.
[28] SIMPSON J A, CHEESEMAN K H, SMITH S E, et al. Free-radical generation by copper ions and hydrogen peroxide. stimulation by Hepes buffer[J]. Biochemical Journal, 1988, 254(2): 519-523.DOI:10.1042/bj2540519.
[29] XIAO H, WANG J, YUAN L, et al. Chicoric acid induces apoptosis in 3T3-L1 preadipocytes through ROS-mediated PI3K/Akt and MAPK signaling pathways[J]. Journal of Agricultural and Food Chemistry,2013, 61(7): 1509-1520. DOI:10.1021/jf3050268.
