天冬氨酸降解人参二醇组皂苷及其美拉德反应产物的抗氧化活性
2018-04-24孙光芝阮长春
刘 志,夏 娟,李 伟,张 晶,孙光芝,阮长春,*
人参(Panax ginseng C. A. Meyer)是我国名贵的中草药,被誉为“百草之王”,在我国用于保健和治疗疾病已有几千年的历史。为了提高人参产品的开发与利用价值,2012年人参被中国卫生部批准为新资源食品,人参的应用将由单一的中药材拓展到食品、饮料及保健产品等领域。人参皂苷是人参的主要活性成分,主要包括人参二醇型皂苷(人参皂苷-Rb1、-Rb2、-Rc和-Rd)和人参三醇型皂苷(人参皂苷-Re和-Rg1)。近年来的研究表明,人参经过高温加工后,由于人参皂苷化学结构的变化导致人参加工品生物活性明显增强[1-3]。在人参高温加工过程中,人参皂苷被转化成低极性的稀有人参皂苷(人参皂苷-Rh1、-Rg3、-F4、-Rg6、-Rh2、-Rk1和-Rg5等)[4-6],这些稀有皂苷显示出了更好的抗癌、抗糖尿病、抗氧化和提高免疫力等药理活性[7-10]。然而人参稀有皂苷在人参加工品中含量较低,且分离纯化较困难;因此目前多采用强酸强碱的水解方法来制备人参稀有皂苷[11-12];强酸强碱水解法虽然经济、快速和简便,但存在专一性差、得率低、副产物较多、腐蚀性强、污染环境等缺点;因此寻找一种高效、绿色环保的催化制备人参稀有皂苷的方法是十分必要的。
美拉德反应是指氨基化合物(氨基酸、胺、肽和蛋白质)和羰基化合物(糖类)在食品和中草药加工及贮藏过程中发生的非酶促褐变反应,其过程复杂,受氨基酸及糖种类影响,并且与反应物浓度、pH值、反应温度和时间等因素有关[13-16];美拉德反应产物种类繁多,不仅对食品的色泽、风味有重要贡献[17],还有抑菌、抗氧化和抗肿瘤等生物活性[18-20]。最近,一些文献报道了在高温条件下使用酸性较弱的柠檬酸和酒石酸作为催化剂,可以实现高效地水解人参皂苷制备人参稀有皂苷[21-22]。由于这些有机酸常被用作食品添加剂,可以使食物具有酸味,且可食用,因此认为这些方法是绿色环保的。天冬氨酸是一种酸性氨基酸,分子内含有两个羧基,呈弱酸性。天冬氨酸是生物体所必须的营养成分,可被吸收降解,无毒副作用。然而利用天冬氨酸作为催化剂制备人参稀有皂苷及其美拉德反应产物的抗氧化活性研究目前鲜见报道。本实验以天冬氨酸为催化剂,人参二醇组皂苷为原料,低成本、环境友好地制备高附加值的稀有人参皂苷20S-Rg3、20R-Rg3、Rk1和Rg5,并通过核磁共振(nuclear magnetic resonance,NMR)(1H-NMR和13C-NMR)进行了结构鉴定。同时研究了其水解反应条件、美拉德反应褐变程度及体外抗氧化活性。本研究为进一步开发绿色环保的工业化制备人参稀有皂苷提供了理论参考和新方法。
1 材料与方法
1.1 材料与试剂
人参二醇型皂苷、人参皂苷20S-Rg3、20R-Rg3、Rk1和Rg5为农业现代化综合技术研究所自制(经质谱(mass spectrum,MS)和NMR鉴定,质量分数>99%)。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海化成工业发展有限公司;D101型大孔吸附树脂 青岛海洋化工有限公司;天冬氨酸、葡萄糖、甲醇、乙醇(均为分析纯)、乙腈(色谱纯) 北京伊诺凯科技有限公司;水为三重蒸馏水。
1.2 仪器与设备
LC-20AT型高效液相色谱(high performance liquid chromatography,HPLC)仪(配有SPD-20A/20AV紫外检测器,LC solution色谱工作站,AT330柱温箱) 岛津国际贸易上海有限公司;AVANCEⅡ NMR仪 瑞士布鲁克公司;紫外-可见分光光度计 北京普析通用仪器有限责任公司;立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 样品的制备
精密称取200 mg人参二醇组皂苷粉末或葡萄糖置于试管中,准确加入质量分数为0.1%、1.0%或5.0%天冬氨酸水溶液4 mL,密封混匀,分别在80、100 ℃和120 ℃条件下蒸制1、2 h和4 h,然后将样品取出,冷冻干燥制成粉状备用。
1.3.2 人参皂苷降解产物的分离鉴定
将天冬氨酸水解人参二醇组皂苷样品干燥粉末400 mg用体积分数80%乙醇溶液溶解,上D101型大孔吸附型树脂柱,进行梯度洗脱,先用蒸馏水洗脱,除去水溶性杂质等,然后分别用体积分数30%、60%和80%乙醇溶液进行梯度洗脱,合并体积分数60%和80%乙醇溶液洗脱液,于40 ℃下减压浓缩,最后用体积分数50%甲醇溶液溶解浓缩液,0.45 μm滤膜滤过,用于HPLC的制备。
半制备型HPLC条件:COSMOSIL 5C18-MS-Ⅱ色谱柱(250 mm×10 mm,5 μm),流动相为乙腈-水(46∶54,V/V),检测波长为203 nm,柱温为25 ℃,流速3.0 mL/min,进样体积为1 mL。
将半制备型HPLC分离纯化的人参皂苷降解产物通过MS、H-NMR(400 MHz)和C-NMR(100 MHz)等进行结构鉴定,以确定其分子结构。
1.3.3 人参皂苷的质量浓度测定
1.3.3.1 供试品溶液的制备
精密称取样品干燥粉末20 mg,用体积分数80%甲醇定容于10 mL容量瓶中;摇匀,过0.45 μm滤膜,用于HPLC定量分析。
1.3.3.2 对照品溶液的制备
分别精密称取人参皂苷20S-Rg3、20R-Rg3、Rk1和Rg5对照品各10 mg,加入体积分数80%甲醇溶液将上述4种人参皂苷配制成质量浓度分别为1.01、1.00、0.97、1.04 mg/mL的混合对照品溶液,摇匀,经0.45 μm滤膜滤过,备用。
1.3.3.3 分析型HPLC条件
色谱柱为COSMOSIL 5C18-MS-Ⅱ(250 mm×4.6 mm,5 μm),检测波长为203 nm,柱温 25℃,流动相为水(A)-乙腈(B);梯度洗脱:0~5 min,22%~30% B;5~25 min,30%~46% B;25~35 min,46%~64% B;35~44 min,64% B;44~50 min,64%~100% B。流速1.0 mL/min,进样体积为20 μL。
1.3.4 美拉德反应褐变程度的测定
作为美拉德反应特征之一的类黑精是使整个反应体系褐变的主要物质,其在420 nm波长处具有最大吸收波长。因此美拉德反应程度可以用产物在420 nm波长处的吸光度来表示,即褐变指数,褐变指数值越大表示美拉德反应程度越深[23]。参照Baisier等[24]的方法,称取适量样品干燥粉末,用体积分数80%乙醇溶液溶解,配制成质量浓度为10 mg/mL的样品溶液,用紫外-可见分光光度计测定不同处理样品在420 nm波长处的吸光度,每个样品平行测定3 次。
1.3.5 DPPH自由基清除能力的测定
称取适量样品干燥粉末,用体积分数80%乙醇溶液溶解,分别配制成质量浓度为0.5、1.0、2.0、4.0 mg/mL的样品溶液,用于抗氧化活性测定。
DPPH自由基清除能力的测定参照王海敏等[25]的方法,精密称取0.012 5 g DPPH,加无水乙醇定容至50 mL容量瓶中,摇匀,得DPPH储备液,4 ℃避光保存。然后精密吸取10 mL DPPH储备液,定容于100 mL容量瓶中,备用。将混合溶液A(2 mL体积分数80%的乙醇溶液+2 mL DPPH储备液)、B(2 mL样品溶液+2 mL DPPH自由基储备液)、C(2 mL样品溶液+2 mL无水乙醇)在室温下避光静置30 min后,快速测定517 nm波长处吸光度。样品对DPPH自由基的清除率可由下式计算。

式中:A1表示DPPH自由基与溶剂混合液的吸光度;A2表示样品与DPPH自由基混合后的吸光度;A3表示样品与溶剂混合后的吸光度。
1.4 数据统计分析
采用SPSS 20.0软件进行统计处理,应用t检验进行差异显著性分析,P<0.05表示有统计学意义。
2 结果与分析
2.1 人参二醇组皂苷降解产物的分离纯化

图1 人参二醇组皂苷(A)及其水解产物(B)的HPLC图Fig. 1 High performance liquid chromatographic profiles of PDG (A)and degradation products (B)
将400 mg人参二醇组皂苷的水解样品进行D101型大孔树脂柱色谱,梯度洗脱后,收集合并乙醇洗脱相,进一步采用半制备型液相色谱进行分离,得到化合物1(16.2 mg)、化合物2(42.7 mg)、化合物3(18.4 mg)和化合物4(50.2 mg)(图1),制备的人参皂苷降解产物经面积归一化法计算,纯度均达99%以上。
2.2 人参二醇组皂苷降解产物的结构鉴定
化合物1:白色粉末,ESI-MS m/z:783.6[M-H]-。1H-NMR(400 MHz,C5D5N) δ:5.25(1H,d,J=7.6 Hz,glu-H-1”)、5.19(1H,t,J=6.5 Hz,H-24)、4.85(1H,d,J=7.5 Hz,glu-H-1’)、3.80(1H,m,H-12α)、3.16(1H,dd,J=11.7,3.3 Hz,H-3α)、1.57(3H,s,H-28)、1.53(3H,s,H-21)、1.30(3H,s,H-26)、1.17(3H,s,H-27)、0.98(3H,s,H-18)、0.84(3H,s,H-29)、0.83(3H,s,H-19)、0.68(3H,s,H-30)。在化合物1的13C-NMR谱中共给出42 个碳信号,δ 126.4和δ 130.9为C-24和C-25的双键碳信号峰,δ 105.2和δ 106.2为两个糖端基碳信号峰。将化合物1的1H-NMR和13C-NMR数据与人参皂苷20S-Rg3文献数据[26]对照,二者基本一致;因此,化合物1的结构鉴定为20S-人参皂苷Rg3。
化合物2:白色粉末,ESI-MS m/z:783.6[M-H]-。1H-NMR(400 MHz,C5D5N) δ:5.26(1H,d,J=7.6 Hz,glu-H-1”)、5.21(1H,t,J=7.2 Hz,H-24)、4.82(1H,d,J=7.6 Hz,glu-H-1’)、3.81(1H,m,H-12α)、3.16(1H,dd,J=11.8,4.3 Hz,H-3α)、1.58(3H,s,H-28)、1.54(3H,s,H-21)、1.28(3H,s,H-26)、1.18(3H,s,H-27)、1.00(3H,s,H-18)、0.90(3H,s,H-29)、0.87(3H,s,H-19)、0.71(3H,s,H-30)。化合物2的13C-NMR数据与化合物1相比较,苷元的C-13和C-22信号分别向低场位移δ 0.7和δ 7.4,C-17和C-21信号分别向高场位移δ 4.1和δ 5.3,其他数据基本一致,提示两者为20R/20S异构体。将化合物2的1H-NMR和13C-NMR数据与人参皂苷20RRg3文献[26]数据对照,二者基本一致;因此,化合物2的结构鉴定为人参皂苷20R-Rg3。
化合物3:白色粉末,ESI-MS m/z:765.5[M-H]-。1H-NMR(400 MHz,C5D5N) δ:5.24(1H,d,J=8.3 Hz,glu-H-1”)、5.17(1H,t,J=6.9 Hz,H-24)、5.03(1H,brs,H-21a)、4.79(1H,brs,H-21b)、4.75(1H,d,J=7.5 Hz,glu-H-1’)、3.80(1H,m,H-12α)、3.16(1H,dd,J=11.5,3.6 Hz,H-3α)、1.54(3H,s,H-28)、1.29(3H,s,H-26)、1.18(3H,s,H-27)、0.99(3H,s,H-18)、0.90(3H,s,H-29)、0.84(3H,s,H-19)、0.70(3H,s,H-30)。在化合物3的13C-NMR谱中共给出42 个碳信号,δ 155.7、108.3、125.5和δ 131.3分别为C-20、C-21、C-24和C-25的双键碳信号峰,δ 105.2和δ 106.2为两个糖端基碳信号峰。将化合物3的1H-NMR和13C-NMR数据与人参皂苷Rk1文献[27]数据对照,二者基本一致;因此,化合物3的结构鉴定为人参皂苷Rk1。
化合物4:白色粉末,ESI-MS m/z:765.5[M-H]-。1H-NMR(400 MHz,C5D5N) δ:5.38(1H,t,J=6.8 Hz,H-22)、5.24(1H,d,J=7.6 Hz,glu-H-1”)、5.10(1H,t,J=6.7 Hz,H-24)、4.86(1H,d,J=7.5 Hz,glu-H-1’)、3.80(1H,m,H-12α)、3.15(1H,dd,J=11.8,4.2 Hz,H-3α)、1.70(3H,s,H-21)、1.50(3H,s,H-28)、1.27(3H,s,H-26)、1.17(3H,s,H-27)、0.99(3H,s,H-18)、0.90(3H,s,H-29)、0.84(3H,s,H-19)、0.69(3H,s,H-30)。在化合物4的13C-NMR谱中共给出42 个碳信号,δ 140.3、123.6、123.9和δ 131.4分别为C-20、C-22、C-24和C-25的双键碳信号峰,δ 105.2和δ 106.2为两个糖端基碳信号峰。将化合物4的1H-NMR和13C-NMR数据与人参皂苷Rg5文献[27]数据对照,二者基本一致;因此,化合物4的结构鉴定为人参皂苷Rg5。
2.3 天冬氨酸催化人参二醇组皂苷的转化途径
人参二醇组皂苷的转化途径如图2所示,在高温高压蒸煮条件下,首先,人参二醇组皂苷被转化成20S-Rg3和20R-Rg3,再进一步脱水生成人参皂苷Rk1和Rg5;人参二醇组皂苷的降解途径为人参二醇组皂苷→20S-Rg3/20R-Rg3→Rk1/Rg5。由于天冬氨酸属于弱酸,反应较温和,因而无其他副产物生成,稀有皂苷得率较高。这些结果与已报道的酒石酸和柠檬酸在高温下降解人参皂苷的转化途径是一致的[21-22];然而强酸强碱水解人参皂苷时,由于反应较剧烈,导致专一性差、副产物较多、得率较低[11-12]。马丽媛等[28]使用5%硫酸水解人参茎叶总皂苷,从水解产物中共分离鉴定了34个人参皂苷类降解产物。张春红等[29]研究了温度和酸的种类对人参二醇得率的影响,结果表明人参二醇的最佳制备方法为100 ℃和10%硫酸水解,最终得率为13.7%。
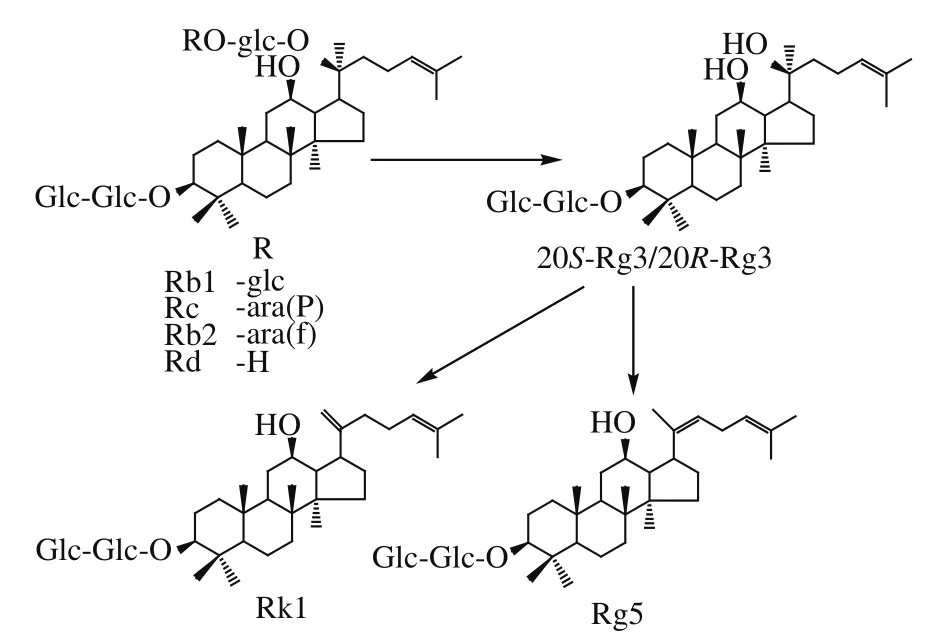
图2 天冬氨酸水解人参二醇组皂苷的转化途径Fig. 2 Transformation pathways of protopanaxadiol-type ginsenosides in the presence of aspartic acid
2.4 不同样品在高温蒸煮条件下美拉德反应褐变程度的变化
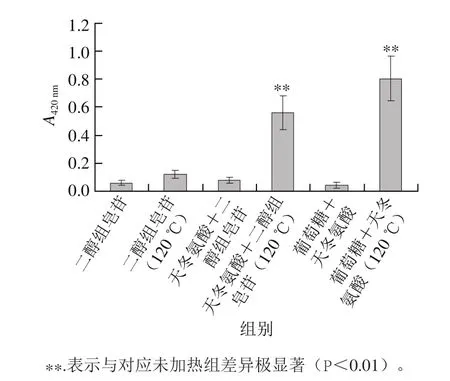
图3 不同样品在高温蒸煮条件下美拉德反应褐变程度的变化Fig. 3 Changes in browning degree of different samples under heating conditions
美拉德反应是羰基化合物和氨基化合物经过复杂的历程最终生成棕色甚至黑色的大分子物质类黑精的褐变反应;其反应物中羰基化合物主要为还原糖,氨基化合物包括氨基酸、蛋白质、胺和肽[13]。在高温蒸煮条件下,不同样品美拉德反应褐变程度的变化如图3所示,未加热的样品全都没有发生褐变,人参二醇组皂苷120 ℃加热样品和未加热样品在褐变程度上无明显差异;而天冬氨酸与人参二醇组皂苷120 ℃加热样品和天冬氨酸与葡萄糖120 ℃加热样品褐变程度显著增加(P<0.01),这说明天冬氨酸降解人参二醇组皂苷的同时,还能与皂苷水解产生的糖发生美拉德反应,产生了褐变。
2.5 水解温度对二醇组皂苷的降解及美拉德反应褐变程度的影响
模拟红参加工的方法,将人参二醇组皂苷(200 mg)溶于4 mL质量分数为5%天冬氨酸的水溶液,分别在80、100 ℃和120 ℃条件下蒸制2 h,研究不同温度对人参二醇组皂苷的降解和美拉德反应褐变程度的影响。

图4 温度对二醇组皂苷的降解及美拉德反应的影响Fig. 4 Effect of heating temperature on the transformation of PDG and Maillard reaction
由图4A可知,人参二醇组皂苷在3 个不同温度条件下均被完全转化成20S-Rg3、20R-Rg3、Rk1和Rg5,且人参皂苷20R-Rg3和Rg5的质量浓度随着温度的升高而升高,20S-Rg3和Rk1的质量浓度随着温度的升高而降低。人参皂苷20R-Rg3和20S-Rg3为同分异构体,在高温条件下,人参皂苷20R-Rg3的产率高于20S-Rg3,可能是人参二醇组皂苷在水解过程中生成人参皂苷Rg3的反应主要按照SN1反应机制进行[21]。当温度升高时,亲核试剂的亲核性增强,当亲核试剂H2O进攻中心碳原子时,离去基ROH尚未远离中心碳原子,导致生成构型翻转的20R-Rg3(从离去基背面进攻)的几率远高于生成构型保持的20S-Rg3(正面进攻)的几率。而同分异构体人参皂苷Rg5和Rk1的水解产率不同,主要是因为人参皂苷Rg5的脱水方式符合扎伊切夫规则,同时其构型为E-构型,属于优势构象,故人参皂苷Rg5的产率高于Rk1[22]。图4B展示了温度对褐变程度的影响,结果表明褐变程度随着温度的升高逐渐递增,80 ℃加热2 h样品的褐变程度与未加热样品不存在显著性差异,120 ℃加热2 h后的样品褐变程度变化显著(P<0.01),说明温度对褐变程度的影响较大。因此,120 ℃为二醇组皂苷水解和美拉德褐变反应的最优条件。
2.6 天冬氨酸质量分数对二醇组皂苷的降解及美拉德反应褐变程度的影响
将人参二醇组皂苷200 mg溶于4 mL质量分数分别为0.1%、1.0%和5.0%的天冬氨酸水溶液,在120 ℃条件下蒸制2 h,研究不同天冬氨酸浓度对人参二醇组皂苷的降解和美拉德反应褐变程度的影响。
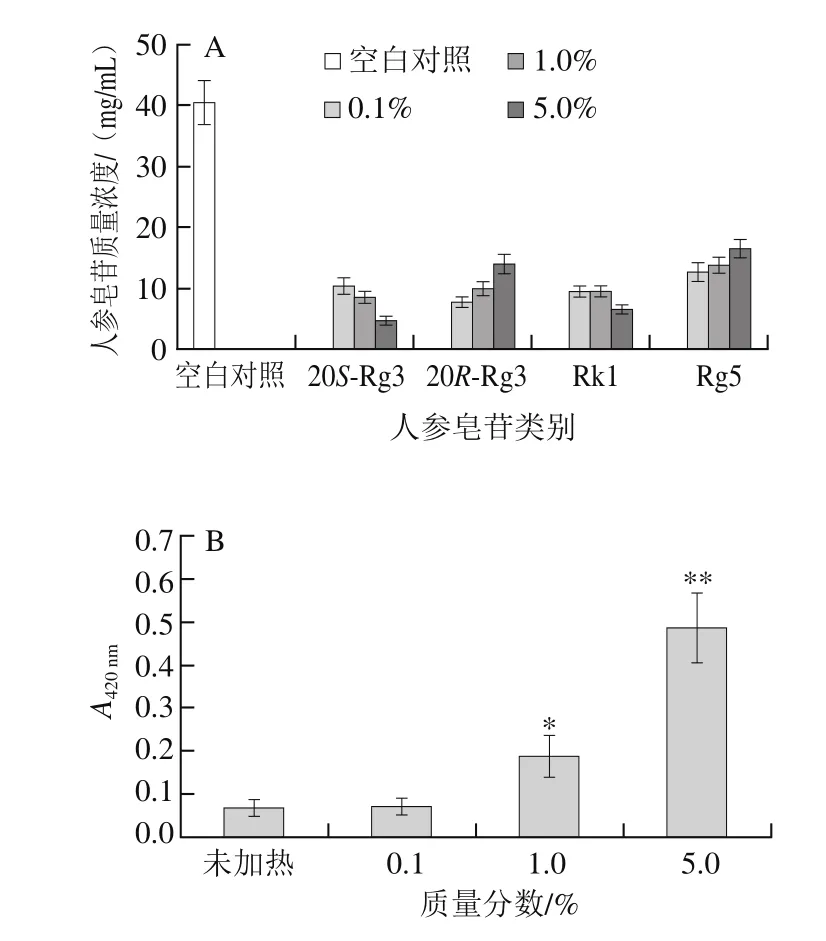
图5 天冬氨酸质量分数对二醇组皂苷的降解及美拉德反应的影响Fig. 5 Effect of aspartic acid concentration on the transformation of PDG and Maillard reaction
由图5A可知,质量分数0.1%天冬氨酸既可以使人参二醇组皂苷完全转化成20S-Rg3、20R-Rg3、Rk1和Rg5,说明低质量分数的天冬氨酸就能使人参皂苷高效的降解。刘敏等[30]研究报道了纤维素、淀粉、精氨酸对人参皂苷Rb1水解反应的影响,结果展示了精氨酸不但不能降解人参皂苷Rb1,相反还抑制其水解。这说明了氨基酸的酸碱性对人参皂苷的降解程度有很大的影响。在美拉德反应褐变程度上,含有质量分数0.1%天冬氨酸的样品与未加热样品不存在显著性差异,质量分数5.0%天冬氨酸的样品褐变程度变化显著(P<0.01),说明氨基酸的质量分数对褐变程度的影响较大(图5B)。因此质量分数为5.0%的天冬氨酸为最佳的水解皂苷和美拉德反应条件。
2.7 蒸制时间对二醇组皂苷的降解及美拉德反应褐变程度的影响
将人参二醇组皂苷(200 mg)溶于4 mL质量分数为5.0%天冬氨酸的水溶液,分别在120 ℃条件下蒸制1、2 h和4 h。研究不同蒸制时间对人参二醇组皂苷的降解和美拉德反应褐变程度的影响。

图6 蒸制时间对二醇组皂苷的降解及美拉德反应的影响Fig. 6 Effect of heating time on the transformation of PDG and Maillard reaction
由图6A可知,在120 ℃条件下蒸制1 h,人参二醇组皂苷均被完全转化成20S-Rg3、20R-Rg3、Rk1和Rg5,且人参皂苷20R-Rg3和Rg5的质量浓度随着蒸制时间的延长而升高,20S-Rg3和Rk1的质量浓度随着蒸制时间的延长而降低;但蒸制2 h和4 h的样品皂苷变化不明显。美拉德反应褐变程度也随着时间的延长而增加,蒸制1 h的样品与未加热样品不存在显著性差异,蒸制2 h和4 h的样品褐变程度变化极显著(P<0.01),说明蒸制时间对褐变程度也有较大的影响(图6B)。因为蒸制2 h和4 h稀有皂苷的生成和褐变程度变化较小,所以最优的蒸制时间为2 h。
2.8 美拉德反应产物对DPPH自由基的清除作用
如图7所示,天冬氨酸与人参二醇组皂苷未加热样品和天冬氨酸与葡萄糖未加热样品表现出较弱的清除DPPH自由基的作用;天冬氨酸与人参二醇组皂苷经过80 ℃加热2 h后,虽然天冬氨酸可以将人参二醇组皂苷降解成稀有人参皂苷20S-Rg3、20R-Rg3、Rk1和Rg5,但其抗氧化活性与未加热样品无明显差异,说明了人参皂苷20S-Rg3、20R-Rg3、Rk1和Rg5有较弱的抗氧化活性。而天冬氨酸与人参二醇组皂苷120 ℃加热样品和天冬氨酸与葡萄糖120 ℃加热样品清除DPPH自由基的作用较未加热组显著增加(P<0.01),说明了在高温条件下天冬氨酸与人参皂苷上水解产生的糖发生了美拉德反应,美拉德反应产物具有较好的抗氧化活性。
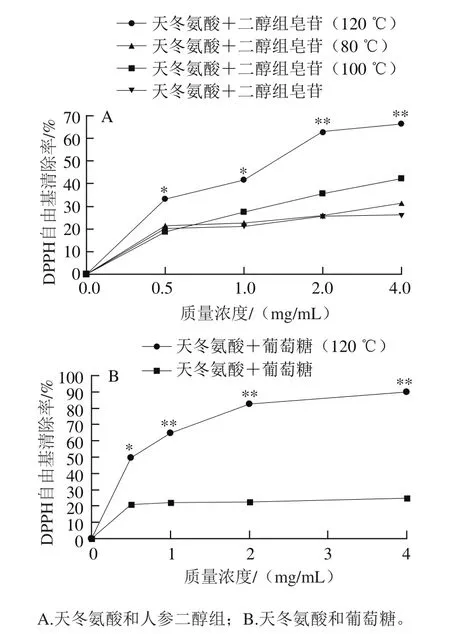
图7 美拉德反应产物对DPPH自由基的清除作用Fig. 7 DPPH radical scavenging capacity of Maillard reaction products
3 结 论
本研究以天冬氨酸为催化剂,研究了在高温高压条件下,天冬氨酸对人参二醇组皂苷的降解及其美拉德反应产物的抗氧化活性。结果表明,在高温蒸煮下,天冬氨酸能使人参二醇组皂苷降解成稀有皂苷20S-Rg3、20R-Rg3、Rk1和Rg5,其转化途径为人参二醇组皂苷→20S-Rg3/20R-Rg3→Rk1/Rg5。人参皂苷20R-Rg3和Rg5的质量浓度随着温度的升高而升高,20S-Rg3和Rk1的质量浓度随着温度的升高而降低。在美拉德反应褐变程度上,人参二醇组皂苷120 ℃加热样品不发生褐变,而天冬氨酸与人参二醇组皂苷120 ℃加热样品和天冬氨酸与葡萄糖120 ℃加热样品褐变程度极显著增加(P<0.01),这说明了天冬氨酸降解人参二醇组皂苷的同时,能与皂苷水解产生的糖发生美拉德反应,产生褐变。另外高温和高质量分数的天冬氨酸美拉德反应褐变程度较高,而低温和低质量分数的天冬氨酸美拉德反应褐变程度较弱。通过蒸煮温度、天冬氨酸质量分数和蒸制时间对二醇组皂苷的降解及美拉德反应褐变程度的影响研究,最终确定最佳的水解条件为:蒸煮温度为120 ℃,天冬氨酸的质量分数为5%,蒸制时间为2 h。抗氧化实验结果表明,未加热的天冬氨酸和二醇组皂苷的混合样品的抗氧化作用较弱,然而随着蒸煮温度的升高,天冬氨酸与人参二醇组皂苷反应样品对DPPH自由基的清除作用明显增强(P<0.01),这正好与美拉德反应褐变程度的变化一致,说明反应样品中具有抗氧化作用的主要物质为美拉德反应产物。
由于天冬氨酸属于弱酸,反应较温和、副产物少,因而反应产物的得率较高。另外天冬氨酸是动植物所必需的营养成分,可降解,无毒副作用;在高温条件下,天冬氨酸不但可以水解人参皂苷,同时还可以生成美拉德反应产物;因而本研究对开发绿色环保型人参稀有皂苷保健食品具有重要价值和意义,将具有广阔的工业化应用前景。
参考文献:
[1] KIM W Y, KIM J M, HAN S B, et al. Steaming of ginseng at high temperature enhances biological activity[J]. Journal of Natural Products, 2000, 63(12): 1702-1704. DOI:10.1021/np990152b.
[2] NAM K Y. The comparative understanding between red ginseng and white ginseng, processed ginsengs (Panax ginseng C. A. Meyer)[J].Journal of Ginseng Research, 2005, 29(1): 1-18. DOI:10.5142/JGR.2005.29.1.001.
[3] SUN S, QI L W, DU G J, et al. Red notoginseng: higher ginsenoside content and stronger anticancer potential than Asian and American ginseng[J]. Food Chemistry, 2011, 125(4): 1299-1305. DOI:10.1016/j.foodchem.2010.10.049.
[4] LIU Z, XIA J, WANG C Z, et al. Remarkable impact of acidic ginsenosides and organic acids on ginsenoside transformation from fresh ginseng to red ginseng[J]. Journal of Agricultural and Food Chemistry, 2016, 64(26): 5389-5399. DOI:10.1021/acs.jafc.6b00963.
[5] KIM S N, HA Y W, SHIN H, et al. Simultaneous quantification of 14 ginsenosides in Panax ginseng C. A. Meyer (Korean red ginseng)by HPLC-ELSD and its application to quality control[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 45(1): 164-170.DOI:10.1016/j.jpba.2007.05.001.
[6] XIE Y Y, LUO D, CHENG Y J, et al. Steaming-induced chemical transformations and holistic quality assessment of red ginseng derived from Panax ginseng by means of HPLC-ESI-MS/MSn-based multicomponent quantification fingerprint[J]. Journal of Agricultural and Food Chemistry, 2012, 60(33): 8213-8224. DOI:10.1021/jf301116x.
[7] LIU Z Q. Chemical insights into ginseng as a resource for natural antioxidants[J]. Chemical Reviews, 2012, 112(6): 3329-3355.DOI:10.1021/cr100174k.
[8] QI L W, WANG C Z, YUAN C S. Ginsenosides from American ginseng: chemical and pharmacological diversity[J]. Phytochemistry,2011, 72(8): 689-699. DOI:10.1016/j.phytochem.2011.02.012.
[9] PARK E K, CHOO M K, HAN M J, et al. Ginsenoside Rh1possesses antiallergic and anti-inflammatory activities[J]. International Archives of Allergy and Immunology, 2004, 133(2): 113-120.DOI:10.1159/000076383.
[10] LEE K Y, LEE Y H, KIM S I, et al. Ginsenoside-Rg5suppresses cyclin E-dependent protein kinase activity via up-regulating p21Cip/WAF1 and down-regulating cyclin E in SK-HEP-1 cells[J]. Anticancer Research, 1997, 17(2): 1067-1072.
[11] BAEK N L, KIM D S, LEE Y H, et al. Cytotoxicities of ginseng saponins and their degradation products against some cancer cell lines[J]. Archives of Pharmacal Research, 1995, 18(3):164-168.
[12] 孟勤, 尹建元, 赵俊艳, 等. HPLC法测定西洋参茎叶总皂苷降解物中20(S)-人参皂苷Rg3的含量[J]. 中草药, 2003, 34(6): 525-526.
[13] KAROUI R, NICOLAÏ B, DE BAERDEMAEKER J. Monitoring the egg freshness during storage under modified atmosphere by fluorescence spectroscopy[J]. Food and Bioprocess Technology, 2008,1(4): 346-356. DOI:10.1007/s11947-007-0011-4.
[14] LERTITTIKUL W, BENJAKUL S, TANAKA M. Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J]. Food Chemistry, 2007, 100(2): 669-677. DOI:10.1016/j.foodchem.2005.09.085.
[15] MORALES F J, JIMÉNEZ-PÉREZ S. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry, 2000, 72(1): 119-125. DOI:10.1016/S0308-8146(00)00239-9.
[16] JING H, KITTS D D. Chemical and biochemical properties of casein sugar Maillard reaction products[J]. Food and Chemical Toxicology,2002, 40(7): 1007-1015. DOI:10.1016/S0278-6915(02)00070-4.
[17] SONG N, TAN C, HUANG M G, et al. Transglutaminase crosslinking effect on sensory characteristics and antioxidant activities of Maillard reaction products from soybean protein hydrolysates[J].Food Chemistry, 2013, 136(1): 144-151. DOI:10.1016/j.foodchem.2012.07.100.
[18] 周小理, 张晓菁, 唐文, 等. 几种美拉德反应产物对人脐静脉内皮细胞增殖的影响[J]. 食品科学, 2011, 32(15): 281-284.
[19] RUFIÁN-HENARES J A, MORALES F J. Functional properties of melanoidins: in vitro antioxidant, antimicrobial and antihypertensive activities[J]. Food Research International, 2007, 40(8): 995-1002.DOI:10.1016/j.foodres.2007.05.002.
[20] VHANGANI L N, WYK J V. Antioxidant activity of Maillard reaction products (MRPs) derived from fructose-lysine and ribose-lysine model systems[J]. Food Chemistry, 2013, 137 (1/2/3/4): 92-98. DOI:10.1016/j.foodchem.2012.09.030.
[21] 孙成鹏, 高维平, 赵宝中, 等. 酒石酸催化转化原人参二醇组皂苷制备20(R)-人参皂苷Rg3[J]. 中草药, 2013, 44(14): 1893-1898.DOI:10.7501/j.issn.0253-2670.2013.14.006.
[22] 孙成鹏, 高维平, 赵宝中, 等. 柠檬催化转化原人参二醇组皂苷制备人参皂苷Rg5的初步研究[J]. 中成药, 2013, 35(12): 2694-2698.DOI:10.3969/j.issn.1001-1528.2013.12.030.
[23] HWANG I G, KIM H Y, WOO K S, et al. Biological activities of Maillard reaction products (MRPs) in a sugar-amino acid model system[J]. Food Chemistry, 2011, 126(1): 221-227. DOI:10.1016/j.foodchem.2010.10.103.
[24] BAISIER W M, LABUZA T P. Maillard browning kinetics in a liquid model system[J]. Journal of Agricultural and Food Chemistry, 1992,40(5): 707-713.
[25] 王海敏, 虞海霞, 董蕊, 等. 苕子蜜酚酸和总黄酮含量测定及抗氧化活性的研究[J]. 食品科学, 2010, 31(1): 54-57.
[26] 滕荣伟, 李海舟, 王德祖, 等. 三个原人参二醇型单糖链配糖体的NMR信号全指定[J]. 波谱学杂志, 2000, 17(6): 461-468.
[27] PARK I H, HAN S B, KIM J M, et al. Four new acetylated ginsenosides from processed ginseng (sun ginseng)[J]. Archives of Pharmacal Research, 2002, 25(6): 837-841.
[28] 马丽媛, 杨秀伟. 人参茎叶总皂苷酸水解产物化学成分研究[J]. 中草药, 2015, 46(17): 2523-2533. DOI:10.7501/j.issn.0253-2670.2015.17.005.
[29] 张春红, 李向高, 张连学, 等. 温度和酸的种类对人参二醇得率的影响[J]. 特产研究, 2005, 27(4): 18-20.
[30] 刘敏, 郑培和, 金银萍, 等. 纤维素、淀粉、精氨酸对人参皂苷Rb1水解反应的影响[J]. 特产研究, 2013, 35(1): 38-40; 54.
