不同方案丙种球蛋白治疗儿童吉兰-巴雷综合征的疗效
2018-04-24彭露,曹洁
彭 露,曹 洁
(重庆医科大学附属儿童医院全科病房/儿童发育疾病研究教育部重点实验室/儿童发育重大疾病国家国际科技合作基地/儿科学重庆市重点实验室,重庆 400014)
吉兰-巴雷综合征(Guillain-Barré syndrome, GBS)是一种急性免疫性周围神经病。目前对于GBS应用免疫球蛋白疗法(IVIG)治疗无统一方案,多数推荐大剂量IVIG每天0.4 g/kg,连续5 d静脉滴注,主要是基于其他血液系统自身免疫性疾病的研究制订的[1],但对于GBS予以丙种球蛋白治疗的个性化给药仍不明确,需要进一步研究丙种球蛋白治疗GBS的最佳方案。为探索疗效更佳的丙种球蛋白治疗GBS的方案,现对2种丙种球蛋白使用方案治疗儿童GBS的临床情况总结分析如下。
1 资料与方法
1.1研究对象回顾性分析2010年1月-2017年4月期间重庆医科大学附属儿童医院收治的确诊GBS患儿的临床资料,纳入标准:①符合GBS的诊断标准[2];②排除确诊GBS但治疗过程中应用激素、血浆置换治疗及丙种球蛋白使用方案不符合本文研究要求的患者。
1.2分组以丙种球蛋白使用方案分组:2组丙种球蛋白总量均为2 g/kg,甲组分1~2 d静脉滴注,乙组分3~5 d静脉滴注。所有患者均予以营养神经等对症支持治疗。
1.3疗效判定①显效:呼吸肌及球麻痹基本恢复,四肢肌力达Ⅳ级及以上;②有效:呼吸肌、球麻痹及四肢肌力较治疗前改善;③无效:病情无改善、加重或死亡。
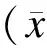
2 结 果
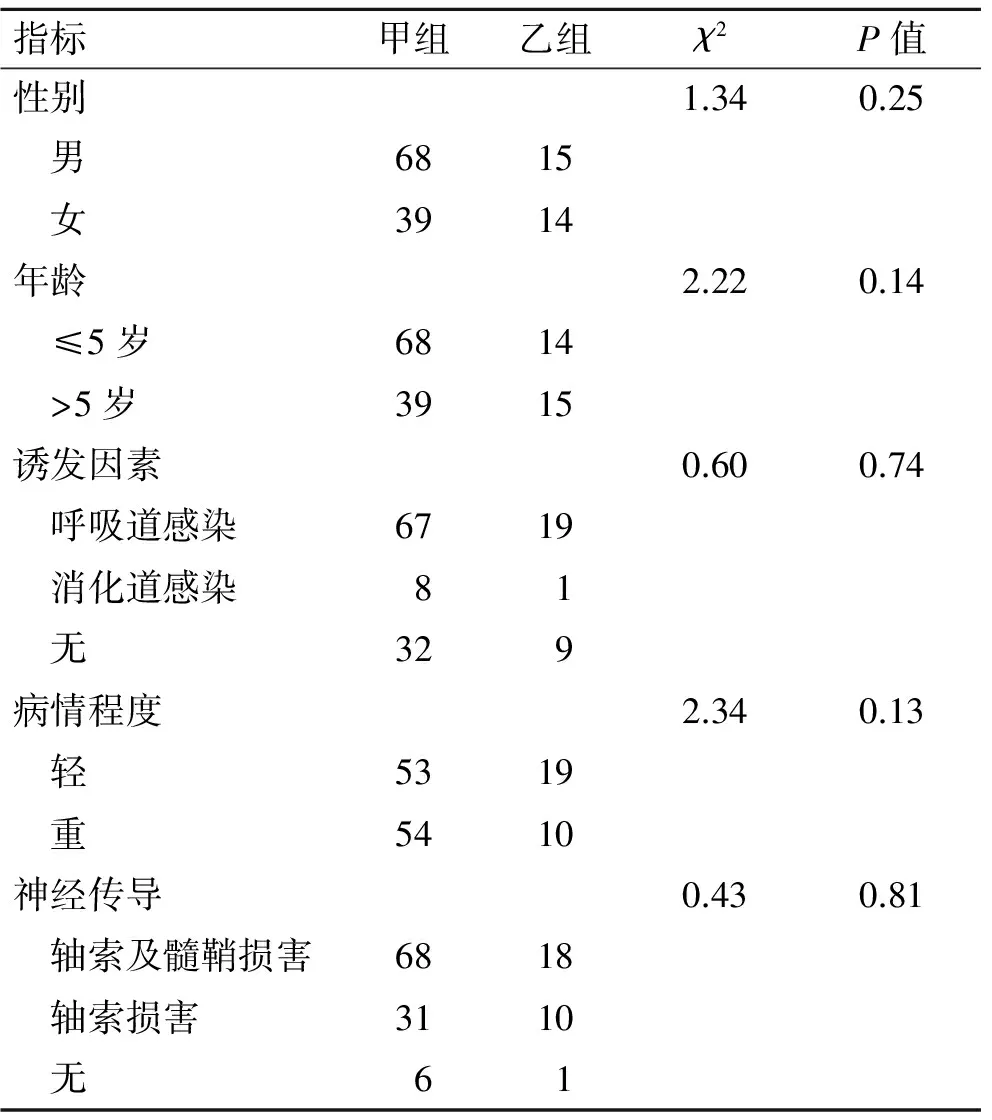
2.1一般情况入选的GBS患儿共136例(男∶女=83∶53),平均年龄(5.3±3.5)岁;一年四季均有发病,四季发病率无明显差异;发病至入院时间为(7.8±6)d;所有患者均有肌力的降低,其中四肢受累64例(47.1%),双下肢受累71例(52.2%),偏侧受累1例(0.7%);膝反射减退或消失104例(76.5%),腹壁反射减弱或消失81例(59.6%),颅神经受累45例(33.1%),感觉减退或消失24例(17.6%),呼吸困难11例(8.1%)。两组患儿病情严重程度无明显差异(以四肢肌力判定病情轻重,重:0~Ⅱ级;轻:Ⅲ~Ⅴ级,表1);甲组住院时间为14(11~32)d,乙组住院时间为13(9.5~30)d,两组住院时间比较差异无统计学意义(Z=-1.17,P=0.24)。
2.2辅助检查所有患者均行脑脊液检查,其中脑脊液蛋白定量为(1.52±1.26)g/L,其中14例(10.3%)患儿脑脊液蛋白正常(均为病程2周内结果);122例(89.7%)患儿脑脊液蛋白水平有不同程度的升高,呈蛋白细胞分离特征。有134例患者在住院期间行神经传导速度检查,其中132例(98.5%)提示异常:轴索及髓鞘损害有86例(64.2%),轴索损害有41例(30.6%),7例(5.2%)无轴索或脱髓鞘病变,复合肌肉运动电位(CMAP)波幅降低或缺失者123例(91.8%)、运动神经传导速度(MCV)减慢者74例(55.2%)、F波异常者115例(85.8%)、H反射异常者97例(72.4%)。本研究中有66例行头颅及脊椎MRI平扫[正常:52例(78.8%);异常:14例(21.2%)],55例行头颅及脊椎MRI平扫+增强[正常:7例(12.7%);异常:48例(87.3%)];MRI平扫异常表现主要包括:脊髓中央管扩张、囊肿、脑沟增宽、髓鞘化延迟等非特异性改变;MRI平扫+增强异常表现主要包括:脊神经根、马尾神经及脊膜的异常强化、脊髓异常信号、椎管内硬膜外积液、局部脱髓鞘病变。
表1两组患儿的基本情况
Tab.1 The basic information of the two groups [n(%)]
指标甲组乙组χ2P值性别1.340.25 男6815 女3914年龄2.220.14 ≤5岁6814 >5岁3915诱发因素0.600.74 呼吸道感染6719 消化道感染81 无329病情程度2.340.13 轻5319 重5410神经传导0.430.81 轴索及髓鞘损害6818 轴索损害3110 无61
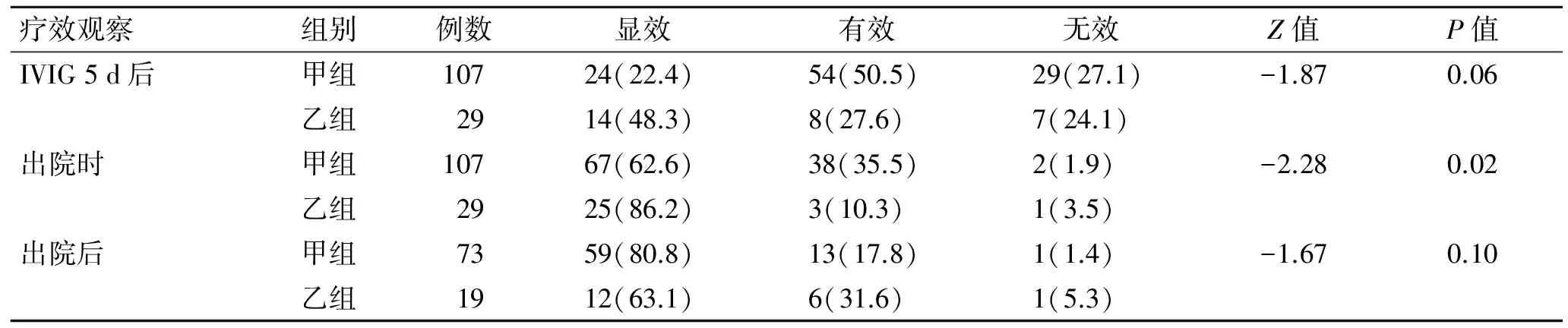
2.3临床疗效两组患儿予以丙种球蛋白治疗后5 d 疗效差异无统计学意义,但乙组显效率(48.3%)较甲组(22.4%)高。两组患儿出院时疗效差异有统计学差异(P<0.05),甲组显效率为62.6%,乙组显效率为86.2%。出院后2017年7月电话随访92名患儿(另外44名患儿失访),截止随访时间为止,甲组病程为34(12,53)月,乙组病程为22(9,34)月,两组总病程比较差异无统计学意义(Z=-1.80,P=0.07),认为两组具有可比性,其中死亡2例(2.2%),1例于急性期死亡,1例于恢复期发生严重感染导致死亡,两组疗效差异无统计学意义(表2)。
2.4复发情况2017年7月电话随访92名患儿(另外44名患儿失访),其中有3例患儿出现复发,仅1例为缓解后1月内出现复发,另外2例于0.5~1年内出现复发,比较两组复发情况差异无统计学意义(表3)。
表2两组患儿IVIG治疗后的临床疗效
Tab.2 The clinical effect after IVIG treatment in the two groups [n(%)]
疗效观察组别例数显效有效无效Z值P值IVIG5d后甲组10724(22.4)54(50.5)29(27.1)-1.870.06乙组2914(48.3)8(27.6)7(24.1)出院时甲组10767(62.6)38(35.5)2(1.9)-2.280.02乙组2925(86.2)3(10.3)1(3.5)出院后甲组7359(80.8)13(17.8)1(1.4)-1.670.10乙组1912(63.1)6(31.6)1(5.3)
表3两组患儿的复发情况
Tab.3 The relapse in the two groups [n(%)]

复发情况例数无复发有复发χ2P值甲组7371(97.3)2(2.7)0.301.00乙组1918(94.7)1(5.3)
3 讨 论
GBS是一种急性免疫性周围神经病,其病因不明,大多数存在着T细胞功能紊乱和B细胞多克隆活化等细胞和体液免疫功能异常。据报道GBS全球的发病率是0.6~2.4/10万,儿童发病率则稍偏低,约为0.34~1.34/10万[3-5];GBS发病高峰季节在不同地区分别为冬季、夏季或无明显季节差异[6];男女比例约为1.5∶1[7]。本研究中男女比例呈1.57∶1,基本与之相符;大约70%患者病前1~3周有急性感染病史,常见病原包括空肠弯曲杆菌、肺炎支原体、流感嗜血杆菌、巨细胞病毒、EB病毒及流感病毒[8]。而本组患儿86例(63.2%)有呼吸道感染史,9例(6.6%)消化道感染史,病原以EB病毒、副流感嗜血杆菌、肺炎链球菌、单疱病毒、柯萨奇病毒及巨细胞病毒为主。GBS主要表现为四肢对称性弛缓性瘫痪,伴或者不伴有自主神经功能或感觉神经障碍,常累及颅神经,以球麻痹及面神经受累为主[9-10]。绝大部分GBS患者在起病后的1年 内症状缓解,也有症状持续长达3年或以上的患者[11]。儿童GBS死亡率约3%~5%[12]。
GBS病因治疗主要是抑制免疫反应,减轻或消除致病性因子对神经髓鞘的损害,促进受损神经髓鞘的修复及再生。病因治疗的一线方案主要包括IVIG和血浆置换疗法(PE),一系列关于PE、IVIG及PE联合IVIG治疗GBS的研究显示其疗效无显著性差异[13-14],但不建议两者联合应用。由于IVIG用于治疗GBS患者操作简单,可广泛应用,副反应少,安全性高,故IVIG已成为治疗GBS的首选方法。
目前,影响IVIG药代动力学变化的机制尚不清楚,识别影响免疫球蛋白药代动力学的潜在遗传因素将是实现个性化给药至关重要的一步。丙种球蛋白治疗后IgG提高水平与其愈后呈正相关:ΔIgG(丙种球蛋白治疗2周后IgG-基础IgG即起病2周后IgG水平) 越小,患者恢复到可独立行走时间越长。多因素分析显示GBS愈后与基础IgG和丙种球蛋白治疗2周 后IgG水平无明显相关性。愈后不同的GBS患者病程达2周后的血清IgG升高水平有很大的差异,而且IgG水平低则愈后差,对于这部分患者适合二次IVIG治疗,将缩短其病程[15]。对于标准疗程IVIG (2 g/kg)治疗效果欠佳的患者,再次予以丙种球蛋白治疗,病情较前有明显改善,但因其为非对照研究,故尚不能确定患者病情改善是二次IVIG的作用[16-17]。
有研究表明,予以丙种球蛋白总量2 g/kg分2 d或5 d静脉滴注治疗51例GBS儿童,其疗效差异无统计学意义,但短疗程组早期复发率更高[18]。而本研究随访92例患儿,对于丙种球蛋白总量2 g/kg分1~2 d和3~5 d静脉滴注,两组复发率则无明显差异,故考虑本研究的2种丙种球蛋白使用方案对其复发率无明显影响。
目前,对于GBS应用IVIG治疗无统一方案,多数推荐静脉滴注大剂量IVIG每天0.4 g/kg,连用5 d,也有主张集中在1~2 d冲击治疗。结合本研究结果:不同丙种球蛋白方案(总剂量2 g/kg分1~2 d和3~5 d给药)治疗儿童GBS出院时的疗效差异有统计学意义(P=0.02),3~5 d组显效率更高,故推荐2 g/kg丙种球蛋白分3~5 d使用,而其整体复发情况比较差异无统计学意义。由于本研究样本量有限,对于2 g/kg丙种球蛋白具体使用天数,尚需扩大样本进一步探索。
参考文献:
[1] KERR J, QUINTI I, EIBL M, et al. Is dosing of therapeutic immunoglobulins optimal? A review of a three-decade long debate in Europe[J]. Frontiers Immunol, 2014, 5:629.
[2] 中华医学会神经病学分会神经肌肉病学组,中华医学会神经病学分会肌电图及临床神经电生理学组,中华医学会神经病学分会神经免疫学组. 中国吉兰-巴雷综合征诊治指南[J]. 中华神经科杂志, 2010, 43(8):583-586.
[3] SEJVAR JJ, BAUGHMAN AL, WISE M, et al. Population incidence of Guillain-Barre syndrome: A systematic review and meta-analysis[J]. Neuroepidemiology, 2011, 36(2):123-133.
[4] SOYSAL A, AYSAL F, CALISKAN B, et al. Clinico-electrophysiological findings and prognosis of Guillain-Barré syndrome—10 years’ experience[J]. Acta Neurol Scand, 2011, 123(3):181-186.
[6] WEBB AJ, BRAIN SA, WOOD R, et al. Seasonal variation in Guillain-Barre syndrome: A systematic review, meta-analysis and Oxfordshire cohort study[J]. J Neurol Neurosurg Psychiatry, 2015, 86(11):1196-1201.
[7] DHADKE SV, DHADKE VN, BANGAR SS, et al. Clinical profile of Guillain Barre syndrome[J]. J Asso Physicians India, 2013, 61(3):168-172.
[8] WALLING AD, DICKSON G. Guillain-Barré syndrome[J]. Am Fam Physician, 2013, 87(3):191-197.
[9] NANDA SK, JAYALAKSHMI S, RUIKAR D, et al. Twelfth cranial nerve involvement in Guillian Barre syndrome[J]. J Neurosci Rural Pract, 2013, 4(3):338-340.
[10] BHARGAVA A, BANAKAR BF, PUJAR GS, et al. A study of Guillain-Barré syndrome with reference to cranial neuropathy and its prognostic implication[J]. J Neurosci Rural Pract, 2014, 5(Suppl 1):S43-S47.
[11] WILLISON HJ, JACOBS BC, VAN DOORN PA. Guillain-Barré syndrome[J]. Lancet, 2016, 388(10045):717-727.
[12] SALEHIOMRAN MR, NIKKHAH A, MAHDAVI M. Prognosis of Guillain-Barré syndrome in children[J]. Iran J Child Neurol, 2016, 10(2):38-41.
[13] HUGHES RA, SWAN AV, VAN DOORN PA. Intravenous immunoglobulin for Guillain-Barré syndrome[J]. Cochrane Database Syst Rev, 2014, 9:CD002063.
[14] SUDULAGUNTA SR, SODALAGUNTA MB, SEPEHRAR M, et al. Guillain-Barré syndrome: clinical profile and management[J]. Ger Med Sci, 2015, 13:Doc16.
[15] KUITWAARD K, DE GELDER J, TIO-GILLEN AP, et al. Pharmacokinetics of intravenous immunoglobulin and outcome in Guillain-Barré syndrome[J].Ann Neurol, 2009, 66(5):597-603.
[16] GODOY DA, RABINSTEIN A. Is a second cycle of immunoglobulin justified in axonal forms of Guillain-Barré syndrome?[J]. Arq Neuropsiquiatr, 2015, 73(10):848-851.
[17] VERBOON C, VAN DOORN PA, JACOBS BC. Treatment dilemmas in Guillain-Barré syndrome[J]. J Neurol Neurosurg Psychiatry, 2017, 88(4):346-352.
[18] KORINTHENBERG R, SCHESSL J, KIRSCHNER J, et al. Intravenously administered immunoglobulin in the treatment of childhood Guillain-Barré syndrome: A randomized trial[J]. Pediatrics, 2005, 116(1):8-14.
