Vaspin通过胰岛素信号通路改善地塞米松诱导的3T3-L1脂肪细胞的胰岛素抵抗
2018-04-24农晰婷刘晓霞武金娥成淑英孙超峰
刘 萍,农晰婷,刘晓霞,张 薇,武金娥,周 鑫,成淑英,孙超峰
(1. 西安市第三医院内分泌科,陕西西安 710018;西安市中心医院内分泌科,陕西西安 710003;3. 西安交通大学第一附属医院心内科,陕西西安 710061)
胰岛素抵抗是代谢综合征、糖尿病和动脉粥样硬化的共同病理生理改变。在胰岛素信号通路中,主要和糖代谢相关的是磷脂酰肌醇3激酶(PI3K)/Akt通路。胰岛素是糖、脂肪代谢的主要调控激素,在机体的主要靶器官是肝脏、脂肪和骨骼肌细胞,上述信号通路传导发生障碍,将导致葡萄糖利用降低,糖原合成减少,导致机体胰岛素抵抗。
脂肪组织是胰岛素抵抗发生的一个重要部位,脂肪组织不仅参与能量代谢,而且是特殊的内分泌器官[1],可分泌多种细胞及组织因子,来自脂肪组织的细胞因子对胰岛素抵抗的发生有重要作用[2]。近年来研究发现,由它产生的许多细胞因子通过调节免疫和炎症反应等途径参与胰岛素抵抗及其相关疾病,如代谢综合征、2型糖尿病的发生发展[3-4]。
Vaspin(visceral adipose tissue-derived serineprotease inhibitor)为内脏脂肪组织特异性丝氨酸蛋白酶抑制剂,属于丝氨酸蛋白酶抑制剂家族成员,是日本学者HIDA等[5]在2005年首先从T2DM肥胖大鼠(OLETF大鼠)内脏脂肪组织中分泌出来的新的脂肪因子。在肥胖的大鼠或是人的脂肪组织中Vaspin的表达均明显增高,在肥胖和胰岛素抵抗的人血清中Vaspin的浓度也明显增加[6-7]。大量研究表明,Vaspin具有改善胰岛素敏感性,调节糖、脂代谢及抑制炎性因子的作用[8],但是Vaspin如何调节脂肪细胞的生物学效应,从而调节糖脂代谢、增加胰岛素敏感性,具体作用机制还不明确。
1 材料与方法
1.13T3-L1前脂肪细胞的培养及诱导分化3T3-L1前脂肪细胞购自中国医学科学院基础医学研究所北京协和医学院细胞资源中心。取3代左右的3T3-L1前脂肪细胞种在6孔板上,待细胞贴壁,生长至完全汇合并达到相互接触抑制后2 d,更换培养基为含有异丁基甲基黄嘌呤(IBMX)0.5 mmol/L(Sigma-Aldrich, USA)、地塞米松1 μmol/L(Sigma-Aldrich, USA)和胰岛素10 μg/mL(Sigma-Aldrich, USA)诱导剂及100 mL/L胎牛血清的DMEM高糖培养基。2 d后,更换诱导剂的培养基为含有100 mL/L胎牛血清和胰岛素的培养基继续培养,随后2 d换为仅含有100 mL/L 胎牛血清的完全培养基,每2 d换液一次。继续培养4 d(即诱导分化8 d)。在8 d后,90%以上的细胞都分化为成熟的脂肪细胞。
1.2Westernblot法检测Vaspin对成熟脂肪细胞PAKT/AKT通路的影响分化成熟的脂肪细胞在含有20 mL/L胎牛血清高糖DMEM中培养6 h。将成熟脂肪细胞分为4组:对照组、Vaspin(PEPROTECH USA)50 ng/mL组、Vaspin 100 ng/mL组、Vaspin 200 ng/mL组,培养12 h收取细胞,Western blot检测PAKT/AKT变化。
1.3胰岛素抵抗细胞模型的建立及实验分组
1.3.1胰岛素抵抗细胞模型的建立 分化成熟的脂肪细胞同步化6 h,将成熟脂肪细胞分为对照组和地塞米松处理组。地塞米松处理组细胞:将培养基更换为含有1 μmol/L地塞米松和100 mL/L胎牛血清的高糖DMEM继续培养到48 h;对照组细胞更换为仅含100 mL/L胎牛血清的高糖DMEM,同时设立未接种细胞的空白对照,加入等体积的DMEM高糖培养基。分别收集24、48 h各组细胞培养基上清,用葡萄糖氧化酶法测定细胞培养上清液中的葡萄糖浓度,所得浓度与未接种细胞的DMEM高糖培养基的葡萄糖浓度相减,得出各组细胞的葡萄糖消耗量。
1.3.2实验分组 分化成熟的脂肪细胞同步化6 h,随机分为4组:对照组、模型对照组、实验组、Vaspin 200 ng/mL+wortmannin 100 nmol/L组。①对照组:不建模,为100 mL/L胎牛血清的高糖DMEM培养;②模型对照组:建模不干预,含有1 μmol/L地塞米松和100 mL/L胎牛血清的高糖DMEM培养;③实验组:建模同时,Vaspin 200 ng/mL干预24 h;④Vaspin 200 ng/mL+wortmannin 100 nmol/L组,用wortmannin 100 nmol/L预处理30 min,建模同时,Vaspin 200 ng/mL干预24 h。
1.4细胞鉴定和检测
1.4.1成熟脂肪细胞的鉴定-油红O染色 将已经诱导分化成的3T3-L1脂肪细胞6孔板用PBS轻轻振荡洗涤2次,加入40 g/L多聚甲醛溶液,固定30 min,PBS缓冲液洗净,用油红O工作液,加入到固定好的脂肪细胞中,共同孵育2 h,PBS缓冲液洗至使其背景透明,胞质中脂滴被特异性的染为亮红色。
1.4.2各组细胞葡萄糖消耗量测定 分别于分组处理后第24、48、72 h,每孔吸取100 μL上清液,分别收集24、48、72 h各组细胞培养液上清,用葡萄糖氧化酶法测定细胞培养上清液中的葡萄糖浓度,所得浓度与未接种细胞的DMEM高糖培养基的葡萄糖浓度相减,得出各组细胞的葡萄糖消耗量。
1.4.3IRS-1、PI3K、phospho-Akt、Akt蛋白表达及磷酸化蛋白测定 采用Western blot检测IRS-1、PI3K、phospho-Akt、Akt蛋白表达。收集细胞并进行细胞裂解,磷酸化蛋白按1∶50加入磷酸酶抑制剂复合物,进行蛋白定量(BCA Protein Assay Kit)。取20 μg蛋白样品经SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将蛋白转移到PVDF膜上,用含有50 mL/L牛血清白蛋白的TBST室温封闭膜2 h,膜分别与兔来源的多克隆PI3K一抗(1∶2 000,EPITOMICS, USA)、phospho-473-Akt一抗(1∶1 000,EPITOMICS, USA)、Akt一抗(1∶1 000,EPITOMICS, USA)及IRS-1一抗(1∶2 000,Cell Signaling Technology, USA)4 ℃孵育过夜;1∶2 000稀释的HRP标记的羊抗兔二抗(EPITOMICS, USA)室温孵育2 h;将膜蛋白面朝下,与发光液避光充分反应5 min,根据Quantity One图像分析系统对条带进行测定,分析蛋白表达的相对量,计算灰度值,并与内参β-actin比对,校正蛋白定量等实验误差。
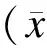
2 结 果
2.1细胞鉴定的结果3T3-L1前脂肪细胞诱导分化为成熟的脂肪细胞,油红O染色鉴定,3T3-L1前脂肪细胞成功分化为成熟脂肪细胞(图1)。
2.2地塞米松诱导成熟脂肪细胞产生胰岛素抵抗用1 μmol/L地塞米松作用于分化成熟的脂肪细胞,24、48 h通过葡萄糖氧化酶法测定细胞培养上清液中的葡萄糖浓度。实验证实,地塞米松作用使葡萄糖消耗量下降,24 h葡萄糖消耗量下降19.6%,48 h葡萄糖消耗量下降26.4%(图2)。成功建立胰岛素抵抗细胞模型。

图1脂肪细胞的鉴定
Fig.1 Identification of 3T3-L1 adipocytes (×200)
A:3T3-L1前脂肪细胞;B:油红O染色分化成熟的脂肪细胞。
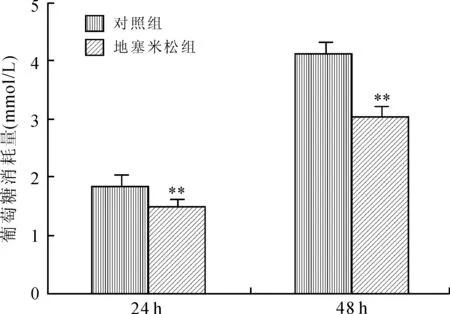
图21μmol/L地塞米松作用3T3-L1脂肪细胞对葡萄糖消耗量的影响
Fig.2 Effect of 1 μmol/L dexamethasone on glucose consumption of mature adipocytes
与对照组相比,**P<0.01。
2.3不同浓度Vaspin对成熟脂肪细胞PAKT/AKT通路的影响为了解Vaspin对成熟脂肪细胞PAKT/AKT通路的影响,我们用Vaspin(0、50、100、200 ng/mL)干预成熟脂肪细胞12 h,Western blot检测PAKT/AKT的表达。结果显示,与对照相比,PAKT随Vaspin浓度增加,表达增强,在50 ng/mL与对照相比没有明显差异,在100、200 ng/mL均有统计学差异(P<0.01,图3)。
2.4各组成熟3T3-L1脂肪细胞葡萄糖的消耗量对照组、模型对照组、实验组分组处理后24、48、72 h,24、48 h模型对照组与实验组比较,实验组葡萄糖消耗量均高于模型对照组,差异有统计学意义(P<0.05);72 h实验组葡萄糖消耗量也高于模型对照组,但没有统计学意义(P>0.05)。24、48、72 h对照组与实验组比较,葡萄糖消耗量没有统计学差异(P>0.05,图4)。
2.5Vaspin对各组3T3-L1脂肪细胞胰岛素信号通路PAKT/AKT、PI3K、IRS-1蛋白表达的影响Western blot结果显示,与对照组相比,模型对照组的IRS-1、PI3K、PAKT的蛋白表达降低,差异有统计学意义(P<0.01);与模型对照组相比,实验组IRS-1、PI3K、PAKT的蛋白表达量均上调,差异有统计学意义(P<0.01);wortmannin预处理则阻断了Vaspin对PAKT/AKT、PI3K、IRS-1的蛋白表达的上调(图5)。

图3不同浓度Vaspin对成熟脂肪细胞PAKT/AKT通路的影响
Fig.3 Effects of different concentrations of Vaspin on PAKT/AKT pathway of mature adipocytes
与对照组相比,**P<0.01。

图4各组3T3-L1脂肪细胞葡萄糖的消耗量
Fig.4 Glucose consumption of adipocytes in different groups
模型对照组与实验组相比,*P<0.05。

图5各组3T3-L1脂肪细胞PAKT/AKT、PI3K、IRS-1蛋白的相对表达量
Fig.5 The relative expressions of PAKT/AKT, PI3K and IRS-1 protein in different groups of adipocytes
图中柱形及所对应的条带依次为对照组、实验组、模型对照组及Vaspin+wortmannin组。实验组与模型对照组相比,##P<0.01;对照组与模型对照组相比,**P<0.01;实验组与Vaspin+wortmannin组相比,△△P<0.01。
3 讨 论
脂肪组织在胰岛素抵抗的发生和发展中发挥关键性作用。不仅脂肪组织在能量代谢中发挥着重要作用,同时,作为一个内分泌器官,其分泌的脂肪因子参与整个机体的代谢调节。研究认为:肥胖和胰岛素敏感性呈负相关。胰岛素抵抗被视为2型糖尿病、肥胖、血脂异常、高血压及动脉粥样硬化的共同危险因素。
Vaspin作为一个新的脂肪因子,由于抑制抵抗素、瘦素及TNF-α等前脂肪因子的表达,明显改善OLETF大鼠的胰岛素敏感性,因此Vaspin被认为是一个有胰岛素增敏作用的脂肪因子[5,7]。临床研究发现,在肥胖、T2DM等代谢综合征的胰岛素抵抗患者体内Vaspin水平明显高于非胰岛素抵抗者,血清中Vaspin水平被认为是机体对胰岛素抵抗的一种代偿性改变;通过改善患者体内胰岛素抵抗后血浆Vaspin水平也明显降低,血浆Vaspin水平与胰岛素抵抗呈正相关[9-10]。Vaspin可能延缓动脉粥样硬化进程[10]。JUNG等[11]研究发现Vaspin能激活血管内皮细胞内胰岛素信号通路PI3K/Akt,激活PI3K激酶,增加PI3K/Akt信号通路中Akt的磷酸化水平,并抑制游离脂肪酸诱导的内皮细胞的凋亡,从而保护血管内皮细胞。因此,Vaspin可能通过改善胰岛素敏感性,进一步改善血管内皮细胞功能,延缓动脉粥样硬化进程。此外,Vaspin通过阻止氧化应激减弱了高糖诱导的血管平滑肌细胞(VSMC)的增殖和激活,抑制了高糖诱导的MAPK、PI3K/Akt胰岛素受体信号以及核因子-KB信号通路[12]。目前,Vaspin在脂肪细胞特别是对于胰岛素抵抗的脂肪细胞的研究甚少。
脂肪细胞是胰岛素抵抗发生的一个重要部位。王丽静等[13]用不同浓度地塞米松(10 nmol/L、100 nmol/L及1 μmol/L)与成熟3T3-L1脂肪细胞孵育,结果显示地塞米松明显抑制脂肪细胞糖摄取,其中1 μmol/L地塞米松抑制葡萄糖利用率达到80%。本实验利用3T3-L1脂肪细胞建立胰岛素抵抗模型,研究Vaspin对脂肪细胞胰岛素抵抗的作用及其可能的机制。为了模拟脂肪细胞胰岛素抵抗模型,我们用1 μmol/L地塞米松诱导3T3-L1脂肪细胞产生胰岛素抵抗。
胰岛素通过胰岛素信号通路IRS/PI3K/AKT介导其糖代谢调节作用。IRS上磷酸化的酪氨酸残基与PI3K相互作用,PI3K能催化二磷酸磷脂酰肌醇为三磷酸磷脂酰肌醇,PI3K/Akt的激活促进GLUT4从胞质向胞膜转位,位于胞膜上的GLUT4可将细胞外的葡萄糖转运入细胞内,因此这一通路的活化将使细胞对葡萄糖的摄取增加。上述信号通路传导发生障碍,将导致脂肪、肌肉等组织产生胰岛素抵抗。我们观察了Vaspin对成熟脂肪细胞PI3K/Akt信号通路的影响,Vaspin能够激活PI3K/Akt信号通路,上调磷酸化AKT蛋白的表达,并呈剂量依赖性。为研究Vaspin在体外对胰岛素抵抗细胞的作用,特别是脂肪细胞,我们成功构建了地塞米松诱导的脂肪细胞胰岛素抵抗模型。用200 ng/mL Vaspin干预胰岛素抵抗的3T3-L1脂肪细胞,可以看出,在24、48 h葡萄糖的消耗量与模型对照组相比明显增加,有统计学意义,说明Vaspin抑制了地塞米松诱导的胰岛素抵抗。本研究用1 μmol/L地塞米松处理脂肪细胞,观察到胰岛素信号通路中IRS-1蛋白表达约抑制68%,PI3K约抑制69%,PAKT约抑制79%;通过Vaspin干预地塞米松诱导的脂肪细胞,可以看出Vaspin减弱了胰岛素信号通路中IRS-1、PI3K、PAKT地塞米松的抑制作用,与模型对照组相比,胰岛素信号通路中的蛋白均上调,推测Vaspin引起的上述改变可能与PI3K/Akt通路有关;通过使用PI3K的特异性抑制剂wortmannin预处理后再给予Vaspin,发现IRS-1、PI3K、PAKT明显被抑制,进一步提示Vaspin改善3T3-L1脂肪细胞的胰岛素抵抗可能是通过IRS-1/PI3K/Akt通路。
综上所述,本研究证实:Vaspin通过IRS-1/PI3K/Akt通路,增加了地塞米松诱导的胰岛素抵抗脂肪细胞对葡萄糖消耗,提示Vaspin可能影响胰岛素抵抗的脂肪细胞中胰岛素信号通路IRS-1、PI3K、PAKT的蛋白表达,增加葡萄糖的利用,从而改善胰岛素抵抗。因此,Vaspin可能作为很有潜力的治疗2型糖尿病的药物将被进一步研究。
参考文献:
[1] WOZNIAK SE,GEE LL,WACHTEL MS,et al. Adipose tissue: The new endocrine organ? A review article[J]. Dig Dis Sci, 2009, 54(9):1847-1856.
[2] SETHI JK, VIDAL-PUIG AJ. Thematic review series: Adipocyte biology. Adipose tissue function and plasticity orchestrate nutritional adaptation[J]. J Lipid Res, 2007, 48(6):1253-1262.
[3] GULEELIK NE, USMAN A, GURLEK A. Role of adipocytokines in predicting the development of diabetes and its late complications[J]. Endocrine, 2009, 36(3):397-403.
[4] VAN GAAL LF, MERTENS IL, DE BLOCK CE. Mechanisms linking obesity with cardiovascular disease[J]. Nature, 2006, 444(7121):875-880.
[5] HIDA K, WADA J, EGUCHI J, et al. Visceral adipose tissue-derived serine protease inhibitor: A unique insulin-sensitizing adipocytokine in obesity[J]. Proc Natl Acad Sci USA, 2005, 102(30):10610-10615.
[6] KORNER A, NEEF M, FRIEBE D, et al. Vaspin is related to gender, puberty and deteriorating insulin sensitivity in children[J]. Int J Obes (Lond), 2011, 35(4):578-586.
[7] PALA D, CARLOS-CANDIDO AP, LEANDRO-DA-CNUZ L, et al. Vaspin association with insulin resistance is related to physical activity and body fat in Brazilian adolescents—A cross-sectional study[J]. Nutr Hosp, 2016, 33(3):265.
[8] HANDISURYA A, RIEDL M, VILA G, et al. Serum Vaspin concentrations in relation to insulin sensitivity following RYGB-induced weight loss[J]. Obes Surg, 2010, 20(2):198-203.
[9] TAN BK, HEUTLING D, CHEN J, et al. Metformin decreases the adipokine Vaspin in overweight women with polycystic ovary syndrome concomitant with improvement in insulin sensitivity and a decrease in insulin resistance[J]. Diabetes, 2008, 57(6):1501-1507.
[10] LIN Y, ZHUANG J, ZHU G, et al. Vaspin attenuates the progression of atherosclerosis by inhibiting ER stress-induced macrophage apoptosis in apoE/mice[J].Mol Med Rep, 2016, 13(2):1509-1516.
[11] JUNG CH, LEE WJ, HWANG JY, et al. Vaspin protects vascular endothelial cells against free fatty acid-induced apoptosis through a phosphatidylinositol 3-kinase/Akt pathway[J]. Biochem Biophys Res Commun, 2011, 413(2):264-269.
[12] LI H, PENG W, ZHUANG J, et al. Vaspin attenuates high glucose-induced vascular smooth muscle cells proliferation and chemokinesis by inhibiting the MAPK, PI3K/Akt, and NF-kappaB signaling pathways[J]. Atherosclerosis, 2013, 228(1):61-68.
[13] 王丽静,张尉,刘小莺,等. 地塞米松诱导3T3-L1脂肪细胞胰岛素抵抗模型的建立[J]. 福建医科大学学报, 2007, (3):282-284.
