MMP-9及glypican-3在肝癌组织中的表达及其临床病理价值
2018-04-24朱月永
陈 薇,陈 靖,游 佳,朱月永,郑 琦
(福建医科大学附属第一医院肝病中心肝内科,福建福州 350005)
肝癌是发病率较高的恶性肿瘤。随着肝癌细胞的侵袭和转移,患者遭受的痛苦逐渐加大直至威胁生命[1]。近年来,对肝癌患者如何作出准确诊断及预后评价越来越引起人们的关注。有学者指出,基质金属蛋白酶-9(matrix metalloproteinase -9, MMP-9)与恶性肿瘤的侵袭及转移有关[2]。而磷脂酰肌醇蛋白聚糖-3(glypican-3)能够对肿瘤血管产生影响,同时在肝细胞癌中,gypican-3能够通过与MMP9结合以及与其他生长因子相关通路的相互作用而促进肝癌的进展[3]。本研究检测肝癌组织中MMP-9及glypican-3的表达并分析其临床病理价值。
1 资料与方法
1.1一般资料选取2014年3月至2016年7月于福建医科大学附属第一医院经病理学诊断为原发性肝癌的患者97例为肝癌组,所有对象在行外科手术前均未接受放化疗及免疫等治疗方案,男83例,女14例;平均年龄(48.24±13.15)岁,病理类型[4]等资料见表1。60例健康志愿者为对照组,均从健康体检者中选取,组织经肝穿刺获得,男51例,女9例;平均年龄(49.46±12.98)岁。入组患者及对照组人员均签署知情同意书,临床实验方案得到当地伦理委员会的审核及批准。
表1肝癌组患者的一般资料
Tab.1 Basic information of the observation group
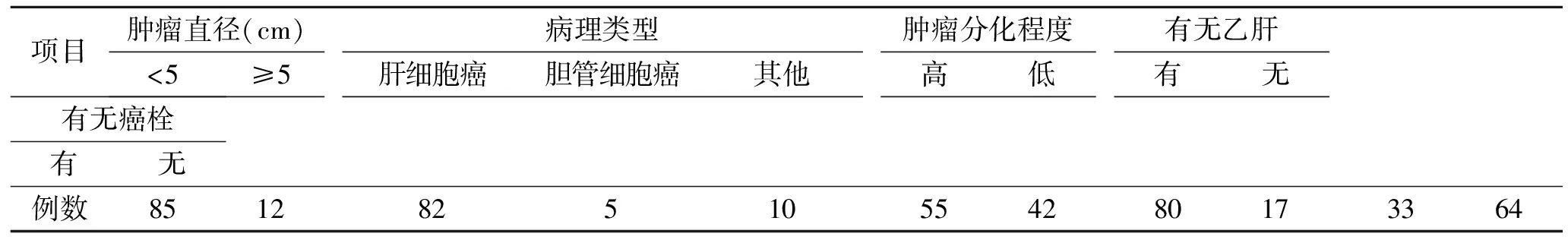
项目肿瘤直径(cm)<5≥5病理类型肝细胞癌胆管细胞癌其他肿瘤分化程度高低有无乙肝有无有无癌栓有无例数851282510554280173364
1.2免疫组织化学法检测MMP-9及glypican-3表达本研究中肝癌患者组织样本为97例,健康志愿者肝脏样本为60例,全部组织均使用免疫组化方法检测MMP-9和glypican-3的表达。所有研究对象肝脏组织进行石蜡包埋制作组织切片,脱蜡水化,双氧水进行内源性过氧化物酶的封闭处理,水洗后浸入磷酸盐缓冲液中5 min×2次。用磷酸盐缓冲液稀释的山羊血清(100 mL/L)封闭,室温孵育10 min后,弃血清,不水洗并分别加入MMP-9及glypican-3一抗工作液(1∶1 000),4 ℃孵育过夜。用磷酸盐缓冲液冲洗5 min×3次;再加入适量生物素标记二抗工作液(1∶5 000),37 ℃孵育30 min。用磷酸盐缓冲液冲洗5 min×3次。显色剂进行显色3~15 min,再用洁净水水洗,复染、脱水、透明、封片。采用常规方法统计评估[4]MMP-9及glypican-3的组化结果。
1.3MMP-9及glypican-3表达与临床病理的关系观察MMP-9及glypican-3表达变化与肝癌组肝癌临床特征之间的关系,包括肿瘤直径、分化程度、肝癌癌栓、甲胎蛋白(AFP)。
1.4统计学方法采用SPSS 19.0软件进行统计学分析。两组计量结果比较采用单样本t检验,计数与计量资料均使用四联表格式表示,使用χ2检验比较
临床指标的诊断特异性及敏感性,P<0.05为差异具有统计学意义。
2 结 果
2.1两组MMP-9、glypican-3表达的比较免疫组化检测结果显示,肝癌组患者的MMP-9、glypican-3表达阳性率和表达评分显著高于对照组(图1,表2,P<0.05)。

图1免疫组化法检测肝癌组与对照组中MMP-9与glypican-3的表达
Fig.1 Expressions of MMP-9 and glypican-3 in control and observation groups detected by immunohistochemistry
表2肝癌组与对照组中MMP-9与glypican-3表达的比较
Tab.2 Comparison of the expressions of MMP-9 and glypican-3 in control and observation groups detected by immunohistochemistry

组别例数MMP⁃9阳性[n(%)]表达评分(分)glypican⁃3阳性[n(%)]表达评分(分)肝癌组9746(47.42)1.95±1.6158(59.79)2.21±1.71对照组60005(8.33)0.83±1.23χ2或t值 7.8322.6225.3812.315P值 0.0070.0090.0210.026
2.2肝癌组MMP-9及glypican-3表达与临床特征的关系肝癌组的MMP-9及glypican-3的表达与性别、年龄、肿瘤直径、肝癌分化情况、有无肝癌癌栓不具有统计学相关性(表3,P>0.05)。
表3肝癌组MMP-9及glypican-3表达与临床特征的关系
Tab.3 Relation of MMP-9 and glypican-3 expressions with clinical characteristics in the observation group

临床特征例数MMP⁃9[n(%)]glypican⁃3[n(%)]性别 男8336(43.37)▲44(53.01)▲ 女148(57.14)11(78.57)年龄(岁) ≤502516(64.00)14(56.00)▲ >507220(27.78)43(59.72)肿瘤直径(cm) <58529(34.12)▲73(85.88) ≥5124(33.33)7(58.33)肿瘤分化 高5527(49.09)▲30(54.55)▲ 低4217(40.48)16(38.10)肝癌癌栓 无6430(46.88)▲26(40.63)▲ 有3314(42.42)12(36.36)甲胎蛋白 阳性7639(51.32)▲44(57.89)▲ 阴性218(38.10)13(61.90)
与同特征对应组比较,▲P>0.05。
3 讨 论
MMP-9属于基质金属蛋白酶的一种,对于由多糖和蛋白构成的细胞外基质会产生降解作用,使细胞正常部分遭受损害,因而有利于癌细胞的侵入、袭击和迁移[5]。而glypican-3可诱发肿瘤血管生成,并且还使血管通透性增加,进一步促进了肿瘤细胞转移到周边血管及组织中[6];同时glypican-3与肝癌的进展以及患者的预后显著相关。因此,glypican-3作为一种肝癌的标记物越来越受到关注。WANG等[7]的研究证实,在具有肝硬化背景的肝癌中,GPC3的阳性率接近90%,在高分化肝癌组织中GPC3阳性率达到48%,而在良性结节以及低分化肝癌组织中仅为3%。Meta分析显示,GPC3在接受肝癌检查的受试者中,曲线下面积(AUROC)达到0.928,甚至高于现有的肝癌标记物AFP的0.869[8]。glypican-3与MMP9之间的关联已有报道,如乳腺癌中外源性的TGF-β能够通过glypican-3调节MMP-9酶的活性[9];肝癌中GPC3基因高表达的患者癌症细胞EMT显著增强,同时,MMP-9作为EMT的标记物之一也有显著升高,而且GPC3与MMP9、β-catenin等EMT标记物之间的表达呈正相关[10]。总的来说,目前对于MMP-9与GPC-3之间的关联主要集中于对EMT作用的探讨,而MMP-9以及GPC-3的表达对肝癌的发生发展以及与已知的癌症标记物之间的关联则尚未有报道。
本研究的免疫组化结果中,细胞膜或者细胞质中出现棕黄色颗粒即认为MMP-9阳性细胞,随机选取5个视野,视野中阳性细胞的比例小于5%即认为样本为阴性。肝癌组患者的MMP-9阳性率和表达评分远远大于对照组(P<0.05)。对照组的MMP-9表达例数为0,即在非肝癌组织中基质金属蛋白酶-9不表达。有研究指出,MMP-9蛋白在很多恶性肿瘤组织中表达,参与了一些恶性肿瘤的形成[11]。本实验结果也表明了MMP-9蛋白在肝癌的形成、变化中有一定的作用;同时发现肝癌组患者的MMP-9表达与性别、年龄、肿瘤直径、肝癌分化情况、有无肝癌癌栓,不具有相关性(P>0.05)。可能的原因在于MMP-9在肝癌细胞的生长、侵袭和迁移过程中,以不同的方式、路径发挥着作用[12]。依据实验结果及MMP-9的特点,可以将其用做检测肝癌患者早期状况的指标,并且MMP-9指标的灵敏度、准确度较好。
肝癌组患者的glypican-3阳性率和表达评分明显高于对照组(P<0.05),对照组glypican-3阳性表达率为8.33%,虽有表达但低于肝癌组织。近来很多学者关注glypican-3与肿瘤的研究[13]。本研究发现,肝癌组患者的glypican-3表达与性别、年龄、肿瘤直径等特征不具有明显关系(P>0.05),说明glypican-3与肝癌的发生发展有关,而对于如何在肿瘤细胞的侵入迁移过程中发挥作用,尚存在疑问[14]。另外,本研究还发现了在高或中分化、低分化的不同病理分级中,glypican-3的表达不具有相关性(P>0.05),提示可能在肝癌细胞的增殖分化中,glypican-3作用较小[15]。
综上所述,MMP-9及glypican-3在肝癌组织中表达具有一定的临床病理价值。MMP-9可用做检测肝癌患者早期状况的指标,glypican-3在肝癌组织中高表达也有一定的检测意义。
参考文献:
[1] 孙燕,屠红,陆培新,等. 肝癌家族史与肝癌关系的20年前瞻性队列研究[J].中华肝脏病杂志, 2014, 22(10):752-756.
[2] WU Y, LIU H, WENG H, et al. Glypican-3 promotes epithelial-mesenchymal transition of hepatocellular carcinoma cells through ERK signaling pathway[J]. Int J Oncol, 2015, 46(3):1275-1285.
[3] AKUTSU N, YAMAMOTO H, SASAK S, et al. Association of glypican-3 expression with growth signaling molecules in hepatocellular carcinoma[J]. World J Gastroenterol, 2010, 28, 16(28):3521-3528.
[4] 胡建新,刘秀颀,李德民,等. 肝癌门静脉癌栓影像学分型与临床病理分型的对比研究[J]. 河北医药, 2015, 44(1):88-89.
[5] MEHNER C, HOCKLA A, MILLER E, et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer[J]. Oncotarget, 2014, 5(9):2736-2749.
[6] 陈会枝,李晨飞,王晓慧,等. 磷脂酰肌醇蛋白聚糖-3在食管鳞癌中的表达及临床意义[J]. 中华实验外科杂志, 2015, 32(10):2599-2601.
[7] WANG XY, DEGOS F, DUBOIS S, et al. Glypican-3 expression in hepatocellular tumors: diagnostic value for preneoplastic lesions and hepatocellular carcinomas[J]. Hum Pathol, 2006, 37(11):1435-1441.
[8] HUSSEIN TD. Serological tumor markers of hepatocellular carcinoma: A meta-analysis[J]. Int J Biol Markers,2015, 24, 30(1):e32-42.
[9] QI XH, WU D, CUI HX, et al. Silencing of the glypican-3 gene affects the biological behavior of human hepatocellular carcinoma cells[J]. Mol Med Rep, 2014, 10(6):3177-3184.
[10] LIU Y, ZHENG D, LIU M, et al. Downregulation of glypican-3 expression increases migration, invasion, and tumorigenicity of human ovarian cancer cells[J]. Tumour Biol, 2015, 36(10):7997-8006.
[11] 赵旭,胡卫列,聂奇伟,等. 肾上腺皮质肿瘤中E-cadherin、MMP-2及MMP-9的表达及意义[J]. 广东医学, 2016,37(23):3527-3530.
[12] HUANG D, LIU D, SUN M, et al. Expression of matrix metalloproteinase -9 and phosphatidylinositol proteoglycan-3 in primary hepatocellular carcinoma (HCC)[J]. Chin J Exp Surg, 2016, 33(9):2200-2202.
[13] 刘爱玲,田芝奥,王欣霖,等. 精氨酸酶-1、肝细胞抗原和磷脂酰肌醇蛋白聚糖-3的表达在肝癌中的意义[J]. 中西医结合肝病杂志, 2015, 25(5):310-311.
[14] 夏丽洁,张富春. 肝癌治疗新靶点GPC3研究进展[J]. 中国药理学通报, 2016, 32(11):1486-1489.
[15] YU C, HUANG H, YANG SL et al. Meta analysis of the diagnostic value of combined detection of phosphatidylinositol proteoglycan-3 and AFP in primary liver cancer[J]. Chin J Hepatobiliary Surg, 2014, 20 (8):566-571.
