盐酸法舒地尔对脂多糖诱导的大鼠血管内皮功能障碍的影响
2018-04-24卢迎宏翟关群王梦超员小利井海云
王 丹,卢迎宏,翟关群,王梦超,员小利,井海云
(郑州大学附属郑州中心医院:1. 心血管内科五病区;2. 心血管内科一病区,河南郑州 450052)
血管内皮细胞是一种单层多角形或扁平细胞,分布在血管腔内表面,多种血管活性物质长期与血管内皮细胞接触,可影响其功能[1]。既往研究显示,多种疾病与血管内皮细胞损伤和功能紊乱具有十分紧密的关系,如高血压、冠心病、动脉粥样硬化、糖尿病、脑梗死等,其中动脉粥样硬化作为一种慢性炎症反应过程,血管内皮细胞是首先受损伤的细胞之一[2-3]。脂多糖(LPS)是一种强烈的炎症启动因子,可导致全身炎症反应的发生,直接或间接激活并损伤内皮细胞,导致内皮细胞凋亡、通透性增加、细胞骨架重排等,最终改变血管内皮细胞形态和功能,引发内皮细胞功能障碍,发生动脉粥样硬化[4]。研究显示,Rho A/Rho激酶(ROCK)信号通路参与了LPS诱导的动脉粥样硬化过程[5]。作为唯一一种在临床上应用的Rho激酶抑制剂,盐酸法舒地尔(HF)具有抗动脉粥样硬化的作用,但其是否具有改善血管内皮功能障碍的作用,相关报道还十分有限。鉴于此,本研究通过构建LPS诱导的血管内皮功能障碍大鼠模型,分析HF对血管内皮功能障碍的影响及可能的机制。
1 材料与方法
1.1实验动物及分组清洁级雄性SD大鼠80只,体质量180~220 g,购于上海实验动物中心。采用随机数字表法将SD大鼠分为:正常对照组、模型组和实验A组、实验B组,每组20只。
1.2主要试剂HF注射液(山西普德药业股份有限公司);LPS(美国Sigma公司);全蛋白提取试剂盒(碧云天生物技术研究所);Western一抗稀释液(碧云天生物技术研究所);Western 二抗稀释液(碧云天生物技术研究所);Cx43一抗、Cav-1一抗、eNOS一抗、RhoA一抗和ROCK1一抗(美国Epitomics公司);β-actin一抗(Santa Cruz公司);辣根过氧化物酶标记的二抗(江苏碧云天公司);BCA蛋白定量试剂盒(北京鼎国昌盛生物技术有限责任公司);RT-PCR试剂盒(大连宝生物公司);其他试剂均为分析纯国产试剂。
1.3主要仪器超净工作台(AIRTECH,苏州净化设备有限公司);精密电子天平(Mettler Toled公司);紫外分光光度计(Nano Drop公司);酶标仪(Thermo公司);RT-PCR仪(Biometra 公司);双垂直蛋白电泳仪(北京市六一仪器厂)。
1.4动物模型的构建及干预参考文献[6]方法,实验A组、实验B组和模型组尾静脉注射LPS(1 mg/kg)建立大鼠内皮功能障碍模型。0.5 h后,实验A组和实验B组分别腹腔注射10 mg/kg和30 mg/kg HF,模型组和对照组分别注射等量9 g/L生理盐水。连续4周,每天按上述方法注射1次。
1.5取材麻醉(100 g/L水合氯醛)后处死各组大鼠,大鼠取仰卧位固定于超净工作台内,剪下大鼠的胸主动脉,去除血管表面的结缔组织和脂肪组织,用双蒸水充分洗净血管内血液,一部分储存于-80 ℃冰箱中,一部分多聚甲醛固定过夜,石蜡包埋。
1.6TUNEL法检测细胞凋亡取石蜡包埋主动脉组织,冰冻切片采用TUNEL进行细胞凋亡检测,严格按TUNEL检测试剂盒说明书操作。显微镜下红色荧光为TUNEL阳性细胞,随机选取6个不重复高倍视野(×200),计算阳性细胞凋亡指数(AI)。计算公式为:AI=(凋亡细胞数/总细胞数)×100%。
1.7RT-PCR检测Cx43、Cav-1、eNOS、RhoA和ROCK1的mRNA表达取-80 ℃主动脉组织,Trizol法分别提取各组总RNA。总RNA采用纯化柱纯化。逆转录得cDNA,引物设计:β-actin上游引物,5′-AGGCATCCTGACCCTGAAGTA-3′,下游引物,5′-GAGGCATACAGGGACAACACAG-3′;Cx43上游引物,5′-GCTCCACTCTCGCCTATGTC-3′,下游引物,5′-TAGTTCGCCCAGTTTTGCTC-3′;Cav-1上游引物,5′-CGCCATTCTCTTTCCTGC-3′,下游引物,5′-AGACGGTGTGGACGTAGA-3′;eNOS上游引物,5′-CTGCGGGTACGAAGGTATCG-3′,下游引物,5′-AGCATCCAATCCATCCAGCA-3′;RhoA上游引物,5′-GATGGAGCTTGTGGTAAGA-3′,下游引物,5′-AAACTATCAGGGCTGTCG-3′;ROCK1上游引物,5′-GGTGATGGCTATTATGGACG-3′,下游引物,5′-GTGTCTCGGAGCGTTTCC-3′。逆转录为cDNA,应用RT-PCR检测Cx43、Cav-1、eNOS、RhoA和ROCK1 mRNA转录水平。以β-actin作为内参照,同一标本的β-actin产物表达水平校正各自目的基因的表达水平,相对表达水平=目的基因表达水平/β-actin表达水平。
1.8Westernblot检测Cx43、Cav-1、eNOS、RhoA和ROCK1蛋白表达取-80 ℃主动脉组织,用预冷的组织裂解液提取总蛋白,Bradford法测定样品的蛋白含量,120 g/L的凝胶分离蛋白质,利用转膜仪(湿转)在100 V 1.5 h的条件下将凝胶上的蛋白转移到PVDF膜上,脱脂奶粉封闭2 h,洗膜后与稀释的Cx43、Cav-1、eNOS、RhoA和ROCK1单克隆抗体(1∶1 000)过夜结合,洗膜后加入稀释的二抗,室温孵育60 min,BeyoECL Plus显色,凝胶成像和化学发光分析系统收集显色条带,运用 Quantity One 软件进行蛋白条带数据分析。
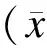
2 结 果
2.1各组大鼠的细胞凋亡情况模型组、实验A组和实验B组内皮细胞凋亡指数显著高于对照组(P<0.05);实验A组和实验B组内皮细胞凋亡指数显著低于模型组(P<0.05);实验B组内皮细胞凋亡指数显著低于实验A组(P<0.05,图1)。
2.2各组大鼠Cx43、Cav-1、eNOS、RhoA、ROCK1mRNA的表达水平模型组Cx43、Cav-1、RhoA和ROCK1 mRNA表达水平显著高于对照组(P<0.05),eNOS mRNA表达水平显著低于对照组(P<0.05);实验A组和实验B组Cx43、Cav-1、RhoA、ROCK1和eNOS mRNA表达水平显著低于对照组(P<0.05);实验A组和实验B组Cx43、Cav-1、RhoA和ROCK1 mRNA表达水平显著低于模型组(P<0.05),eNOS mRNA表达水平显著高于模型组(P<0.05);实验B组Cx43、Cav-1、RhoA和ROCK1 mRNA表达水平显著低于实验A组(P<0.05),eNOS mRNA表达水平显著高于实验A组(P<0.05,图2)。
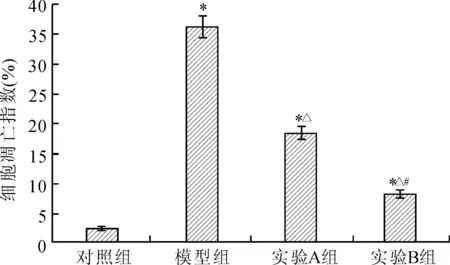
图1各组大鼠内皮细胞凋亡指数
Fig.1 Apoptosis index of endothelial cells in each group
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与实验A组比较,#P<0.05。

图2各组大鼠Cx43、Cav-1、RhoA、ROCK1和eNOSmRNA表达水平
Fig.2 mRNA expressions of Cx43, Cav-1, RhoA, ROCK1 and eNOS in each group
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与实验A组比较,#P<0.05。
2.3各组大鼠Cx43、Cav-1、RhoA、ROCK1和eNOS蛋白的表达水平模型组Cx43、Cav-1、RhoA和ROCK1蛋白表达水平显著高于对照组(P<0.05),模型组、实验A组和实验B组eNOS蛋白表达水平显著低于对照组(P<0.05);实验A组和实验B组Cx43、Cav-1、RhoA和ROCK1蛋白表达水平显著低于模型组(P<0.05),eNOS蛋白表达水平显著高于模型组(P<0.05);实验B组Cx43、Cav-1、RhoA和ROCK1蛋白表达水平显著低于实验A组(P<0.05),eNOS 蛋白表达水平显著高于实验A组(P<0.05,图3、图4)。
3 讨 论
血管内皮损伤和功能障碍在心血管疾病的发生发展过程中具有重要作用,因此,改善血管内皮功能障碍对于降低心血管疾病发病率和死亡率具有重要意义[7]。LPS是革兰氏阴性杆菌外膜上的一种糖蛋白,是一种炎症启动因子,可导致全身炎症反应[8]。研究表明,血管内皮细胞是LPS重要的效应细胞,LPS作用后可直接导致血管内皮细胞膜通透性增加,进而形成血管内皮损伤和功能障碍[9]。因此,LPS是建立血管内皮损伤和功能障碍动物模型的常用药物。

图3Westernblott结果图
Fig.3 Western blot results
1:模型组;2:实验B组;3:对照组;4:实验A组。

图4各组大鼠Cx43、Cav-1、eNOS、RhoA和ROCK1蛋白表达水平
Fig.4 The protein expression levels of Cx43, Cav-1, eNOS, RhoA and ROCK1 in each group
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与实验A组比较,#P<0.05。
本研究采用LPS诱导建立血管内皮损伤和功能障碍大鼠模型,采用HF进行干预。数据显示,模型组、实验A组和实验B组内皮细胞凋亡指数显著高于对照组(P<0.05);实验A组和实验B组内皮细胞凋亡指数显著低于模型组(P<0.05);实验B组内皮细胞凋亡指数显著低于实验A组(P<0.05),表明LPS成功诱导建立了血管内皮损伤和功能障碍大鼠模型,HF干预后有助于减少内皮细胞凋亡,且呈剂量依赖性。
RhoA/Rho激酶信号转导通路被证实在动脉粥样硬化过程中起重要作用,RhoA/Rho激酶信号转导通过引发血管内皮功能障碍和氧化应激发生,促进细胞凋亡[10]。ROCK是小G蛋白RhoA的主要效应因子,其表达水平上调可促进氧化应激、炎症反应和细胞纤维化,其表达水平降低可介导肌动蛋白重组、血管平滑肌细胞收缩和细胞粘附等多种生理功能[11]。ROCK参与内皮细胞功能障碍的调节过程,在动脉粥样硬化和细胞、器官损伤中起重要作用[12]。HF是一种Rho激酶抑制剂和细胞内钙离子拮抗剂,可显著抑制RhoA/Rho激酶信号转导通路,降低ROCK1表达水平,减轻其对血管内皮功能的损伤程度,降低血管内皮细胞凋亡程度[13]。实验表明,HF作用于LPS诱导的血管内皮功能障碍大鼠模型,Cx43、Cav-1、RhoA和ROCK1 mRNA和蛋白水平显著下降。Cx43是缝隙连接蛋白家族中的重要成员,主要由血管内皮细胞和平滑肌细胞表达,其在动脉粥样硬化发展过程中表达明显上调[14]。Cav-1是一种小窝蛋白,广泛表达于血管内皮细胞中,在动脉粥样硬化早期可能参与低密度脂蛋白的转运和炎症反应过程[15]。因此,HF可能通过RhoA/Rho激酶信号转导通路,抑制RhoA和ROCK1的表达,从而抑制Cx43、Cav-1的表达,发挥抗凋亡效应。
一氧化氮也参与了血管衰老过程,其主要由一氧化氮合成酶合成,其中eNOS是一氧化氮合成酶三种类型中的一种。本组数据显示,模型组、实验A组和实验B组eNOS 蛋白表达水平显著低于对照组(P<0.05);实验A组和实验B组eNOS蛋白表达水平显著高于模型组(P<0.05);实验B组eNOS蛋白表达水平显著高于实验A组(P<0.05),表明HF可提高eNOS表达水平,发挥对血管内皮的保护作用。研究证实,Cav-1与eNOS蛋白存在一定的相互作用,Cav-1对eNOS有负性调节作用,其表达水平上升,可降低eNOS表达水平,导致血管内皮功能障碍[16]。因此,HF对血管内皮功能障碍的改善作用途径之间可能存在一定的交叉作用。
综上所述,HF可能通过RhoA/Rho激酶信号转导通路,抑制RhoA和ROCK1的表达,从而抑制Cx43、Cav-1的表达;可能通过提高eNOS表达水平,发挥改善血管内皮功能障碍的功能。
参考文献:
[1] TORIMOTO K, OKADA Y, MORI H, et al. Relationship between fluctuations in glucose levels measured by continuous glucose monitoring and vascular endothelial dysfunction in type 2 diabetes mellitus[J]. Cardiovasc Diabetol, 2013, 12(1):1.
[2] XIE K, WANG W, CHEN H, et al. Hydrogen-rich medium attenuated lipopolysaccharide-induced monocyte-endothelial cell adhesion and vascular endothelial permeability via Rho-associated coiled-coil protein kinase[J]. Shock, 2015, 44(1):58-64.
[3] JOSHI AD, DIMITROPOULOU C, THANGJAM G, et al. Heat shock protein 90 inhibitors prevent LPS-induced endothelial barrier dysfunction by disrupting RhoA signaling[J]. Am J Resp Cell Mol, 2014, 50(1):170-179.
[4] 李南南,张军平,仲爱芹,等. RhoA/ROCK 信号通路在动脉粥样硬化发生中的作用[J]. 基础医学与临床, 2014, 34(10):1422-1425.
[5] 李伟,周乐. 脂多糖诱导血管内皮细胞骨架重构中RhoA/ROCK通路的作用及中药干预[J]. 世界中西医结合杂志, 2014, 9(12):1359-1363.
[6] 马文东,袁媛,杨奕,等. TGF-β1介导的RhoA/ROCK通路在大鼠肺肌成纤维细胞分化中的调节作用[J]. 中国病理生理杂志, 2013, 29(10):1758-1763.
[8] LI C, ZHANG WJ, FREI B. Quercetin inhibits LPS-induced adhesion molecule expression and oxidant production in human aortic endothelial cells by p38-mediated Nrf2 activation and antioxidant enzyme induction[J]. Redox Bio, 2016, 16(9):104-113.
[9] BARABUTIS N, DIMITROPOULOU C, BIRMPAS C, et al. P53 protects against LPS-induced lung endothelial barrier dysfunction[J]. Am J Physiol-Lung C, 2015, 308(8):L776-L787.
[10] LI Y, LIU H, XU QS, et al. Chitosan oligosaccharides block LPS-induced O-GlcNAcylation of NF-κB and endothelial inflammatory response[J]. Carbohyd Polym, 2014, 99(6): 568-578.
[11] 张成果. 盐酸法舒地尔对维持性血液透析患者血管内皮功能的保护作用[J]. 实用医学杂志, 2014, 30(21):3499-3502.
[12] 韩佳寅,易艳,梁爱华,等. Rho/ROCK信号通路研究进展[J]. 药学学报, 2016, 51(6):853-859.
[13] 闫莹,杨朝,汪涛. 活性氧与RhoA/ROCK信号通路对血管平滑肌细胞钙浓度及钙敏感性的影响[J]. 国际呼吸杂志, 2015, 35(12):954-957.
[14] 张浩,刘小贤,刘庆华,等. RhoA-Rock信号通路在转化生长因子β1诱导大鼠腹膜间皮细胞转分化中的作用[J]. 中华肾脏病杂志, 2009, 25(2):128-133.
[15] GEVAERT T, VANSTREELS E, DAELEMANS D, et al. Identification of different phenotypes of interstitial cells in the upper and deep lamina propria of the human bladder dome[J]. J Urology, 2014, 192(5):1555-1563.
[16] 王勇,靳利艳,王留义. 不同剂量培哚普利对原发性高血压病患者血管内皮功能及血压变异性的影响研究[J]. 中国全科医学, 2016, 19(26):3160-3164.
