miR-126修饰的间质干细胞来源的外泌体对大鼠早期缺血性股骨头坏死的影响
2018-04-24周山健李海乐肖大伟田大川刘丹平
周山健,李海乐,肖大伟,田大川,刘丹平
(1. 锦州医科大学附属第一医院关节外科,辽宁锦州 121001;2. 漯河市中心医院创伤骨科,河南漯河 462000)
股骨头坏死是长期或大剂量使用类固醇皮质激素治疗诸多疾病后的严重并发症之一,其发病机制可能是类固醇皮质激素导致股骨头区血管内血栓形成和血管外髓内脂质沉积,并最终造成血供的破坏,进而诱发局部缺血和骨细胞死亡,并演进为软骨下骨的崩解[1-2]。目前,软骨下骨损坏后的唯一有效治疗方法为髋关节置换,但对于年轻患者而言,其植入假体的耐久性调查结果并不乐观[3]。因此,针对软骨下骨崩解前的干预性治疗显得尤为重要。近年来,干细胞移植疗法在促进血管再生方面显示出巨大的应用前景,但潜在的免疫排斥和染色体变异特性限制了其在临床中的发展[4-5]。最新研究发现,源于干细胞的外泌体包含多种蛋白质、信使核糖核酸(messenger ribonucleic acid, mRNA)及微小核糖核酸(micro-ribonucleic acid, miRNA)等,在促进血管生成方面有一定效果,且不会出现排斥反应和染色体变异[6]。然而,间充质干细胞来源的外泌体(MSC-Exos)中促血管成分含量较少。全基因组和基因分析结果显示,微小核糖核酸-126(miR-126)在血管再生方面效果显著[7]。因此,可利用miR-126质粒转染MSCs,获得miR-126高含量的MSC-126-Exos。目前,尚未见相关文献报道利用MSC-126-Exos治疗大鼠SANFH。本研究拟通过观察MSC-126-Exos对人脐静脉内皮细胞(HUVEC)增殖、迁移和成管以及成血管相关基因表达的影响,以及在体实验观察股骨头坏死区的血管新生和骨密度,评估MSC-126-Exos对大鼠SANFH的治疗作用。
1 材料与方法
1.1实验动物6周龄雄性SD大鼠由锦州医科大学SPF级实验动物中心提供,按照光照和黑暗每12 h 交替的环境中标准饲养,用于MSCs分离培养、SANFH动物模型建立及外泌体注射治疗。所有实验大鼠符合卫生部一级动物标准,并通过动物伦理学委员会批准。
1.2主要试剂及仪器胎牛血清(FBS)和Opti-MEM、L-DMEM培养基、DMEM/F12培养基(Gibco美国),Ficoll液(天津市灏洋生物制品科技有限责任公司),micrONTMmiRNA mimic(广州市锐博生物科技有限公司),mirVana miRNA 分离试剂盒(Ambion美国),miScript反转录试剂盒和miScript SYBR Green PCR试剂盒(QIAGEN德国),MTT和DiL(Sigma美国),BCA蛋白定量试剂盒和ECL显影液(上海碧云天生物技术公司),Matrigel基质胶(BD美国),甲泼尼龙(MPS, Pfizer美国),脂多糖、小鼠抗大鼠CD9、CD63、CD81抗体和HRP偶联的山羊抗小鼠抗体(Absci美国),DAPI、小鼠抗大鼠血管内皮生长因子A(VEGFA)抗体、小鼠抗β-actin抗体、兔抗大鼠-CD31抗体和Alexa-Fluor 647-结合羊抗兔抗体(Abcam英国)。Hitachi H-7650透射电镜和超高速离心机(HITACHI日本),蛋白凝胶分离和转膜系统(Bio-Rad美国),蛋白发光显影仪(OMEGA美国),倒置荧光显微镜(Olympus日本),Micro-CT扫描仪(SCANCO Medical AG瑞士)。
1.3细胞培养参照文献[7]方法提取大鼠原代MSCs,接种于含100 mL/L FBS、100 U/mL青霉素、100 U/mL链霉素的L-DMEM培养基中,置于37 ℃、50 mL/L CO2恒温培养箱培养。
HUVEC购自ATCC,实验室传代后使用,含100 mL/L FBS+100 U/mL青霉素+100 U/mL链霉素的DMEM/F12完全培养基置于37 ℃、50 mL/L CO2恒温培养箱常规培养。
1.4外泌体的提取及鉴定[8]用去除外泌体的L-DMEM完全培养基培养MSCs 48 h后,将上清4 ℃ 7 400 r/min离心30 min去除细胞碎片后,再置入超离管以4 ℃、29 700 r/min离心2 h,PBS重悬提取外泌体并于-80 ℃保存备用。
进一步应用Western blot法检测外泌体特异性蛋白CD9(1)、CD63和CD81表达。用透射电镜观察外泌体形态。取5 μL提取悬液于镍碳合金网上静置10 min后置于室温风干箱中风干,取出后以草酸铀负染液负染10 min,PBS反复洗膜5次,室温干燥后电压80 kV透射电镜下观察。
1.5HUVECs摄取外泌体将提取好的MSC-Exos用DiL标记。取对数生长期的HUVECs消化离心后接种于6孔板,待细胞生长融合至70%,将所获DiL标记的MSC-Exos与HUVECs共孵育4 h[10],PBS冲洗后,40 g/L多聚甲醛固定,DAPI染核,以倒置荧光显微镜观察。
1.6miR-126的转染及qRT-PCR检测MSCs培养传至第3代,取融合度50%左右细胞,用Opti-MEM、Lipofectamine 2000试剂将30 nmol/L micrONTMmiRNA mimic转染至MSCs内,继续培养48 h后,进行后续实验。按照mirVana miRNA分离试剂盒操作步骤,分离所提纯MSC-Exos和MSC-126-Exos中的miR-126,cDNA合成使用miScript反转录试剂盒[9]。miR-126引物序列为5′-ACACTCCAGCTGGGTCGTACCGTGAGTAAT-3′和5′-TGG-TGTCGTGGAGTCG-3′,使用miR-126引物和miScript SYBR Green PCR试剂盒进行实时荧光定量PCR检测。将U6作为其内参,其序列为5′-CTCGCTTCGGCAGCACA-3′和5′-AACGCTTC-ACGAATTTGCGT-3′。miR-126的相对表达应用2-ΔΔCT进行计算。
1.7体外实验检测MSC-126-Exos对HUVECs的影响分别以80 mg/L MSC-126-Exos、80 mg/L MSC-Exos以及含有相同体积 PBS的DMEM/F12完全培养基处理作为实验组、对照组和空白组。
MTT实验检测HUVECs细胞增殖,使用酶标仪在490 nm波长下进行检测获取吸光度值。
细胞划痕实验用于检测MSC-126-Exos对HUVECs迁移的影响,于倒置荧光显微镜下进行观察划痕变化,细胞迁移率=(0 h划痕的平均边距-24 h划痕的平均边距)/0 h划痕的平均边距×100%。
HUVECs的成管实验[10]检测MSC-126-Exos对HUVECs毛细血管网形成的影响,倒置显微镜下观察成管情况,选取5个随机视野中分支点的数目作为成管的效果指标。Western blot法检测HUVECs中VEGFA的表达水平,所得结果采用Image-J进行分析。
1.8大鼠SANFH模型的建立及分组选取6周龄雄性SD大鼠18只,静脉注射10 μg/kg脂多糖和肌肉注射20 mg/kg甲泼尼龙,构建大鼠SANFH模型[11]。将其随机分为3组:模型组(每周尾静脉注射200 μL PBS)、MSC-Exos组(每周尾静脉注射200 μg MSC-Exos)和MSC-126-Exos组(每周尾静脉注射200 μg MSC-126-Exos)。注射后分笼饲养,并每天使其自由活动以运动髋关节。6周后,将所有SD大鼠麻醉后处死并取股骨头以备检测。
1.9免疫荧光分析股骨头区血管密度各组大鼠单侧股骨头标本进行脱钙、石蜡包埋并切片,常规操作进行抗原修复、50 mL/L山羊血清封闭后,一抗(CD31 1∶200)4 ℃孵育过夜,PBS冲洗3次后,荧光二抗(1∶500)暗盒室温孵育30 min,用DAPI染细胞核,在荧光显微镜下观察分析,随机选取各组切片镜下视野,血管新生通过CD31染色阳性的典型圆形或椭圆形结构的数目进行估量。
1.10Micro-CT扫描检测股骨头骨质各组大鼠单侧股骨头标本取出后,进行中性甲醛(100 mL/L甲醛)固定过夜,次日PBS清洗后,置于Mircro-CT扫描仪进行检测[11]。设定扫描仪的分辨率为每像素14.8 μm。骨小梁从骨髓中分离后,分析骨质评估值:小梁厚度(trabecular thickness, Tb.Th)、小梁分离度(trabecular separation, Tb.Sp)、小梁数(trabecular number, Tb.N)和每组织体积骨量(bone volume per tissue volume, BV/TV),并在图片查看器Evaluation中选取每个样本的冠状面和横断面作为骨修复的大体观。
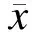
2 结 果
2.1MSCs外泌体的鉴定和HUVECs摄取情况分析应用透射电镜扫描提纯的MSC-Exos,其形态大多为杯形或圆形结构,且直径在40~100 nm范围之间(图1A)。Western blot结果显示,MSC-Exos表达特异性的外泌体表面蛋白CD9、CD63和CD81(图1C)。倒置荧光显微镜下观察DiL标记的MSC-Exos被HUVECs摄取,且其主要集中在细胞核附近(图1B)。

图1MSCs外泌体(MSC-Exos)的鉴定和HUVECs摄取情况
Fig.1 Identification and analysis of MSC-Exos and uptake by HUVECs
A:透射电镜观察外泌体的形态(×50 000);B:HUVECs细胞摄取外泌体(×400);C:Western blot检测外泌体CD9、CD63和CD81蛋白的表达。
2.2MSCs外泌体中miR-126的相对含量外泌体中miR-126实时荧光定量PCR检测结果显示,MSC-126-Exos中的miR-126相对含量(0.85±0.03)显著高于MSC-Exos组(0.25±0.05),且差异有统计学意义(P<0.05,图2)。
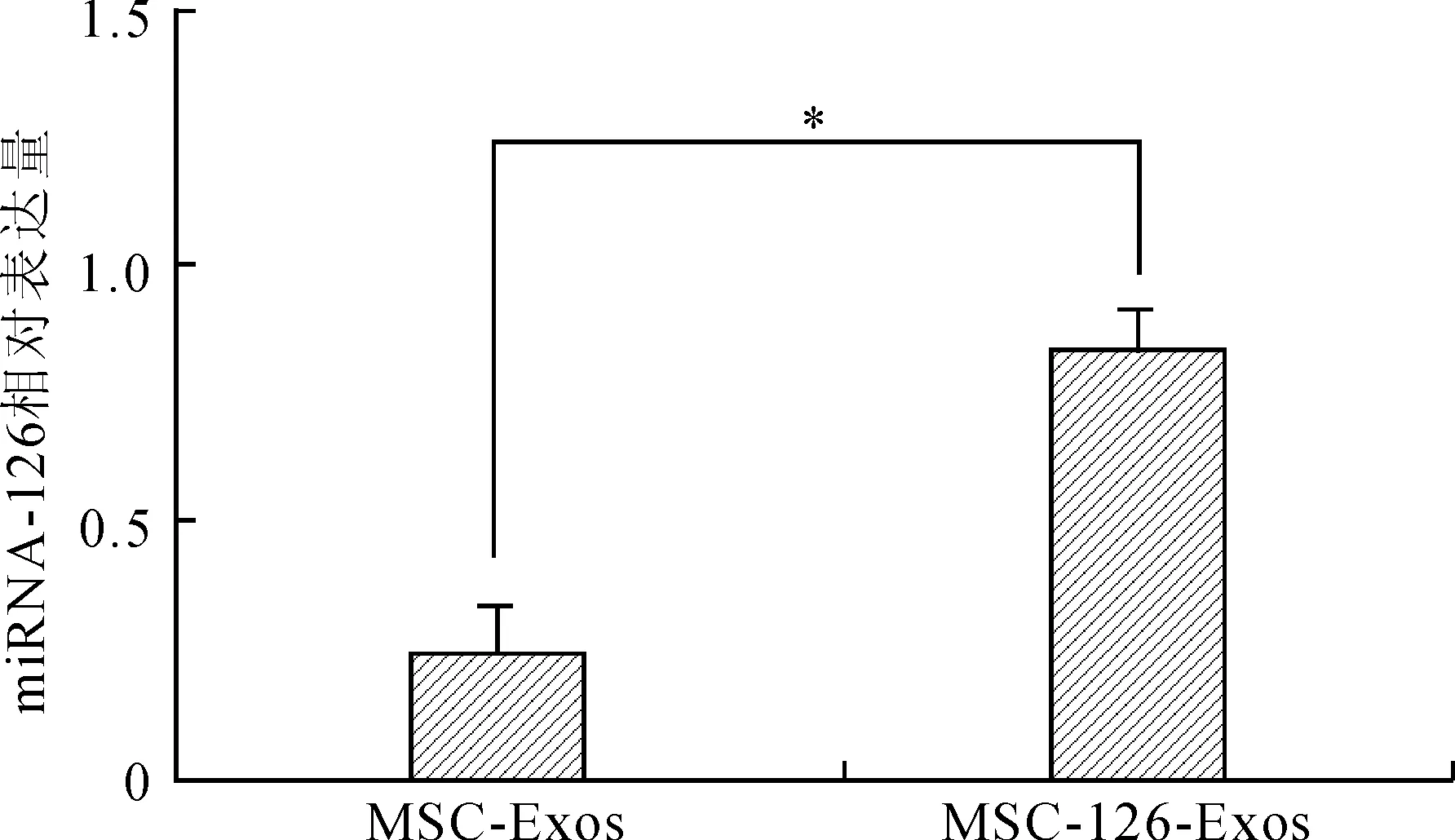
图2实时荧光定量PCR检测MSC-126-Exos和MSC-Exos中miR-126的相对含量
Fig.2 The relative content of miR-126 in MSC-126-Exos and MSC-Exos detected by RT-qPCR
2.3MSC-126-Exos促进HUVECs增殖、迁移和成管MTT结果显示,实验组HUVECs 24 h时的增殖率显著高于对照组,差异具有统计学意义(P<0.05,表1)。划痕实验结果显示,实验组HUVECs在24 h时的迁移度较对照组和空白组明显(图3),差异有统计学意义(P<0.05,表1)。应用3D-Matrigel评估MSC-126-Exos对HUVECs成管的作用,结果显示HUVECs在3组实验中均能形成毛细血管样结构,但在空白组生成的管样结构较少,4 h时实验组较对照组成管的长度和分支数量多(图4A~C),且有明显差异(P<0.05),且显著多于空白组,差异有统计学意义(P<0.05,表1)。8 h时实验组成管的数量也较对照组和空白组显著增多(图4D~F),且差异有统计学意义(P<0.05,表1)。
2.4各组HUVECs中VEGFA的表达水平Western blot检测结果显示,MSC-126-Exos和MSC-Exos刺激HUVECs时,实验组和对照组HUVECs中VEGFA的表达均较空白组显著,且实验组又显著强于对照组,组间比较差异有统计学意义(P<0.05,图5,表1)。

图3划痕实验评估MSC-126-Exos对HUEVCs迁移的促进作用
Fig.3 Promotion of MSC-126-Exos in cell migration of HUEVCs detected by scratch test (×40)
A、D:实验组;B、E:对照组;C、F:空白组。
表1各组HUVECs在MTT实验中的增殖率、划痕实验中的迁移率、在成管实验中形成节点分支数目和VEGFA的表达水平
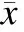

组别增殖率(%)迁移率(%)成管数量(n/field)4h8hVEGFA表达实验组0.93±0.03∗#85.08±4.05∗#57.67±2.52∗#88.00±5.57∗#0.80±0.04∗#对照组0.63±0.02∗63.34±3.23∗46.00±4.36∗58.67±3.51∗0.45±0.04∗空白组0.42±0.0143.76±2.7715.00±2.0029.00±3.610.16±0.03
与空白组比较,*P<0.05;与对照组比较,#P<0.05。

图4成管实验评估MSC-126-Exos对HUEVCs成管的促进作用
Fig.4 Promotion of MSC-126-Exos in tube formation of HUEVCs detected by tubule formation assay (×100)
A、D:实验组;B、E:对照组;C、F:空白组。
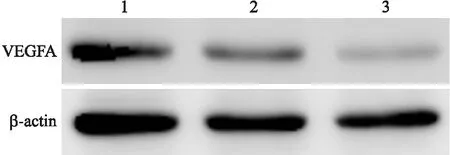
图5Westernblot检测各组HUVECs中VEFGA的表达
Fig.5 Expressions of VEGFA in HUVECs in various groups detected by Western blot
1:实验组;2:对照组;3:空白组。
2.5各组股骨头区的血管密度及小梁骨量变化间断注射外泌体治疗大鼠SANFH 6周后,通过股骨头标本的CD31免疫荧光染色计数微血管密度观察股骨头区的新生血管。结果显示,MSC-126-Exos组微血管呈近圆形满视野分布(图6A);MSC-Exos组相对较少,且血管直径也较大(图6B);模型组视野中出现极少血管(图6C)。统计分析各组随机视野中微血管密度,结果显示,MSC-126-Exos组微血管密度显著多于MSC-Exos组和模型组,且差异有统计学意义(P<0.05,表2)。
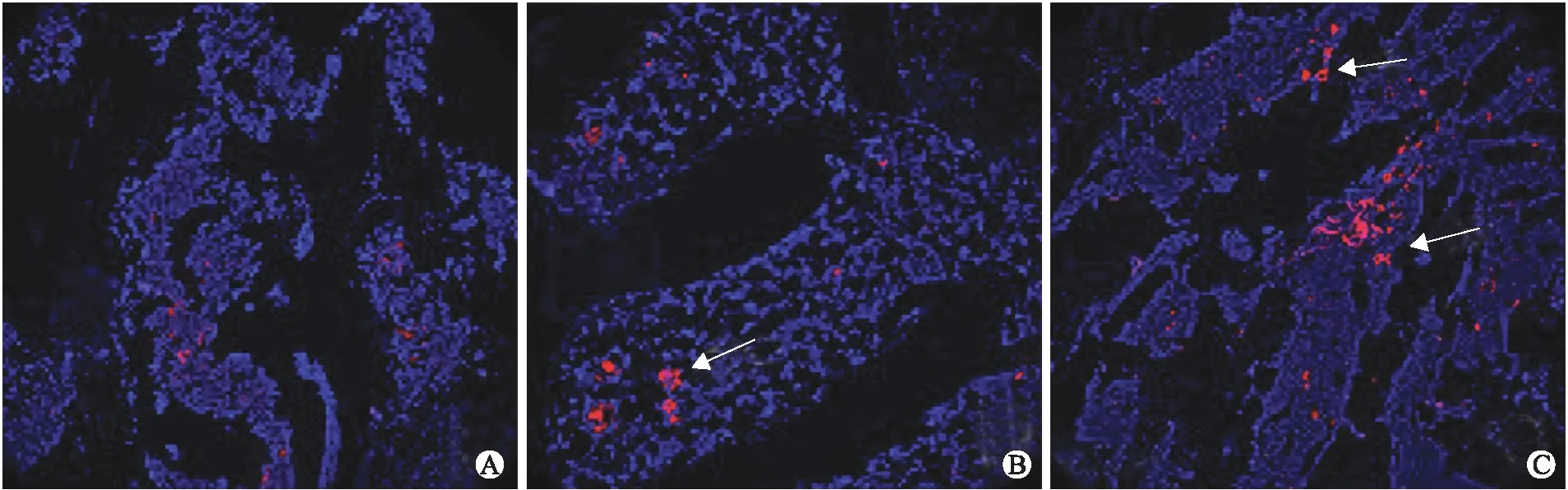
图6各组大鼠股骨头CD31标记的血管密度
Fig.6 The blood vessel density of the femoral head in rats in various groups (×100)
A:模型组;B:MSC-Exos组;C:MSC-126-Exos组。箭头所指红色荧光:CD31阳性结果。
MSC-126-Exos组和MSC-Exos组大鼠股骨头的Micro-CT扫描结果显示,冠状面表现为股骨头形态正常,股骨头区骨密度影正常,且MSC-126-Exos组较MSC-Exos组更为致密(图7B、C);横断面表现为骨小梁排列规则而连续,且MSC-126-Exos组的小梁厚度及密度大于MSC-Exos组(图7E、F)。模型组冠状面表现为股骨头形态尚可,但股骨头近端出现沿头缘透光区,内呈软组织密度,且靠近干骺端处骨小梁增粗硬化,并呈不规则排列(图7A);其横断面呈现骨小梁密度下降,形态扭曲,出现簇状或条索状分布且形态模糊(图7D)。骨质评估值分析结果表明:MSC-126-Exos组和MSC-Exos组显著高于模型组,且MSC-126-Exos组又较MSC-Exos组显著,差异具有统计学意义(P<0.05,表2)。
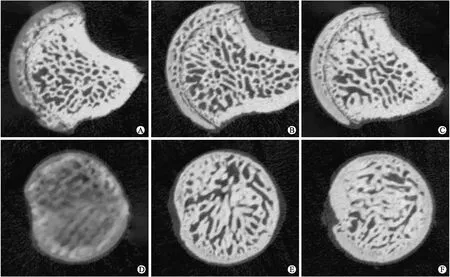
图7各组大鼠股骨头Micro-CT扫描成像
Fig.7 The Micro-CT scan imaging of the femoral head in rats in various groups
A、D:模型组;B、E:MSC-Exos组;C、F:MSC-126-Exos组。
表2各组大鼠股骨头坏死区CD31标记的血管密度及骨质评估值
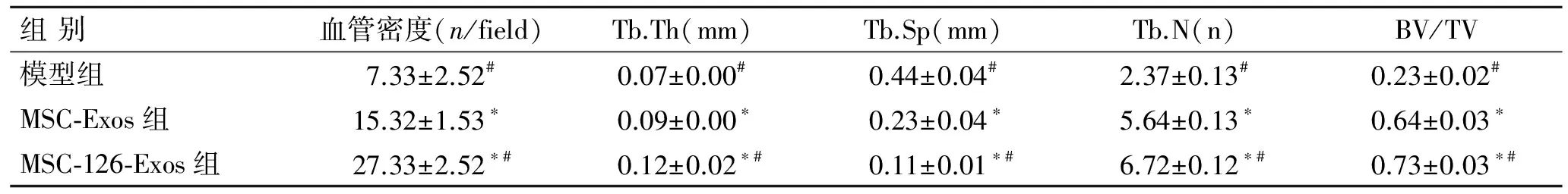
组别血管密度(n/field)Tb.Th(mm)Tb.Sp(mm)Tb.N(n)BV/TV模型组7.33±2.52#0.07±0.00#0.44±0.04#2.37±0.13#0.23±0.02#MSC⁃Exos组15.32±1.53∗0.09±0.00∗0.23±0.04∗5.64±0.13∗0.64±0.03∗MSC⁃126⁃Exos组27.33±2.52∗#0.12±0.02∗#0.11±0.01∗#6.72±0.12∗#0.73±0.03∗#
与模型组比较,*P<0.05;与100 mg/L MSC-Exos组比较,#P<0.05。
3 讨 论
激素性股骨头坏死是由于长期或大量使用类固醇激素造成的严重疾病,发病率有逐渐增高的趋势[12]。股骨头发生坏死后,不仅骨的结构遭到破坏,而且强度降低,导致较高的致残率,如果在早期阶段进行有效干预治疗,将可能终止坏死的进程,避免进一步发展导致股骨头塌陷。在股骨头坏死的早期阶段,小范围的坏死组织可以溶解吸收,通过促进骨再生和再骨化,形成骨性愈合[13]。而骨性愈合的过程高度依赖于血管的再生,新生的血管可以为成骨过程提供充足的氧气、营养物质以及所需的微环境[14]。因此,尽量在股骨头塌陷之前,通过改善骨坏死区的血供,促进骨修复和再生是针对早期股骨头坏死干预治疗的重点。
外泌体是细胞分泌的大小在40~100 nm之间的膜囊泡,通过负载多种具有生物活性的成分如miRNA等物质在细胞与细胞间的沟通中发挥重要作用[15-16]。实际上,外泌体已经被证实在促进皮肤损伤修复、急性肺损伤的保护以及肝纤维化的缓解等多种疾病模型中具有重要的治疗作用[16-18],大量报道显示,干细胞分泌的外泌体在促进血管新生方面具有很强的优势,被认为是一种调节血管新生的介质,如TENG等[19]证实,在心肌缺血性损伤中,MSCs分泌的外泌体能促进新生血管生成和抑制炎症反应而改善心功能。近年来,许多研究表明外泌体负载的miRNA可以通过调控内皮细胞增殖、迁移、凋亡影响血管生成[20-21],在促进和调控血管生成的过程中起重要作用[22-23]。miR-126是其中重要的miRNA之一,位于表皮生长样结构域蛋白7(epidermal growth factor like protein 7, Egfl-7)基因的内含子上,在内皮细胞上特异性表达[23]。大量研究报道miR-126与血管内皮细胞及血管功能密切相关。研究发现过表达miR-126能够激活VEGF依赖的信号通路,促进血管生成[24]。但是,MSC-Exos中促血管的miRNA含量有限,本研究利用构建过表达miRNA-126的MSCs,获得miR-126含量高的MSC-126-Exos。体外实验结果显示,实验组HUVECs的增殖率、迁移速度及4 h和8 h成管能力分别为对照组的1.5倍、1.3倍、1.3倍和1.5倍,同时VEGFA的表达为对照组的1.8倍。以上结果表明MSC-126-Exos较MSC-Exos具有更强的促成血管功能;动物实验也表明MSC-126-Exos对于股骨头坏死区的血管修复作用较MSC-Exos组更显著。
相关研究表明,骨坏死区域的血管生成对骨折修复有重要作用[25-26],且坏死区的血供可以直接影响骨痂形成[27]。本研究中MSC-126-Exos组股骨头Micro-CT扫描结果分析也显示,MSC-126-Exos组的Tb.Th、Tb.Sp、Tb.N和BV/TV值分别为MSC-Exos组的1.4倍、0.5倍、1.2倍和1.2倍,表明MSC-126-Exos在改善坏死股骨头区骨质方面的效果要强于MSC-Exos。因此,通过修饰MSCs使其外泌体中miRNA等含量或成分发生变化,充分发挥外泌体生物学作用,可为干细胞治疗和进一步临床应用提供新的思路。
参考文献:
[1] ATSUMI T, KUROKI Y. Role of impairment of blood supply of the femoral head in the pathogenesis of idiopathic osteonecrosis[J]. Clin Orthop Relat Res, 1992, 277(277):22-30.
[2] JONES JP. Fat embolism, intravascular coagulation, and osteonecrosis[J]. Clin Orthop Relat Res, 1993, 292(292):294-308.
[3] CHIU KH, SHEN WY, KO CK, et al. Osteonecrosis of the femoral head treated with cementless total hip arthroplasty. A comparison with other diagnoses[J]. J Arthroplasty, 1997, 12(6):683-688.
[4] AMARIGLIO N, HIRSHBERG A, SCHEITHAUER BW, et al. Donor-derived brain tumor following neural stem cell transplantation in an ataxia telangiectasia patient[J]. PLoS Med, 2009, 6(2):e1000029.
[5] HERBERTS CA, KWA MS, HERMSEN HP. Risk factors in the development of stem cell therapy[J]. J Transl Med, 2011, 9:29.
[6] MITCHELL A, FUJISAWA T, NEWBY D, et al. Vascular injury and repair: A potential target for cell therapies[J]. Future Cardiol, 2015, 11(1):45-60.
[7] 辛毅,刘小希,赵伟,等. 差速贴壁法分离兔骨髓源性间充质干细胞和内皮祖细胞及其生物学特性的研究[J]. 中国实验血液学杂志, 2013, 21(3):746-753.
[8] THÉRY C, AMIGORENA S, RAPOSO G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol, 2006, 3:22.
[9] CHENG HS, SIVACHANDRAN N, LAU A, et al. MicroRNA-146 represses endothelial activation by inhibiting pro-inflammatory pathways[J]. EMBO Mol Med, 2013, 5(7):949-966.
[10] GUO SC, TAO SC, YIN WJ, et al. Exosomes from human synovial-derived mesenchymal stem cells prevent glucocorticoid-induced osteonecrosis of the femoral head in the rat[J]. Int J Biol Sci, 2016, 12(10):1262-1272.
[11] ZHANG C, MA J, LI M, et al. Repair effect of coexpression of the hVEGF and hBMP genes via an adeno-associated virus vector in a rabbit model of early steroid-induced avascular necrosis of the femoral head[J]. Transl Res, 2015, 166(3):269-280.
[12] SUN Y, FENG Y, ZHANG C, et al. Beneficial effect of autologous transplantation of endothelial progenitor cells on steroid-induced femoral head osteonecrosis in rabbits[J]. Cell transplantation, 2011, 20:233-243.
[13] 石少辉,李子荣. 血管生成在缺血性股骨头坏死修复中的作用[J]. 中华全科医学杂志, 2007, 6(8):479-481.
[14] KLEINHEINZ J, STRATMANN U, JOOS U, et al. VEGF-activated angiogenesis during bone regeneration[J]. J Oral Maxillofac Surg, 2005, 63:1310-1316.
[15] XIN H, LI Y, CHOPP M. Exosomes/miRNAs as mediating cell-based therapy of stroke[J]. Front Cell Neurosci, 2014, 8:377.
[16] BIAN S, ZHANG L, DUAN L, et al. Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model[J]. J Mol Med (Berl), 2014, 92(4):387-397.
[17] XIN H, LI Y, CUI Y, et al. Systemic administration of exosomes released from mesenchymal stromal cells promote functional recovery and neurovascular plasticity after stroke in rats[J]. J Cereb Blood Flow Metab, 2013, 33(11):1711-1715.
[18] ZHANG J, GUAN J, NIU X, et al. Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angoigenesis[J]. J Transl Med, 2015,13:49.
[19] TENG X, CHEN L, CHEN W, et al. Mesenchymal stem cell-derived exosomes improve the microenvironment of infarcted myocardium contributing to angiogenesis and anti-inflammation[J]. Cell Physiol Biochem, 2015, 37(6):2415-2424.
[20] SUAREZ Y, SESSA WC. MicroRNAs as novel regulation of angiogenesis[J]. Circ Res, 2009, 104(6):442-454.
[21] BONAUER A, BOON RA. DIMMELER S. Vascular microRNAs[J]. Current Drug Targets, 2010, 11(8):943-949.
[22] LATRONICO MV, CATALUCCI D, CONDORELLI G. Emerging role of microRNAs in cardiovascular biology[J]. Circ Res, 2007, 101(12):1225-1236.
[23] CORDES KR, SRIVASTAVA D. MicroRNA regulation of cardiovascular development[J]. Circ Res, 2009, 104(6):724-732.
[24] NICOLI S, STANDLEY C, WALKER P, et al. MicroRNA-mediated integration of haemodynamics and Vegf signalling during angiogenesis[J]. Nature, 2010, 464(7292):1196-1200.
[25] GERSTENFELD LC, CULLINANE DM, BARNES GL, et al. Fracture healing as a post-natal developmental process: molecular, spatial, and temporal aspects of its regulation[J]. J Cell Biochem, 2003, 88(5):873-884.
[26] AI-AQL ZS, ALAGL AS, GRAVES DT, et al. Molecular mechanisms controlling bone formation during fracture healing and distraction osteogenesis[J]. J Dent Res, 2008, 87(2):107-118.
[27] CHOI IH, AHN JH, CHUNG CY, et al. Vascular proliferation and blood supply during distraction osteogenesis: A scanning electron microscopic observation[J]. J Orthop Res, 2000, 18(5):698-705.
