中药健脾方对糖尿病大鼠肾组织骨桥蛋白及肾脏病理的影响
2018-04-24邢艳阳李中南邢宇婷窦德梅
邢艳阳,李中南,邢宇婷,窦德梅
(1.安徽中医药大学,合肥 230038;2.安徽中医药大学第一附属医院)
糖尿病肾病(DKD)是糖尿病(DM)常见的严重慢性并发症之一,20%~40%的糖尿病患者发展成慢性肾脏病,是糖尿病患者肾衰竭的主要原因[1]。骨桥蛋白(OPN)是一种具有细胞粘附和迁移功能的分泌型磷酸化糖蛋白,可作为肾小管间质的一种重要趋化因子,通过介导该部位的巨噬细胞浸润、蛋白尿漏出、肾小球硬化等机制促进DKD的发生与发展[2]。降低糖尿病肾病骨桥蛋白的表达,抑制巨噬细胞驱化,改善早期肾脏病变程度,是延缓糖尿病肾损害的一个新途径[3]。本次实验旨在研究中药健脾方对糖尿病大鼠肾组织OPN的表达及对肾脏病理的影响,分析讨论健脾活血中药对肾脏的调节机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 取正常雄性大鼠50只,体质量(190±20)g,由安徽医科大学动物实验中心供应,合格证号:0001841。饲养房空气流通,温度维持在18~25 ℃,相对湿度保持在40%~70%,动物自由进食和饮水,适应性饲养1周。
1.1.2 药物与试剂 中药健脾方由黄芪20 g、山药15 g、白术10 g、茯苓10 g、生地10 g、丹参15 g、菝葜15 g、地龙10 g、五味子5 g、黄连10 g组成,饮片由安徽中医药大学第一附属医院中药房提供;盐酸吡咯列酮(杭州中美华东制药有限公司生产,批号:H20050500);链脲佐菌素(STZ)(购自美国Sigma公司,批号:S0130);水合氯醛(青岛宇龙海藻有限公司生产,批号:H3702673);通用型二抗试剂盒(购自北京中杉金桥生物技术有限公司,批号:131208K)。
1.1.3 主要仪器与设备 血糖监测仪(美国强生公司,型号:稳豪型);JD801形态学图像分析系统(江苏省捷达科技发展有限公司);全自动生化仪(日本株式会社,型号:日立 7600)。
1.2 实验干预与分组 将50只健康雄性大鼠予基础饲料(蛋白质16%,碳水化合物50%,脂肪8%)饲喂1周,随机抽取10只作为健康对照组,其余大鼠作实验组。对照组予基础饲料饲喂至本实验终止;实验组予高脂饲料(其中蛋白质15%,脂肪25%,碳水化合物45%,胆固醇5%,猪油10%)喂养,4周后造模,禁食8 h后,将STZ用0.1 mol/L的柠檬酸-柠檬酸钠缓冲液(pH值为4.4)配成2%浓度,按35 mg/kg剂量于大鼠左下腹一次性腹腔注射,120 h后取鼠尾静脉测血糖,血糖≥16.7 mmol/L视为造模成功。将造模失败的5只大鼠剔去,成模的45只大鼠随机分成模型组11只,中药组12只,吡格列酮组12只。按人与鼠的单位体质量折算系数算出各组的药用剂量,其中中药组按3 g·kg-1·d-1予健脾方灌胃,吡格列酮组按10 mg·kg-1·d-1灌胃,健康对照组和模型组按5 mL·kg-1·d-1予0.9%氯化钠溶液灌胃,各组持续饲喂8周直至本实验完成。
1.3 指标检测与方法 连续灌胃,分别在第2、4周末测定各组大鼠血糖并记录,8周末测定血糖及血脂[低密度脂蛋白-胆固醇(LDL-C)、三酰甘油(TG)、总胆固醇(TC)],禁食不禁水8 h,再以3%水合氯醛按10 mg/kg给大鼠腹腔注射麻醉,迅速分离双肾,将新鲜组织放在冻存管内,并保存于液氮中,按免疫组织化学法操作标准完成。采取JD801形态分析系统分析肾组织OPN的表达图,以阳性面积及平均吸光度来表示OPN的表达强度。高倍镜(×400)下观察并记录切片中肾组织不重叠视野下的阳性细胞数。病理切片采取HE染色法,光镜下观察并比较肾组织病理学变化程度。

2 结果
实验期间模型组、吡格列酮组、中药组因血糖过高各死亡1只,两药物组因大鼠打斗各死亡1只。
2.1 各组大鼠肾组织OPN的比较 高倍镜观察显示:正常组大鼠OPN在肾组织中未见明显表达;模型组OPN的表达较正常组显著升高,多呈强阳性,尤其以肾小管与肾间质细胞中较明显;与模型组对比,中药组、吡格列酮组大鼠肾组织中OPN的表达有不同程度的下降,多呈弱阳性,差异较为明显。
与健康对照组相比,模型组大鼠肾组织OPN的阳性面积、平均吸光度及阳性细胞数均明显增高(P<0.01);与模型组相比,中药组和吡咯列酮组OPN阳性面积、平均吸光度、阳性细胞数显著降低(P<0.01或P<0.05),差异有统计学意义。见图1,表1。
2.2 各组大鼠肾组织病理学的改变 光镜观察显示:正常组大鼠肾组织形态规则,肾小球结构完整,基底膜较薄,肾小管形态完整清晰,未见炎性细胞浸润。同正常组比较,模型组大鼠肾组织形态欠规则,毛细血管袢结构不清晰,肾小球体积显著增大,可见肾小球囊腔增大、结构不规整,基底膜增厚,肾小管部分萎缩、部分扩张,间质血管有不同程度的增生,细胞外基质明显增多,肾间质内可见大量的炎性细胞浸润。同模型组比较,中药组、吡格列酮组大鼠肾组织病变有不同程度的改善,肾小球结构清晰、规则,基膜增厚减轻,可见部分肾小球体积增大,肾小管腔轻度扩张,肾小球内的细胞数目稍增多,细胞外基质增多降低,肾间质内见少许的炎性细胞浸润。见图2。
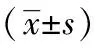
表1 各组大鼠肾组织中OPN阳性面积、平均吸光度、阳性细胞数的比较
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05
2.3 各组大鼠血糖、血脂的比较 与正常组相比,模型组各时段血糖、血脂(TG、TC、LDL-C)水平明显升高(P<0.01);与模型组相比,中药组和吡格列酮组血糖及血脂水平显著降低(P<0.01)。见表2,3。
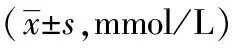
表2 各组大鼠血脂的比较
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01
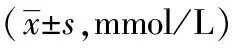
表3 各组大鼠不同时段血糖的比较
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01
3 讨论
目前多数学者认为DKD的发病机制为糖脂代谢紊乱、遗传易患性、氧化应激、炎性反应等多种因素共同作用,导致细胞外基质增多、基膜变厚、微血管病变、肾组织纤维化等病理变化[4]。研究发现,OPN大量表达于肾脏及骨骼中,肾组织中OPN可由肾小管上皮细胞合成、分泌,高糖可诱导OPN合成增加[5]。肾组织OPN进一步介入到巨噬细胞趋化、蛋白尿渗出及肾小球硬化等多个环节,促使DKD的发生与发展。故早期阻断肾组织中OPN的表达,对DKD的治疗有重要意义[6-7]。
本次实验注意到模型组大鼠肾组织OPN的表达明显增加,多呈强阳性。中药组大鼠肾组织OPN的表达显著下降,多数不表达或呈弱阳性表达。同时,提示模型组大鼠肾组织OPN的阳性面积、平均吸光度、阳性细胞数目均显著增加;中药组和吡咯列酮组上述指标明显下降,表明中药健脾方可显著抑制OPN的表达。肾脏病理结果提示,模型组大鼠肾脏受损较为严重,予中药健脾方治疗后大鼠肾组织病变明显减轻,提示本方可减轻糖尿病大鼠肾脏病理损伤,对肾脏早期损伤具有良好的保护作用。同时实验结果显示出模型组大鼠的血糖、TC、TG等水平显著增高,予中药健脾方后大鼠的血糖、血脂水平较模型组明显降低。分析本方的作用机制,可能是通过减少炎性因子的刺激,减轻糖脂毒性对内皮细胞功能的损害,进而降低肾组织OPN的高表达,减缓肾脏的病理损害,抑制DKD的进展。
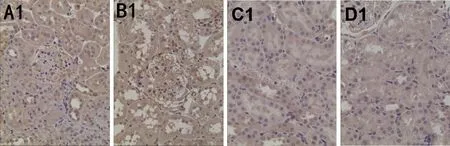
A1:健康对照组;B1:模型组;C1:中药组;D1:吡格列酮组
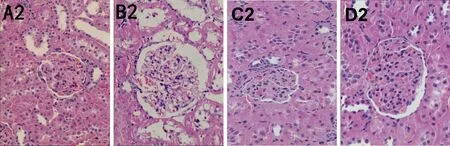
A2:健康对照组;B2:模型组;C2:中药组;D2:吡格列酮组
近几年,课题组从临床调查入手,发现糖尿病肾病患者中脾虚血瘀型增多。如名老中医曹恩泽主任认为,脾肾亏虚是DKD的病理基础,瘀血是DKD发病的重要病理因素[8]。糖尿病肾病虽病本在肾,但与脾胃关系密切。祖国医学认为,脾胃为乃后天之本,气血生化之源;肾是先天之本,为精血之海,生命之根[9-10]。脾肾二脏在生理上相互滋生,在病理上亦互为因果,彼此影响。同时,“久病入络”“久病致瘀”,瘀血阻络贯穿着DKD的始终,既是DKD的病理产物,又可作为其致病因素。故治疗糖尿病肾病应注意调养脾肾,活血化瘀。本实验选择健脾益气活血方符合临床实际。方中黄芪、白术、茯苓益气健脾利湿,山药健脾补肾,养胃生津;生地清热凉血,滋肾养阴;黄连清热燥湿解毒;丹参活血祛瘀,五味子滋肾生津,菝葜健脾利湿解毒,地龙活血通络、捜剔驱邪。诸药合用,达到健脾补肾,益气活血之效,全方阴阳互济,攻补兼施,扶正祛邪,使机体阴阳平,瘀浊去,肾络通。
药理研究证实,丹参、黄芪等能够降低血糖和改善胰岛素抵抗(IR)[11-12];黄芪甲苷能够修复高糖诱导的平滑肌细胞和内皮细胞的功能障碍,故能在一定程度上保护糖尿病血管重构[13],且黄芪通过减少肾脏局部TGF-β1、OPN的表达和巨噬细胞驱化,减轻组织损伤,保护肾脏功能,对患者整体起着矫正蛋白质及脂质代谢紊乱的作用;丹参可明显下调肾脏OPN的合成与分泌[14];黄连中的小檗碱能增强胰岛素的敏感性,且能下调血清中游离脂肪酸,改善大鼠的高糖高脂状态,调节胰岛素分泌及改善IR[15]。山药多糖对胰岛细胞起到保护和修复作用,并能降低胰高血糖素的水平,使胰岛素的分泌增加[16];白术能够减轻四氧嘧啶损害胰岛B细胞,或能改善胰岛B细胞功能,达到降糖效果[17];茯苓多糖能显著升高2型糖尿病小鼠肾脏中超氧化物岐化酶及谷胱甘肽过氧化物酶的水平,减少丙二醛的含量,增强肾组织的抗氧化能力,降低脂质过氧化,改善自由基所致氧化损伤,抑制T2DM小鼠肾脏中Bax基因的表达,进而减缓肾组织细胞凋亡趋势,保护肾脏[18];地龙能改善DKD患者的脂质代谢紊乱,保护内皮细胞,清除氧自由基,降低过氧化脂质水平[19];生地黄、北五味子可增强抗氧化能力、加速自由基的清除[20]。菝葜提取物对于小鼠蛋清致足肿、醋酸致腹膜炎等有良好的抗炎、消肿作用,大大降低炎症部位的炎症介质,并有不同程度的免疫调节作用[21]。
综上所述,中药健脾方可能是通过多环节、多靶点提高机体免疫功能,减少炎性反应,清除氧自由基,改善血液高粘、高聚状态,抑制糖尿病肾脏病理炎症状态,调节糖脂代谢紊乱,降低肾脏骨桥蛋白的高表达,从而起到延缓糖尿病肾脏损伤,保护肾脏功能的作用。
[1] 纪立农,陈莉明,郭晓蕙,等.中国慢性疾病防治基层医生诊疗手册(糖尿病分册)2015年版[J].中国糖尿病杂志,2015,23(8):673-701.
[2] 刘丹,吴红艳.骨桥蛋白在糖尿病肾病中作用的研究进展[J].安徽医药,2016,20(10):1832-1835.
[3] 张筠,王建平,臧丽,等.吡格列酮对2型糖尿病肾病患者骨桥蛋白和尿微量清蛋白的影响[J].实用医学杂志,2012,28(16):2772-2774.
[4] 王凤梅,蒋克国,张桂霞,等.高糖激活PI3K/AKT/Mtorc1通路诱导人肾小管上皮细胞骨桥蛋白的表达[J].中国药理学通报,2014,30(8):1156-1160.
[5] 崔京男,崔海月.冬虫夏草对糖尿病大鼠肾组织骨桥蛋白表达的影响[J].中华中医药学刊,2010,28(12):2635-2637.
[6] 张宁,李全民.糖尿病肾病患者血清骨桥蛋白检测的临床意义[J].中国医学工程,2012,20(5):86-87.
[7] 邓蓉蓉,沈婕,张丽丽,等.骨桥蛋白与糖尿病肾脏疾病的相关性研究进展[J].国际泌尿系统杂志,2014,33(2):283-285.
[8] 王亿平,王翠萍.曹恩泽治疗糖尿病肾病经验[J].中医药临床杂志,2013,25(4):298-300.
[9] 汪健,李中南.益气养阴活血方联合前列地尔治疗糖尿病肾病[J].中国临床保健杂志,2004,7(4):252-253.
[10] 孙文娟,王敏.肾炎康复片联合前列地尔改善糖尿病肾病患者血液微循环的效果[J].中国临床保健杂志,2016,19(6):602-605.
[11] 李娜,胡正芳,江振洲,等.中药抗糖尿病研究进展[J].药学与临床研究,2011,19(4):343-347.
[12] 刘颖,陆付耳,黄光英.丹参对HepG2细胞胰岛素抵抗状态的影响[J].医药导报,2008,27(3):265-267.
[13] 欧阳静萍,王念,张德玲,等.黄芪多糖抑制2型糖尿病大鼠肝脏PTP1B的表达改善胰岛素抵抗的机制[J].中国动脉硬化杂志,2009,17(7):569-570.
[14] 刘虹彬,温进坤,韩梅.丹参对血管平滑肌细胞基质金属蛋白酶和骨桥蛋白基因表达及细胞增殖的影响[J].中国中西医结合杂志,2002,22(10):764-766.
[15] 殷峻,陈名道,唐金凤,等.小檗碱对实验大鼠糖脂代谢的影响[J].中华糖尿病杂志,2004,12(3):215-218.
[16] 杨宏莉,张宏馨,李兰会,等.山药多糖对2型糖尿病大鼠降糖机制的研究[J].河北农业大学学报,2010,33(3):100-103.
[17] 单俊杰,田庚元.白术糖复合物AMP-B的理化性质及降血糖活性的研究[J].药学学报,2003,38(6):438-441.
[18] 黄聪亮,郑佳俐,李凤林,等.茯苓多糖对2型糖尿病小鼠肾组织抗氧化能力及Bax、Bcl-2蛋白表达影响[J].食品与生物技术学报,2016,35(1):82-88.
[19] 马艳春,周波,宋立群,等.地龙有效成分对糖尿病肾脏疾病患者血脂、脂质过氧化反应的影响[J].中国临床保健杂志,2012,15(1):53-54.
[20] 戴卫波,梅全喜,李乐愚.中药组方治疗糖尿病药理作用研究进展[J].世界中医药,2016,11(6):1122-1125.
[21] 李苏翠,舒孝顺,杨祥良.菝葜根茎活性部位的抗炎作用及其对环氧化酶活性影响的研究[J].亚太传统医药,2009,5(7):16-21.
