医疗器械与血液相互作用试验
——体外血小板计数新方法的建立
2018-04-24乔春霞侯丽赵增琳屈秋锦褚祥宇董传俊魏振西展荣凯
乔春霞 侯丽 赵增琳 屈秋锦 褚祥宇 董传俊 魏振西 展荣凯
1 国家食品药品监督管理局济南医疗器械质量监督检验中心 (山东 济南 250101)
2 山东恒信检测技术开发中心 (山东 济南 250101)
ISO10993.4/GB/T16886.4[1]指出与血液接触的医疗器械进行血液相容性评价时,需要对一些器械对血小板和血小板功能的影响进行评价。ISO 10993-4:2017(E)[2]中对血小板激活试验的选择进行了调整,推荐试验为血小板计数和激活指示剂的测定或血小板形态学测定。针对血小板计数的具体检测方法,目前可参考的标准是ASTM F2888-2013[3],此标准中采用的体外血小板计数方法是采用枸橼酸钠的抗凝人全血进行的,推荐的阳性对照材料是黑橡胶和天然胶乳,要求与材料接触后的全血中的血小板计数值要小于空白全血血小板计数值的50%。但是经过笔者选用多种黑橡胶和天然胶乳试验发现在此试验体系下,黑橡胶和天然胶乳对于全血中血小板计数值的影响并不能达到标准要求。因此对ASTM F2888-2013的试验体系进行了改进,选择几种容易获得的材料用于筛选符合要求的阳性对照材料,为能准确评价医疗器械血小板性能评价提供数据支持。
1.材料、试剂和仪器
1.1 材料
阴性对照:聚乙烯(日本HRI);阳性对照:黑橡胶(Fisher Scienti fi c);玻璃珠(Sigma);丁腈手套(石家庄鸿瑞集团);橡胶手套(诗董橡胶股份有限公司)。
1.2 试剂
柠檬酸钠抗凝的采血管(3.2%,0.109M,上海科华检验医学产品有限公司);EDTA二钠(国药集团化学试剂有限公司),配制成500mmol/L浓度;氯化钙(国药集团化学试剂有限公司),配制成1M浓度;肝素钠(Sigma),配制成200U/mL。
1.3 仪器
本试验使用的仪器主要有水浴摇床(1092型,德国GFL公司),全自动血液分析仪(日本株式会社,XT-2000i型)。
2.方法
2.1 制备样品
试验分为4组,每组有5种材料,每种材料平行制备3管,每管12cm2。将材料剪成小块置于聚丙烯试管中,以保证能与1mL血液最大程度接触。每组平行制备3管未接触材料的全血作为空白对照。同时,为了研究试验体系的稳定性,本研究重复进行了3次试验。
2.2 试验前准备
静脉采集新鲜人全血,枸橼酸钠抗凝,混匀后置于冰上保存备用。
2.3 试验步骤
枸橼酸钠抗凝全血组:每支试管中加入0.9%氯化钠注射液预湿试管中的样品,室温静置30s,移除所有0.9%氯化钠注射液后,每支试管中加入全血1mL。
含枸橼酸钠、氯化钙和肝素钠溶液全血组:将剩余的全血分为3组,按每1mL血液中加入0.01mL氯化钙溶液的比例,在抗凝全血中加入氯化钙溶液,使其终浓度为10mmol/L。每组全血分别加入适量的200U/mL的肝素钠溶液,使其终浓度分别为0.5U/mL、1.0U/mL和2.0U/mL。按上文步骤每支试管中加入调整后的全血。
所 有 试 管 在(37±1)˚C的 水 浴 中 震 荡 孵 育(60±5)min,转速为60rpm。孵育后,每支试管中加入EDTA(500mmol/L)0.01mL,使其终浓度为5mmol/L来终止反应。用血液分析仪进行血小板计数。
2.4 结果计算
分别计算3管阴性对照、阳性对照和空白对照的血小板计数平均值。按下式计算阴性对照和阳性对照与空白对照相比的百分比:

式中:A=阴性对照/阳性对照血小板计数平均值,B=空白对照的血小板计数平均值,C=与空白对照相比的百分比(%)。
2.5 试验有效性
空白对照组血液应在正常成人血小板计数范围内,即(100~300)×109/L范围内。
空白对照、阴性对照和阳性对照3个读数的每一个值应在(读数均值±20%)区间内。
阴性对照的血小板读数的接受准则为空白对照的80%~120%范围内。阳性对照的血小板值与空白对照相比的百分数值应小于50%。
3.结果
空白对照、阴性对照和阳性对照的3个读数的每一个值均在(读数均值±20%)区间内。
3次试验空白对照组血小板计数值均在正常成人血小板计数范围内,即(100~300)×109/L。
阴性对照和阳性对照与空白对照相比的百分比见图1、图2和图3。枸橼酸钠抗凝全血组血小板计数结果显示所有的阳性对照材料血小板计数值均大于空白对照的50%,因此该试验体系不能满足检测要求。
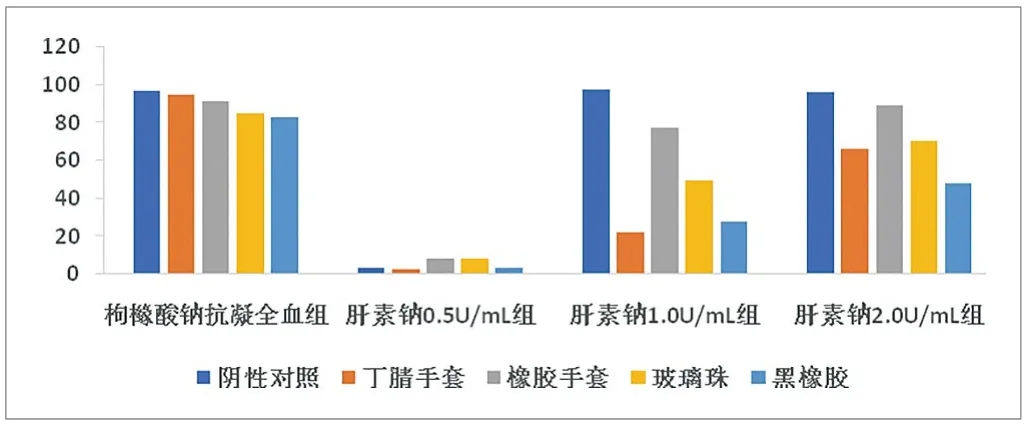
图1. 第一次试验结果(C值,%)
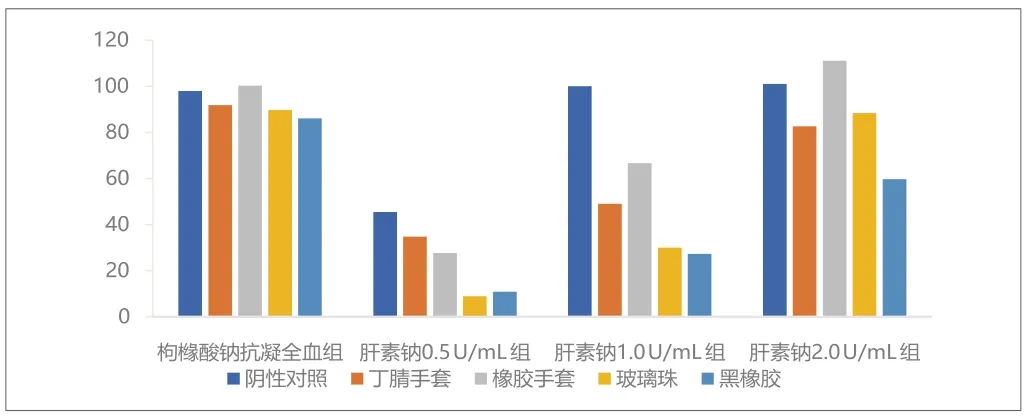
图2. 第二次试验结果(C值,%)
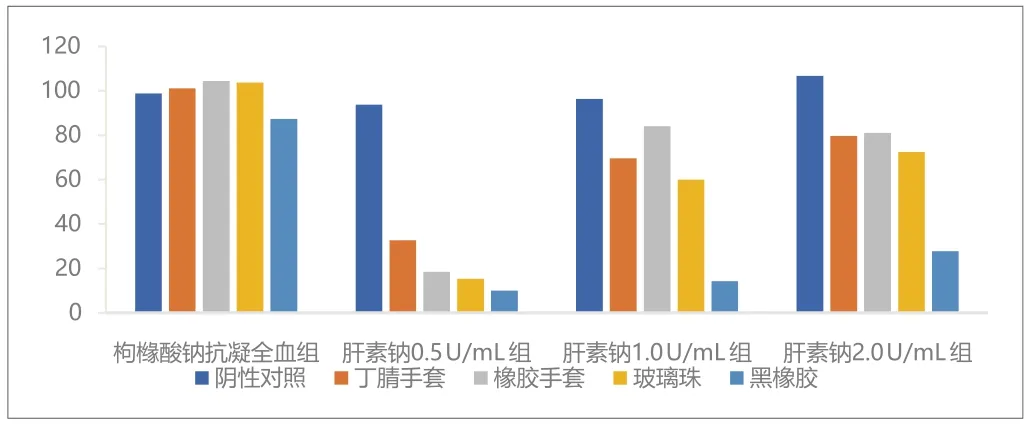
图3. 第三次试验结果(C值,%)
加入氯化钙和肝素钠溶液后的全血与材料接触后3次试验结果显示:
肝素钠浓度为0.5U/mL时,除了第三次试验的阴性对照血小板计数值为空白对照93.7%外,其余试验所有试管均发生凝血。按照上文的判断依据,第三次试验符合要求。
肝素钠浓度为1.0U/mL时,按照上文的判断依据,阴性对照符合要求。三次试验黑橡胶的血小板计数值均低于空白对照的50%。丁腈手套和玻璃珠在第一次和第二次试验中符合要求。橡胶手套在三次试验中均降低但没有超过空白对照的50%。因此黑橡胶符合阳性对照的要求,而其他阳性材料则反应不一致。
肝素钠浓度为2.0U/mL时,按照上文的判断依据,阴性对照符合要求。只有黑橡胶在第一次和第三次试验时符合要求。其他材料的小板计数值降低均不明显。综合判断,肝素钠浓度为2.0U/mL时,不适宜用于检测接触医疗器械后全血的血小板计数。
4.讨论
体外检测血小板激活需要考虑两个重要的问题:减少自发的血小板激活需要采用静脉穿刺采血,血液需抗凝防止凝血,同时要保持血小板的活化状态直至检测[4]。多个研究发现,不同的抗凝剂对血小板数量及血小板功能的检测有不同的影响[5-8]。按照ASTM F2888-2013的要求,血小板计数采用的体系是枸橼酸钠抗凝的人全血,许多研究者也优先采用枸橼酸钠抗凝的全血进行血小板研究,主要是因为枸橼酸钠同EDTA相比能较少引起血小板的自发激活[5]。本研究发现按照此标准的试验体系,与阳性对照材料接触后的血液中的血小板数量没有明显减少,因此,不适用于进行医疗器械与血小板相互作用的评价。在此试验体系的基础上,本次研究对试验体系进行了改进,使血液处于轻度抗凝状态,利于血小板的激活。
本研究发现采用相同的试验材料在不同的时间进行试验得到的肝素钠的最佳浓度不同,可能的原因是血液不同,保存期限内的试剂浓度的变化等。有研究证实,在血液中加入一些试剂可以使血小板的物理和生化状态保持在某一特殊时间点,从而减少血小板的自发激活,接触后的血液可以放置较长时间[4,6,9,10]。本试验中的EDTA即具有终止反应的作用。血小板的消耗通常受到血液接触表面积的影响,因此医疗器械的表面积会影响血小板计数的结果。为了使试验样品的结果与对照相比具有最大差异化,本研究与ASTM F2888-2013保持一致,医疗器械表面积与血液体积的比例为12cm2:1mL。
尽管本研究建立的试验体系还存在着一些缺陷,但总的来说适用于体外测试医疗器械与血小板间的相互作用,黑橡胶可以作为阳性对照用于检测。医疗器械对血小板的影响,除计数外还需要考虑其他方面如材料表面黏附、激活和血小板表面活化分子表达等,此体系是否适用于这些检测,还需要进一步研究。另外,因为人血来源有限,兔血是否使用于此体系,也是下一步需要研究的内容。
[1] GB/T16886.4-2003:《医疗器械生物学评价第4部分:与血液相互作用试验选择》[S].2003-08-13.
[2] ISO 10993-4:2017 (E):Biological evaluation of medical devices––Part 4:Selection of tests for interactions with blood[S].2017-4.
[3] ASTM F2888-2013:Standard Test Method for Platelet Leukocyte Count- An In-Vitro Measure for Hemocompatibility Assessment of Cardiovascular Materials[S].2013.
[4] Macey M, Azam U, McCarthy D, et al. Evaluation of the anticoagulants EDTA and citrate, theophylline, adenosine, and dipyridamole( CTAD) for assessing platelet activation on the ADVIA 120 hematology system[J].Clin Chem.,2002,48(6 Pt 1):891-899.
[5] Golanski J, Pietrucha T, Baj Z, et al. Molecular insights into the anticoagulant- induced spontaneous activation of platelets in whole blood— various anticoagulants are not equal[J].Thromb Res.,1996,83(3):199-216.
[6] Muriithi EW, Belcher PR, Menys VC, et al. Quantitative detection of platelet aggregates in whole blood without fi xation[J].Platelets,2000,11(1):33-37.
[7] 詹彤,万学兴.三种抗凝剂对全血血小板计数的影响[J].临床输血与检验.2001,3(3):38-39.
[8] Lazarus AH, Semple JW, Freedman J. Preanalytical requirements for fl ow cytometric evaluation of platelet activation: choice of anticoagulant. Transfus Med.,1999,9(2):147-154.
[9] Hu H, Daleskog M, Li N. In fl uences of fi xatives on fl ow cytometric measurements of platelet P-selectin expression and fi brinogen binding[J].Thromb Res.,2000,100(3):161-166.
[10] Schmidt V, Hilberg T. ThromboFix platelet stabilizer: advances in clinical platelet analyses by fl ow cytometry?[J].Platelets,2006,17(4):266-273.