3D打印技术在气道管理中的应用进展*
2018-04-24刘凯茜综述审校
刘凯茜 综述 王 军 审校
(北京大学第三医院麻醉科,北京 100191)
3D打印技术在我国医疗行业的应用始于20世纪80年代,最初主要用于立体医疗模型的制造。随着精准化医疗和个性化医疗的发展,3D打印技术在医疗行业的应用日趋广泛,从立体模型、手术器械到活体移植组织、人体器官,3D打印技术逐步成熟完善并在医疗领域占据重要的地位。气道管理作为围术期重要的管理项目之一始终备受关注,3D打印技术的出现可以将气道管理可视化、个体化,因此,其应用空间和发展前景十分广阔。本文对3D打印技术在气道管理中的应用进行文献总结。
1 3D 打印技术用于气道评估
目前,3D打印技术在气道管理方面应用最多的是用于术前准备阶段的气道评估。临床常用的气道评估方法主要有Mallampati分级、喉镜检查、测量甲颏距离及张口度、观察颈部活动度等方法,这些方法成本低、迅速便利,但缺陷在于无法全面、直观地掌握患者气道情况,特别是对于有困难气道的患者,尽管可以预测出发生困难气道,但仍不能做到精准的定位和具体情况分析。3D打印技术很好地弥补上述缺陷,通过患者气道的CT、MRI和超声等检查结果模拟重建呼吸道3D模型,还原真实气道结构(图1),直观地了解患者气道解剖异常及通气功能受限的病因。利用选择性激光烧结(selective laser sintering,SLS)和立体平板印刷打印机,在Amira、3Diagnosys、Ondemand 3D(上呼吸道重建)、OsiriX、Mimics、BrainLab(下呼吸道)等软件包的支持下进行个体化气道重建[1],还原气道及毗邻结构,尤其是因甲状腺、食管、颈椎、纵隔等毗邻结构解剖异常带来的气道结构改变,最大限度地了解患者气道解剖结构。
近年来,3D打印技术在产科和儿科患者气道评估方面应用较多,产前超声检查可发现具有先天性气道缺陷和颌面发育异常的胎儿,基于其超声影像制出胎儿气道的3D打印模型可清晰发现解剖结构异常,用于预测和制定气道管理方案以及气道重建方案[2]。2015年Wilson 等[3]应用3D打印模型了解1例小儿患者的气道实际尺寸,以此选择合适的通气设备施行单肺通气,该模型使麻醉医生能够术前了解患儿气道的实际情况,选择恰当的主气管和支气管的气管导管。上海儿童医院应用3D打印技术对婴幼儿气道狭窄纠正手术的评估,显著提高手术治疗成功率,自2015 年至今,该医院心脏中心小儿气管狭窄的手术治疗成功率已接近90%[4]。对于有先天性心脏病的患者特别是小儿患者而言,术前详细了解气道和脉管系统的关系至关重要,3D打印技术可以很好地显示心房、心室、大血管与气管、支气管、支气管树之间的解剖关系(图2),完善心胸外等大手术的术前准备,制定最合理的手术方案[5]。
除用于婴幼儿的气道评估和治疗,3D打印技术也有助于成人气道评估和相关气道疾病的治疗。从2011年至今,3D打印技术逐步应用于术前气道评估[6]。在困难气道、气道解剖结构改变或气道为手术部位时,传统的气道评估方法将不再适用,3D打印模型可以帮助了解气道病变、气道肿瘤形态大小和位置、病变与邻近器官的解剖位置、重要供血血管等信息[7],尤其有利于麻醉医生的气道评估、困难气道插管以及制定单肺通气的气道管理方案[8]。在整形外科中,可应用3D打印技术模拟整形后的面部结构,比如模拟鼻部手术后面部和气道改变,以此来评估和判断整形手术的可行性[9]。此外,3D打印技术还可用于术后手术效果的评价和气道评估,预防术后肉芽组织增生造成的气道狭窄,并可检测多发性软骨炎的复发,以预防气管支气管软化症的发生[10]。
3D打印技术以其准确定位和立体精细剪裁,制作出个体化解剖仿真模型,能够更直观地了解不同个体的气道疾病,用于制定精准的气道手术方案及合并气道疾病的非气道手术患者的气道管理方案,合理规划手术空间,缩短手术时间,预判术中可能出现的问题且可避免因过度破坏气道而造成的术后并发症,极大地提高麻醉管理质量和手术治疗效果。北京大学第三医院麻醉科首次应用3D打印技术完成1例喉癌术后气管切开的气道评估[11]。应用CT对患者气道进行扫描,将CT中的薄层图像资料用于三维计算功能重建,将气管3D图像导入3D打印机,应用可生物降解的绿色高分子材料聚丙交酯(polylactic acid,PLA)制作出气管模型(图3),根据患者气道打印3D气道模型,根据CT图像中气道外径打印3D气道模型(图3A),根据CT图像中气道内镜打印制作的3D气道模型(图3B)。通过该模型,直观、全面地对患者气道情况做出评估,并根据模型选择满足麻醉与手术需要的气管导管(图3B,3C),顺利完成麻醉与手术(图3D),术后患者预后良好。
2 3D打印气道支架
近年来,3D打印技术除在气道评估方面发挥作用外,植入存在呼吸系统疾病患者体内的3D打印气道支架也在逐年增加。气道支架是针对气道狭窄或塌陷的患者所采用的一类气道内部或外部环形网状支撑物,以此来扩张和支撑气道以达到解除狭窄的治疗目的。目前,临床上常用的气道支架以Dumon硅酮支架和镍钛记忆合金支架居多。Dumon硅酮支架有易发生移位、无法完全贴合气道而易滋生细菌、不适用于曲线病灶等缺点;镍钛记忆合金支架有塌陷可致气道梗阻、过度膨胀压迫气道壁及难以取出等缺点[12],究其原因是批量生产的气道支架不能完全满足不同患者的病情需求。3D打印技术不仅可用于评估这类支架的设计质量[13],还可以用于制作个体化气道支架。治疗睡眠呼吸暂停综合征所采用的传统口腔矫正器需要定期复诊,黏附率高,还有副作用,因此,轻薄、舒适贴合、黏附率低的个体化3D打印口腔矫正器应运而生,开创气道支架的先河[14]。3D打印技术还极大提高气道支架的制作效率,传统支架的制作周期常为数月,基于患者的CT、MRI、超声等影像学资料的3D打印技术在3~4 d内即可制作出个体化的气道支架[15],具有广阔的应用前景。
近年来,随着3D打印技术的逐步成熟,出现一种植入气管和支气管外表面的3D打印支架。尽管同样起到气道支撑作用,但它不同于普通气道外薄片支架[16],其形状与患者气道走行一致,较好地贴合气道,提升支撑效果(图4)。Zopf等[17,18]应用SLS技术和可吸收材料打印出气道外支撑薄片治疗早产儿气管支气管软化,有效缓解威胁生命的气道塌陷,1年后临床跟踪气道开放效果良好,且预计该支架在3年内自动吸收。在小儿气道软化症应用3D打印的气道支架,还需注意气道支架应适应气道组织的动态生长,聚己内酯(polycaprolactone,PCL)是较为适合的材料[19]。Kaye等[20]设计一个270°的环形气道外3D打印薄片支架进行体外实验,实验结果表明,软化气管植入支架后相比软化气管的塌陷率显著降低(P<0.01),与正常气管的塌陷率无统计学差异(P=0.13)。虽然目前对于有复杂和严重气道问题的患者手术进行气道重建能使80%~90%的患者产生良好的效果,但3D打印的气道外支撑薄片可以个体化重建,对于提升治疗效果仍有空间[21]。
未来的3D打印气道支架将是组织工程学和3D技术的完美结合,不仅具备严格的气密性[22],良好的贴合气道,能够提供长效的支撑,不发生移植物抗宿主反应有良好的组织相容性,并能预防肉芽组织增生,促进新血管形成等特点。
3 气道修复
在气道管理中,具有先天性气道发育不良或气道相关手术后发生气道软化、气道塌陷、气道破损等组织缺陷的患者均需要及时进行气道修复。因气道修复过程受到修复材料、外科操作和患者免疫反应等多重因素的影响,患有严重气道缺陷的患者死亡率较高。组织工程学和3D打印技术的结合改善了这一现状,在个体化气道修复方面正在逐渐成为研究和应用的热点。融合组织工程学的3D打印技术以其精准还原气道缺损情况和个体化制备修复材料的优势,制造出贴合患者气道、降低排斥反应又不阻碍其气道内组织生长的修复材料,提高气道修复成效。
近年来,气道支架与细胞疗法、生物活性因子的联合应用在气道的再生和修复方面的应用不断增多[23]。结合组织工程学和3D打印技术的3D生物打印技术的出现,提供更多的具有生物活性的移植物和修补片[21],3D打印技术未来可以作为基质细胞、干细胞、生长因子的载体或者直接打印出符合个体需求的活体组织。3D打印在喉气管重建中的应用具有很大潜力,这源于3D生物打印技术的出现,3D生物打印可以精确控制不同生物材料的空间构成,在兔的喉气管重建模型上,研究者利用3D生物打印的喉气管移植物对摘除喉气管的32只实验兔实施重建术,术后体外细胞增殖试验结果表明,修补物的初代平均存活率为87.5%,移植细胞7 d之内可以翻1倍,并且实验动物在移植后未发现呼吸异常,且修补物的软骨组织具有良好的组织相容性[24]。
目前,常用的医疗3D打印材料主要为PCL和聚乳酸-羟基乙酸(polylactic-co-glycolic acid,PLGA)2种纤维聚合物。上述2种材料在气道支架制备及气道修补中可单独应用或分层、混合使用[25]。PCL已在医疗方面广泛应用,在机械性能方面低熔点(约60 ℃)便于3D打印材料的融化,PCL还可提高支架的机械性,能长效维持稳定的支撑。PCL也被称为“4D生物材料”,因为它可以随着时间推移适应患者气道的生长而变形、变性,因此,特别适于儿科气道缺陷患者的气道支撑和修补[19]。PLGA是较为新兴的材料,既可以提供机械性支撑,还是可降解材料,可以在体内逐渐水解,因而可作为药物缓释的载体或暂时性支架。3D打印的复合材料气道支架根据其纤维直径、孔隙大小、孔隙率、纤维走行方式不同会对气道细胞修复产生不同的影响,这2种纤维聚合物的最佳混合搭配所制备的3D打印支架的拉伸和径向压缩耐受度是其他试验组3~8.5倍,更能满足医生和患者对修复材料的需求[25]。根据不同的治疗需求可以应用可吸收、不可吸收或者部分吸收的修复材料,3D打印产品的机械性能也将很大程度上影响气道修复过程,在气道管理方面的应用具有很大潜力,值得进一步研究。
4 3D打印技术用于临床教学和辅助研究
3D打印技术不仅有助于临床诊断和治疗,在教学和科研方面也逐步得到应用。普通的气道管理教学大多采用文字描述和临床操作的方式,前者实践性差,无法让学生有直观的体验,后者在现今医疗环境下具有一定风险性,若使用实验动物进行操作则存在动物资源利用、管理和处理的问题,甚至伦理问题。目前,国内将3D打印技术应用到气道教学中的仍属少数,大多3D打印模型是气道评估后继续用于临床教学的,但这已经提供良好的可视化教学模型,让学生更直观、更真实地了解不同个体的气道解剖情况,跳出传统抽象的二维教学,大大提高教学成效和满意度,是锻炼和提高学生临床思维的良好工具[26,27](图5)。除此之外,该模型也有助于向患者及家属介绍病情和治疗方案,提高医患沟通效率。在纤维支气管镜的教学中,可应用免费开放的3D模拟软件和低成本3D打印气道模型(图6),这种方法已投入教学并且收效显著,既大幅降低教具成本,又能很好地保持学生对于解剖结构的辨识度[28~30]。低成本的3D打印教学模型也可用于气道重建软骨移植术的模拟训练,56%的参训者认为该模型与实际情况高度相似,其余不认为高度相似的主要原因是3D材料的非均质性和对其触觉的陌生感,但总体来说,因其成本较低(约0.6美元)、形状和特征符合标准人体结构,在外科医师气道手术的训练中具有较好的应用前景[31]。
3D打印的气道模型也可以用于实验研究,如离体仿真实验模型的制备。3D打印技术在模拟早产儿呼吸道气溶胶疗法的研究方面已有应用,通过打印不同周数胎儿上呼吸道的模型来满足实验需求,因不涉及人体器官和组织的使用在医学伦理方面具有明显优势[32]。除此之外,3D打印的气道模型还可用于气溶胶、造影剂、药物等在气道内分布情况的研究[33]。伴随3D打印技术的不断成熟,具有热熔性的3D打印材料可以反复利用,避免了常规教学模型损耗和更新带来的巨大开销,日后热熔材料制备的3D打印教学模型可能会比市售的常规教学模型更加经济环保,具有较好的应用前景。
5 展望
3D打印技术现已成为精准医疗的一部分,在气道管理方面的应用也在不断完善和提升,但该技术仍有一定的局限性:用于打印材料的机械性能或化学性质还不能完全满足理想气道支撑物和修补物的要求;缺乏个体化3D打印产品的质量检测标准;缺乏植入物长期活体试验观察,难以预测长期植入后不良反应;3D打印产品的消毒措施有限(大部分打印材料都不能耐受高温和高压消毒),目前,可用环氧乙烷、过氧化氢和伽马射线进行消毒等[19],但这些局限性终将随着3D打印技术和组织工程学的发展逐步减少。
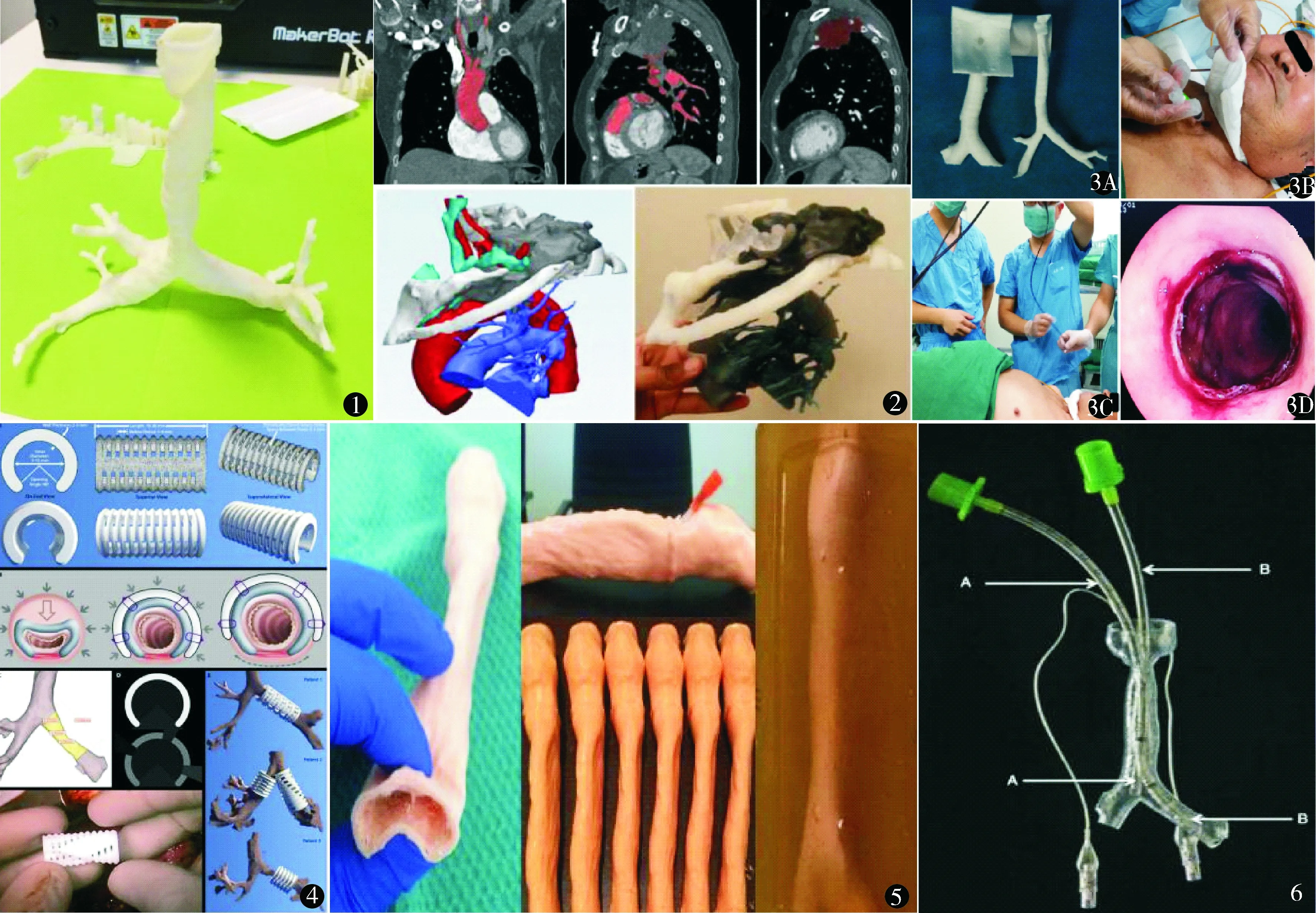
图1 3D打印的气道模型[8] 图2 3D打印技术显示气道与大血管位置关系[7] 图3 3D打印技术辅助喉部肿瘤患者气管切开术后的气道评估[11] 图4 3D打印气道外支架示意图[18] 图5 喉气管教学模型[8] 图6 应用于支气管插管的教学[7]
在未来的气道管理当中,3D打印技术在气道评估方面的应用将逐步常规化,或不再局限于困难气道。在气道支架和气道修复方面会结合组织工程学研究,将打印材料从人工聚合物优化成为具有生物活性的组织,更能满足不同患者和医生的需求,因此,在手术和麻醉的呼吸管理方面有很大的应用前景。因3D打印技术几近符合精准化医疗和个体化医疗的需要,未来批量生产的气管导管和气道支架很可能逐步减少甚至消失。在气道管理的教学方面,可建立3D医疗影像资源库,从中可获得能直接进行3D打印的气道数据和图像,便于各教学机构和医疗机构共享资源,通过交流学习营造更加完善的教学和科研环境,使3D打印技术能够在气道管理方面发挥到极致。
1 Chen H, van Eijnatten M, Wolff J, et al. Reliability and accuracy of three imaging software packages used for 3D analysis of the upper airway on cone beam computed tomography images. Dentomaxillofac Radiol,2017,46(6):20170043.
2 Vankoevering KK, Morrison RJ, Prabhu SP, et al. Antenatal three-dimensional printing of aberrant facial anatomy. Pediatrics,2015,136(5):e1382-e1385.
3 Wilson CA, Arthurs OJ, Black AE, et al. Printed three-dimensional airway model assists planning of single-lung ventilation in a small child. Br J Anaesth, 2015,115(4):616-620.
4 上海交通大学医学院附属上海儿童医院率先开展婴幼儿气道狭窄纠治手术.上海交通大学学报(医学版),2016,36(4):554.
5 Speggiorin S, Durairaj S, Mimic B, et al. Virtual 3D modeling of airways in congenital heart defects. Front Pediatr,2016,4:116.
6 Crafts TD, Ellsperman SE, Wannemuehler TJ, et al. Three-dimensional printing and its applications in otorhinolaryngology-head and neck surgery. Otolaryngol Head Neck Surg,2017,156(6):999-1010.
7 Giannopoulos AA, Steigner ML, George E, et al. Cardiothoracic applications of 3-dimensional printing. J Thorac Imaging,2016,31(5):253-272.
8 Chao I, Young J, Coles-Black J, et al. The application of three-dimensional printing technology in anaesthesia: a systematic review. Anaesthesia, 2017,72(5):641-650.
9 Manuel CT, Harb R, Badran A, et al. Finite element model and validation of nasal tip deformation. Ann Biomed Eng,2017,45(3):829-838.
10 Tam MD, Laycock SD, Jayne D, et al. 3-D printouts of the tracheobronchial tree generated from CT images as an aid to management in a case of tracheobronchial chondromalacia caused by relapsing polychondritis. J Radiol Case Rep,2013,7(8):34.
11 Han B, Liu Y, Zhang X, et al. Three-dimensional printing as an aid to airway evaluation after tracheotomy in a patient with laryngeal carcinoma. BMC Anesthesiol,2016,16:6.
12 张治国,孙亿民,江 晨,等.人体气道支架的发展与最新研究进展.常州大学学报(自然科学版), 2017,29(1):62-67.
13 Hollister SJ, Flanagan CL, Zopf DA, et al. Design control for clinical translation of 3D printed modular scaffolds. Ann Biomed Engl,2015,43(3):774-786.
14 Jacobowitz O. Advances in oral appliances for obstructive sleep apnea. Adv Otorhinolaryngol,2017,80:57-65.
15 气道支架:3D打印在医疗领域的潜在应用.塑料科技,2015,1:54.
16 Hsueh WD, Smith LP. External airway splint to treat tracheomalacia following laryngotracheal reconstruction. Int J Pediatr Otorhinolaryngol,2017,94:68-69.
17 Zopf D, Hollister S, Nelson M, et al. Bioresorbable airway splint created with a three-dimensional printer. N Engl J Med,2013,368: 2043-2045.
18 Morrison RJ, Hollister SJ, Niedner MF, et al. Mitigation of tracheobronchomalacia with 3D-printed personalized medical devices in pediatric patients. Sci Transl Med,2015,7(285):1-11.
19 Cheng GZ, San Jose Estepar R, Folch E, et al. Three-dimensional printing and 3D slicer: powerful tools in understanding and treating structural lung disease. Chest,2016,149(5):1136-1142.
20 Kaye R, Goldstein T, Aronowitz D, et al. Ex vivo tracheomalacia model with 3D-printed external tracheal splint. Laryngoscope, 2017,127(4):950-955.
21 Kaye R, Goldstein T, Zeltsman D, et al. Three dimensional printing: A review on the utility within medicine and otolaryngology. Int J Pediatr Otorhinolaryngol,2016,89:145-148.
22 Fishman JM, Wiles K, Lowdell MW, et al. Airway tissue engineering: an update. Expert Opin Biol Ther,2014,14(10):1477-1491.
23 Hertegård S. Tissue engineering in the larynx and airway. Curr Opin Otolaryngol Head Neck Surg,2016,24(6):469-476.
24 Goldstein TA, Smith BD, Zeltsman D, et al. Introducing a 3-dimensionally printed, tissue-engineered graft for airway reconstruction: a pilot study. Otolaryngol Head Neck Surg,2015,153(6):1001-1006.
25 Ott LM, Zabel TA, Walker NK, et al. Mechanical evaluation of gradient electrospun scaffolds with 3D printed ring reinforcements for tracheal defect repair. Biomed Mate,2016,11(2):1-16.
26 孙世伟,葛 楠,刘洪涛.3D打印技术在麻醉神经阻滞教学中的应用.中国继续医学教育,2017,9(4):46-47.
27 周 悦,黄华兴,王 巍,等.3D打印技术在外科临床教学中的应用.南京医科大学学报(社会科学版), 2015,6:504-506.
28 Parotto M, Jiansen JQ, Abotaiban A, et al. Evaluation of a low-cost, 3D-printed model for bronchoscopy training. Anaesthesiol Intensive Ther,2017,49(3):189-197.
29 Byrne T, Yong SA, Steinfort DP. Development and assessment of a low-cost 3D-printed airway model for bronchoscopy simulation training. J Bronchology Interv Pulmono,2016,23(3):251-254.
30 Pedersen TH, Gysin J, Wegmann A, et al. A randomised, controlled trial evaluating a low cost, 3D-printed bronchoscopy simulator. Anaesthesia,2017,72(8):1005-1009.
31 Ha JF, Morrison RJ, Green GE, et al. Computer-aided design and 3-dimensional printing for costal cartilage simulation of airway graft carving. Otolaryngol Head Neck Surg,2017,156(6):1044-1047.
32 Minocchieri S, Burren JM, Bachmann MA, et al. Development of the premature infant nose throat-model (PrINT-Model): an upper airway replica of a premature neonate forthe study of aerosol delivery. Pediatr Res,2008,64(2):141-146.
33 Kim MT, Park JH, Shin JH, et al. Influence of contrast agent dilution on ballon deflation Time and visibility during tracheal balloon dilation: a 3D printed phantom study. Cardiovasc Intervent Radiol,2017,40(2):285-290.
