组合支架在经颈静脉肝内门体分流术中应用的随访结果
2018-04-24赵世录王昌明栾景源李天润董国祥
赵世录 王昌明 傅 军 栾景源 李天润 赵 军 董国祥 李 选
(北京大学第三医院介入血管外科,北京 100191)
门脉高压症是由于各种原因引起的门静脉及其属支压力升高,侧支循环开放引起食管胃底曲张静脉破裂出血是门脉高压症最主要的并发症,也是门脉高压症患者死亡的主要原因[1]。经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)是在肝静脉和门静脉之间建立分流道,以降低门静脉压力,从而预防和控制门静脉高压症引起的严重并发症,在临床上广泛应用于食管胃底静脉曲张出血、顽固性胸腹腔积液、布加氏综合征等疾病的治疗[2~4]。随着覆膜支架的应用,TIPS术后支架狭窄率已经显著降低[5~7],但术后肝性脑病、肝功能衰竭等并发症仍然是限制该技术发展的主要原因[6]。在门脉高压症患者中,如何提高分流道通畅率,合理调节分流量,减少因门静脉过度分流引起的肝性脑病及肝功能损伤是临床亟待解决的问题。2011年4月~2017年5月我们在TIPS术中以“裸支架+相应长度覆膜支架”的形式建立分流道,既提高分流道通畅率,又保证门静脉分支血供,通过不同直径支架的组合实现分流量主动调控,减少过度分流并改善预后,报道如下。
1 临床资料与方法
1.1 一般资料
2011年4月~2017年5月我科对TIPS术中以“裸支架+相应长度覆膜支架”的形式建立分流道进行前瞻性研究。病例选择标准:①自愿作为受试对象,签署知情同意书;②反复内镜治疗无效或内镜治疗失败的食管胃静脉曲张破裂出血、难治性腹水;③年龄18~85岁。排除标准:①年龄<18岁或>85岁;②不符合临床研究方案规定的纳入标准;③合并心、脑、肝、肾和造血系统疾病及精神病;④妊娠、哺乳期妇女、过敏体质;⑤已知对造影剂过敏;⑥参加其他临床试验者或研究者认为不宜参加本试验;⑦TIPS术前行其他门脉系统手术(如分流或断流术);⑧恶性肿瘤患者,预计生存时间不超过6个月。
共纳入61例,男39例,女22例。年龄(58.5±9.9)岁(41~82岁)。病因为乙型肝炎肝硬化30例,丙型肝炎肝硬化5例,酒精性肝硬化9例,自身免疫性肝炎5例,布加综合征1例,原发性胆汁性肝硬化2例,其他未知病因9例。肝功能Child-Pugh分级A级21例,B级32例,C级8例。合并门静脉血栓10例。TIPS指征为上消化道出血55例(其中急性上消化道出血27例),难治性腹水6例。
1.2 方法
1.2.1 围手术期处理 术前行肝脏增强CT明确门静脉系统情况,确定有无血栓并明确门静脉分支与肝静脉相对位置及有无肝脏占位。择期手术者纠正低蛋白血症,使血清白蛋白达到30 g/L左右。术前2 d低蛋白饮食,防止血氨增高诱发或加重肝性脑病。纠正贫血,低血小板等情况,调整凝血功能,改善肝功能。急诊患者采用三腔两囊管或药物止血治疗,纠正休克,血红蛋白调整至60~70 g/L,生命体征相对平稳,意识清楚,即行手术。
1.2.2 手术方法 手术由同一名经验丰富的医师主导操作,术中全身肝素化(普通肝素80 U/kg)。仰卧位,常规消毒铺巾,局部麻醉下右颈内静脉入路,经肝静脉穿刺门静脉分支,建立分流道。以裸金属支架将门静脉分支与下腔静脉之间短路(常用直径10 mm或8 mm,自膨式支架)。裸支架释放后,其通过肝实质部分(狭窄段)获清晰显示,测量其长度。根据裸支架经过肝实质段长度及球囊直径选择相应规格覆膜支架(Fluency,美国巴德公司)覆盖分流道肝实质段。59例胃底曲张静脉根据术中造影以弹簧圈进行选择性栓塞。
1.2.3 术后处理 术后普通肝素抗凝24 h,监测活化部分凝血酶时间至正常值2倍。术后限制蛋白饮食3个月,口服乳果糖30 ml/d,保持排便通畅,预防肝性脑病;预防感染,保护肝功能。
1.3 手术成功的标准
①成功建立分流道,覆膜支架准确覆盖肝实质段,门静脉分支血流通畅;②血流动力学标准:门体压力梯度值(portosystemic gradient,PSG)较术前下降50%[8]。
1.4 观察指标
①门静脉压力检测:通过门静脉内造影导管直接测量术前、术后门静脉压力,并计算PSG,比较手术前后门静脉压力变化。②分流道功能:术后3、6、12、24、36、48个月行血常规、肝肾功能、凝血功能、血氨检查,同时性腹部彩超或肝脏增强CT检查,必要时行血管造影检查,了解分流道及门脉分支血流情况。③临床疗效:肝功能、腹水变化情况、再出血率、肝性脑病发生率及生存率。
1.5 统计学分析
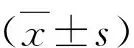
2 结果
61例均成功完成TIPS,手术成功率100%,均未出现操作相关并发症,59例同期完成食道胃底曲张静脉栓塞。共置入128枚支架,其中覆膜支架62枚,裸支架66枚。27例急性上消化道出血即刻止血率为100%。中位住院时间7 d(2~21 d)。
2.1 TIPS术后对门静脉血流动力学影响
TIPS术前PSG为16~73 mm Hg,(38.0±8.1)mm Hg;术后10~30 mm Hg,(15.2±3.2)mm Hg,术前后比较有显著性差异(t=28.546,P=0.000)。
2.2 TIPS术后分流道功能
分流道经肝实质段长(前后位测量)13~60 mm,(28.6±9.8)mm。随访过程中,5例(8.2%)发生分流道狭窄或闭塞,其中1例为门静脉癌栓阻塞分流道,未再行开通;余4例行二次开通术(其中1例开腹经肠系膜上静脉途径开通),复查未见支架再狭窄。术前9例合并门静脉血栓,1例术后26个月后发生分流道闭塞,其余患者至随访结束,分流道通畅。61例术后一期累积通畅率见图1和表1,二期累积通畅率为100%。

图1 术后分流道一期累积通畅率
2.3 肝性脑病和肝功能情况
肝性脑病(West-Haven分期)11例:Ⅰ、Ⅱ期分别为4、3例,经饮食控制及内科处理后好转;Ⅲ期3例,经内科药物保守治疗好转;Ⅳ期1例死亡。至随访结束,Ⅲ、Ⅳ期肝性脑病发生率为6.6%(表1)。
61例术前Child-Pugh评分(7.59±1.68)分,52例长期存活者Child-Pugh评分术前(7.47±1.60)分,随访结束时(7.04±1.12)分,差异无统计学意义(t=1.961,P=0.055)。
2.4 术后再出血率(表1)
4例发生再出血,再出血中位时间为术后第18个月(7~32个月)。2例为分流道狭窄或闭塞,通过分流道扩张术及支架再次置入治疗成功,其后未再出血;另2例出血因放弃治疗死亡。
2.5 术后腹水情况
6例难治性腹水术后积液量均有减少,其中2例术后3个月腹部超声提示腹水由大量减少为中等量,3例由大量减少为少量,1例由中等量减少为少量,无完全消失者。患者腹围由术前(86.45±3.21)cm降至术后(76.47±3.59)cm,差异有统计学意义(t=8.182,P=0.000)。
2.6 TIPS术后生存率(表1)
随访截止2017年5月。61例术后随访5~73个月,中位随访时间26个月,34例随访>24个月,18例随访>36个月,7例随访>60个月:9例死亡,其中3例死于多器官功能障碍,2例死于肝癌晚期肝功能衰竭,1例死于肝性脑病,1例死于肺部感染,2例死于术后消化道再出血。Kaplan-Meier生存曲线见图2。
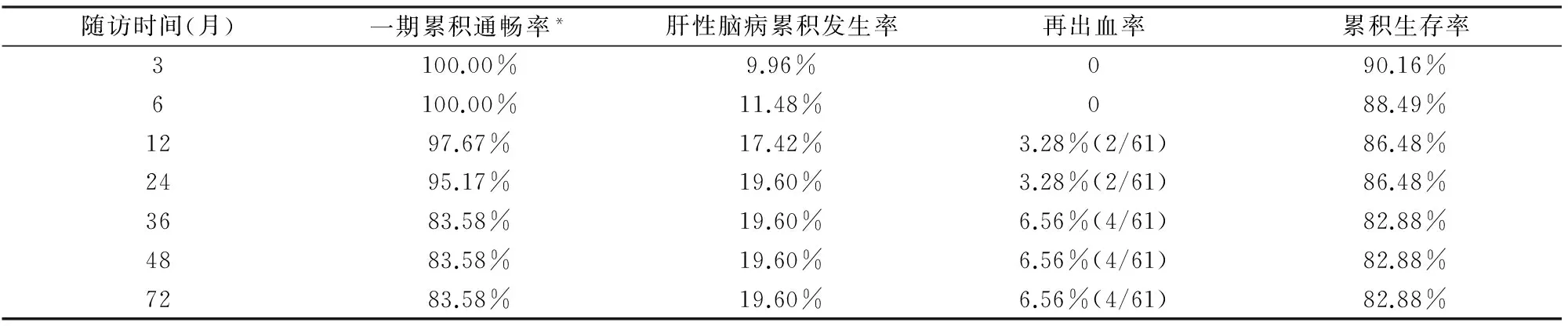
表1 61例术后随访情况
*一期累积通畅率:TIPS术后未再采取任何治疗措施,分流道一直保持通畅;二期累积通畅率:TIPS术后分流道发生阻塞,经二次开通后分流道保持通畅
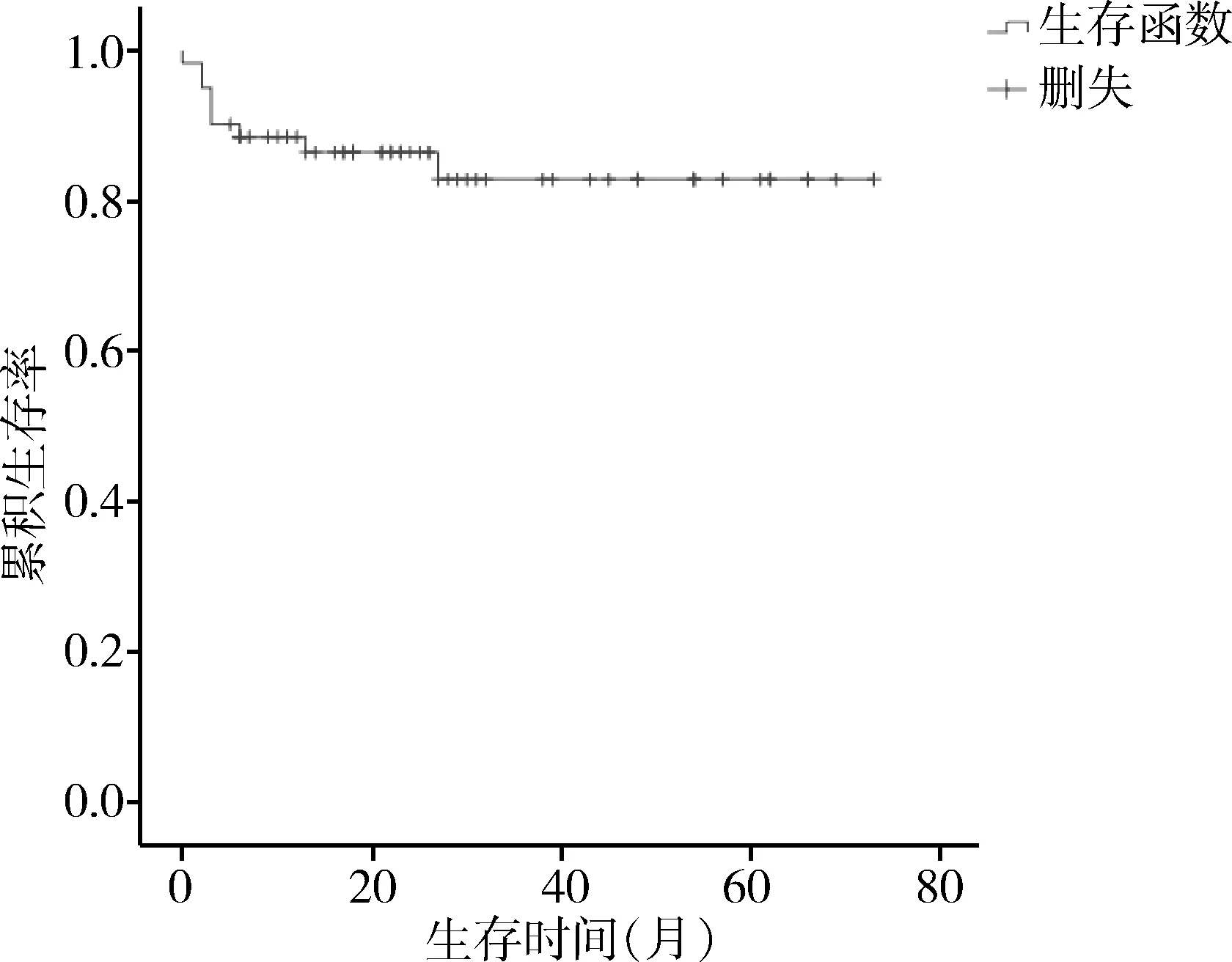
图2 Kaplan-Meier生存曲线
3 讨论
近年来,TIPS在技术上日益成熟,已被公认为门脉高压上消化道出血及顽固性腹水的重要治疗方法。但TIPS术后支架再狭窄、术后肝功能损害及肝性脑病的发生率较高,是限制TIPS广泛应用的主要原因。覆膜支架应用于临床后,极大地提高支架的通畅率[9]。覆膜支架的覆膜区,主要是通过覆盖肝静脉-门静脉通道的肝实质部分,减少胆汁及内皮细胞增生等对支架的影响来提高支架通畅率。但覆膜支架与金属裸支架相比塑形性差,在实际操作过程中,覆膜支架的门静脉端、肝静脉端常常要达到门静脉主干、下腔静脉入口水平,如果没有达到上述水平,或出现支架末端“盖帽”、“贴壁”、“成角”等,影响支架的通畅率;同时,超范围的覆盖会影响门静脉分支血供,形成血栓,影响肝功能,并容易继发血栓形成。这些因素在一定程度上抵消覆膜支架的优势。
作为分流道主要框架的裸金属支架与肝实质段短覆膜支架的组合模式,能减少分流道对肝脏血流灌注的影响;金属裸支架可塑性好,可避免分流道与门静脉成角的情况,金属裸支架的门静脉端可深入至门静脉分叉水平甚至门静脉主干内并与之相倚靠,不影响门脉分支的血流,理论上可以减少门静脉入口端血流动力学紊乱的发生。
术中经过球囊扩张及祼支架的释放,分流道肝实质段能够得到清晰显示及准确测量,降低覆膜支架精确释放的难度[10],提高定位准确性。分流道肝实质段长度一般在2~4 cm,远小于整体长度,相应长度覆膜支架释放后,既可以准确覆盖肝实质段,又能够使门静脉分支血供全部得以保留,从而保护肝功能,并减少血栓形成[10]。
为减少因门体过度分流导致的肝性脑病、减少支架阻塞率,我们设计的组合支架,可通过不同直径球囊、支架的组合及多次门静脉测压等逐步操作,使PSG得到合理控制,在一定程度上减少过度分流引起的肝功能衰竭及肝性脑病。初次扩张分流道时,我们建议选用较小口径球囊(通常为6 mm),随后选用较大口径裸支架(10 mm或8 mm,参考外科限制性分流手术数据);释放后第1次测压,如果PSG大于既定标准,选用更大口径球囊扩张,并配以相应口径覆膜支架覆盖;如果压力下降超过预定值,选用较小口径覆膜支架修正,最终使PSG较术前下降50%。临床应用过程中,10 mm或8 mm口径裸支架与不同口径及长度覆膜支架组合,术后肝性脑病累积发生率19.60%,文献[11,12]报道10 mm支架TIPS术后肝性脑病发生率40%。本组52例存活者Child-Pugh评分较术前无明显变化(t=1.961,P=0.055),肝功能得到有效保护。本组9例死亡中,术前Child-Pugh分级A级占9.52%(2/21),B级占9.38%(3/32),C级占50.00%(4/8)。可见,术前肝功能Child-Pugh分级越差的患者术后死亡的风险越高。
肝性脑病多发生在术后的1~3个月内,其中大多数患者临床症状轻微且易于治疗,术后6个月后肝性脑病发生率明显降低。本组11例发生肝性脑病,皆与未严格控制蛋白饮食有关,其中Ⅰ、Ⅱ期分别为4、3例,经饮食控制及内科处理后好转,Ⅲ期3例,经内科药物保守治疗好转,Ⅳ期1例死亡。
我们设计的组合支架(裸支架+一定长度的覆膜支架)与TIPS专用支架(Viatorr)的设计原理相似,Viatorr支架分为裸区和覆膜区,在释放时需要精确定位,操作上有一定难度,有时常因为定位不精确,需要另外放置支架来修正[13,14]。组合支架的分步放置方式可将分流道肝实质部分清晰显影,大大减少覆膜支架准确覆盖肝实质段的难度,临床效果与Viatorr支架无明显差异[14]。术后72个月再出血率为6.56%(4/61),Lv等[15]报道术后2年再出血率25%,在后面的临床研究中可以考虑进一步减少分流,以更大程度减少肝性脑病,减轻肝功能损伤。
总之,使用组合支架(裸支架+覆膜支架)实现肝实质分流道准确定位覆盖,在技术上安全可行,分流量在一定程度上可调控,术后肝功能得到有效保护并降低肝性脑病的发生率。在临床初步应用中,支架通畅率、再出血率及生存率等方面在术后中远期均获较满意效果。
1 Loffroy R, Favelier S, Pottecher P, et al. Transjugular intrahepatic portosystemic shunt for acute variceal gastrointestinal bleeding: Indications, techniques and outcomes. Diagn Interv Imaging,2015,96(7-8):745-755.
2 Pomier-Layrargues G, Bouchard L, Lafortune M, et al. The transjugular intrahepatic portosystemic shunt in the treatment of portal hypertension: current status. Int J Hepatol,2012,2012:167868.
3 Lo GH. The use of transjugular intrahepatic portosystemic stent shunt (TIPS) in the management of portal hypertensive bleeding. J Chin Med Assoc,2014,77(8):395-402.
4 Boyer TD, Haskal ZJ. The role of transjugular intrahepatic portosystemic shunt (TIPS) in the management of portal hypertension: update 2009. Hepatology,2010,51(1):306.
5 Perarnau JM, Le Gouge A, Nicolas C, et al. Covered vs. uncovered stents for transjugular intrahepatic portosystemic shunt: a randomized controlled trial. J Hepatol,2014,60(5):962-968.
6 Weber CN, Nadolski GJ, White SB, et al. Long-term patency and clinical analysis of expanded polytetrafluoroethylene-covered transjugular intrahepatic portosystemic shunt stent grafts. J Vasc Interv Radiol,2015,26(9):1257-1265.
7 Sommer CM, Gockner TL, Stampfl U, et al. Technical and clinical outcome of transjugular intrahepatic portosystemic stent shunt: bare metal stents (BMS) versus viatorr stent-grafts (VSG). Eur J Radiol,2012,81(9):2273-2280.
8 Angermayr B, Cejna M, Koenig F, et al. Survival in patients undergoing transjugular intrahepatic portosystemic shunt: ePTFE-covered stentgrafts versus bare stents. Hepatology,2003,38(4):1043-1050.
9 Bureau C, Pagan JC, Layrargues GP, et al. Patency of stents covered with polytetrafluoroethylene in patients treated by transjugular intrahepatic portosystemic shunts: long-term results of a randomized multicentre study. Liver Int,2007,27(6):742-747.
10 王昌明,李 选,傅 军,等. 肝实质段覆膜支架精确覆盖技术在经颈静脉肝内门体分流术中的应用.北京大学学报(医学版),2014,46(1):165-168.
11 Barrio J, Ripoll C, Banares R, et al. Comparison of transjugular intrahepatic portosystemic shunt dysfunction in PTFE-covered stent-grafts versus bare stents. Eur J Radiol,2005,55(1):120-124.
12 Bettinger D, Schultheiss M, Boettler T, et al. Procedural and shunt-related complications and mortality of the transjugular intrahepatic portosystemic shunt (TIPSS). Aliment Pharmacol Ther,2016,44(10):1051-1061.
13 Hausegger KA, Karnel F, Georgieva B, et al. Transjugular intrahepatic portosystemic shunt creation with the Viatorr expanded polytetrafluoroethylene-covered stent-graft. J Vasc Interv Radiol,2004,15(3):239-248.
14 Saad WE, Darwish WM, Davies MG, et al. Stent-grafts for transjugular intrahepatic portosystemic shunt creation: specialized TIPS stent-graft versus generic stent-graft/bare stent combination. J Vasc Interv Radiol,2010,21(10):1512-1520.
15 Lv Y, Qi X, He C, et al. Covered TIPS versus endoscopic band ligation plus propranolol for the prevention of variceal rebleeding in cirrhotic patients with portal vein thrombosis: a randomised controlled trial. Gut,2017, pii: gutjnl-2017-314634. [Epub ahead of print]
