幽门螺杆菌分型与儿童腹型过敏性紫癜的关系
2018-04-24张小飞荣爱红王字举赵学良
王 硕,张小飞,荣爱红,王字举,赵学良*
(1.吉林大学中日联谊医院 儿科,吉林 长春130033;2.北京中医药大学东直门医院 检验科,北京100700)
过敏性紫癜(HSP)是一种儿科常见疾病,虽然HSP的病因很多,但是感染因素被认为是最重要的致病因素[1]。HP感染与HSP的关系最初受到了成人同时患HSP和胃炎的个案例报道的启发[2]。幽门螺杆菌人群普遍易感,且感染主要在儿童期获得,此时期也是HSP的高发期。有报道指出在中国,HP流行地区的HSP患儿的感染率特别高,尤其是腹型HSP的患者中检出率较高[3]。大量研究表明HP分型与HSP的发生存在一定联系[4]。HP分为两型:Ⅰ型(表达CagA和/或VacA);Ⅱ型(CagA和VacA均不表达)。菌株分型不同,毒力不同,感染宿主的能力和临床表现不同[5]。本研究着重探讨HP分型与HSP的关系。
1 资料与方法
1.1一般资料选取2015年4月至2017年4月吉林大学中日联谊医院儿科收治的过敏性紫癜患儿70例作为实验组,均符合过敏性紫癜诊断标准[6]。符合以下体征2条或以上:①可触性紫癜;②发病年龄<16岁;③急性腹痛;④组织切片显示小静脉和小动脉周围有中性粒细胞浸润。其中伴消化道症状症状有消化系统损伤的有44例。男36例,女34例,年龄4-16岁,平均(8.9±3.1)岁。另选30例健康小儿作为对照组。男18例,女12例,年龄4-16岁,平均(9.4±3.4)岁。两组患儿的性别、年龄等一般资料对比后,差异无统计学意义(P>0.05)。
1.2方法两组患儿均进行HP抗体分型(免疫印迹法)检查HP感染情况并对HP进行分型检测。试剂盒由深圳市伯劳特生物制品有限公司生产。操作过程严格按照说明书进行:取10 μl血清与缓冲液同时加入孵育槽中与印记膜孵育30 min,洗涤3次,加入酶标抗体室温孵育30 min,再洗涤3次,加入酶底物5 min后显色。结果判读:HP的细胞毒素CagA(116KD区带)、空泡毒素VacA(95KD和91KD区带)、尿素酶UreB(66KD)和尿素酶UreA(30K区带)抗体,将有CagA区带和/或VacA区带显色的定为Ⅰ型(毒力型)HP感染,无CagA区带和VacA区显色的定为Ⅱ型(非毒力型)HP感染,无CagA、VacA、Ureas区带的为HP感染阴性。
1.3统计学处理用SPSS24统计软件,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1血HP检测结果70例HSP患儿与健康对照组HP感染情况,见表1,HSP患儿组与健康对照组HP阳性率差异有统计学意义(P<0.05)。腹型过敏性紫癜与非腹型过敏性紫癜HP感染情况,见表2,腹型过敏性紫癜与非腹型过敏性紫癜HP感染阳性率差异有统计学意义(P<0.05)。HSP患儿HP免疫印记分型结果,见表3,腹型过敏性紫癜与非腹型过敏性紫癜比较,Ⅰ型HP感染率差异有统计学意义(P<0.05)。
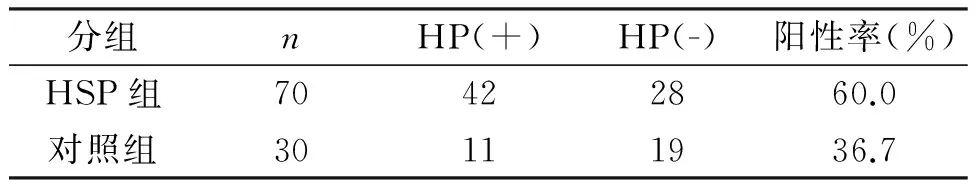
表1 70例HSP患儿与健康对照组HP感染情况(n)
注:过敏性紫癜与健康对照组阳性率差异有统计学意义,P<0.05

表2 70例HSP患儿HP感染情况(n)
注:腹型过敏性紫癜与非腹型过敏性紫癜阳性率差异有统计学意义,P<0.05
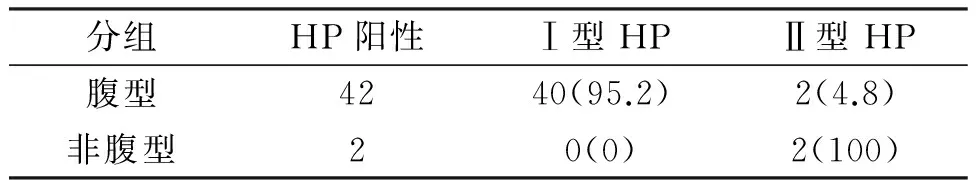
表3 HSP患儿免疫印迹法分型结果[例(%)]
2.2HP感染与HSP患儿年龄、性别的关系HSP男性HP阳性22例(22/44,50%);女性22例(22/44,50%);男女性别之间差异无统计学意义(P>0.05)。HSP患儿HP阳性44例平均年龄(8.6±2.9)岁;阴性26例,平均年龄(9.2±3.4)岁,年龄之间差异无统计学意义(P>0.05)。
3 讨论
过敏性紫癜是一种多系统参与免疫球蛋白a介导的血管炎,具有自限性,多影响影响皮肤、关节、胃肠道和肾脏。HSP在3到10岁的儿童中最为常见,典型的表现为下肢和臀部区域的皮疹。半数的患者都有不同的胃肠道表现。虽然HSP的发病机制尚不清楚,但许多因素因素,如感染、药物、甚至恶性肿瘤都被报道与HSP的发生有关[7],但感染因素仍是最重要的致病因素。在中国儿童总感染率达29%,部分地区甚至达到75%[3]。大量研究表明HP感染不仅引起消化道黏膜损伤亦可引发变态反应[8]。
本研究表明HP感染与HSP密切相关。HSP患儿HP感染率为60%高于健康对照组36.7%,HP感染的患儿更易发生HSP。腹型HSP的HP感染率达95.5%且95.2%为I型HP。数据显示HSP患儿HP感染与性别、年龄均无明显相关性。
目前研究表明HP分为Ⅰ型和Ⅱ型,Ⅰ型为分泌空泡毒素VacA/细胞毒素CagA的高毒力菌株,Ⅱ型为无VacA/CagA分泌的低毒力菌株,且HP感染预后受菌株的毒力影响[9]。空泡毒素基因A的产物(vacA)和cagA是主要的HP毒力因子,参与消化道黏膜损伤和变态反应。本研究中HSP患儿HP感染率高且多为Ⅰ型HP,与其毒力及致病机制相一致。有研究表明vacA和cagA是等位基因,编码最重要的HP毒力蛋白VacA和CagA,假设vacA或cagA可能通过复杂和未知的机制参与HSP进展。实验研究HP和动脉粥样硬化的关系表明cagA抗原模拟血管壁的多肽,这意味着cagA抗体会损伤内皮[10]。HP感染也引起炎性介质,如白细胞介素(IL)-6、IL-12、IFN-γ、TNF-α等的大量释放,通过他们之间复杂的网络,这些细胞因子直接或间接参与了HSP发生和发展。这也许就是Ⅰ型HP感染更易引起消化道损伤和变态反应且更易引起腹型过敏性紫癜的原因。
HSP患儿HP感染率高,尤其是腹型HSP患儿,且多为Ⅰ型HP。因此,建议HSP患儿,尤其是腹型HSP儿童尽早做HP分型检测,有助于临床治疗。
参考文献:
[1]Shin SB,Choi YJ,Lee J,et al.Henoch-Schonlein Purpura with Concurrent Cytomegalovirus Duodenitis[J].Infection & chemotherapy,2017,49(2):146.
[2]Cecchi R,Torelli E.Schonlein-Henoch purpura in association with duodenal ulcer and gastric Helicobacter pylori infection[J].The Journal of dermatology,1998,25(7):482.
[3]Xiong LJ,Tong Y,Wang ZL,et al.Is Helicobacter pylori infection associated with Henoch-Schonlein purpura in Chinese children? a meta-analysis[J].WJP,2012,8(4):301.
[4]Suzuki R,Shiota S,Yamaoka Y.Molecular epidemiology,population genetics,and pathogenic role of Helicobacter pylori[J].Infect Genet Evol,2012,12(2):203.
[5]Yamaoka Y,Kikuchi S,el-Zimaity HM,et al.Importance of Helicobacter pylori oipA in clinical presentation,gastric inflammation,and mucosal interleukin 8 production[J].Gastroenterology,2002,123(2),414.
[6]Mills JA,Michel BA,Bloch DA,et al.The American College of Rheumatology 1990 criteria for the classification of Henoch-Schonlein purpura[J].Arthritis and rheumatism,1990,33(8):1114.
[7]Weiler-Bisig D,Ettlin G,Brink T,et al.Henoch-schonlein purpura associated with esophagus carcinoma and adenocarcinoma of the lung[J].Clinical nephrology,2005,63(4):302.
[8]Atherton JC,Peek RM,Jr Tham KT,et al.Clinical and pathological importance of heterogeneity in vacA,the vacuolating cytotoxin gene of Helicobacter pylori[J].Gastroenterology,1997,112(1),92.
[9]Franceschi F,Sepulveda AR,Gasbarrini A,et al.Cross-reactivity of anti-CagA antibodies with vascular wall antigens:possible pathogenic link between Helicobacter pylori infection and atherosclerosis[J].Circulation,2002,106(4):430.
[10]Yang M,Li FG,Xie XS,et al.CagA,a major virulence factor of Helicobacter pylori,promotes the production and underglycosylation of IgA1 in DAKIKI cells[J].Biochemical and biophysical research communications,2014,444(2):276.
