碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽的研究
2018-04-23师小飞李明生
师小飞,李明生
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
0 引言
随着我国家禽养殖业的快速发展,我国每年宰杀肉鸡量已超过1×109只,每只鸡的血液含量为90 g左右,而这些鸡血通常作为废弃物排放,并未得到有效利用,不仅浪费资源,而且容易污染环境[1-2]。鸡血富含蛋白质、氨基酸、脂肪、维生素、无机盐、微量元素、酶类及其他生物活性物质,具有很高的营养价值,应用前景广阔[3-5]。近年来,利用动物血液为原料制备抗氧化肽[6-8]、抗菌肽[9-11]、ACE抑制肽[12-13]等生物活性多肽的研究越来越多,为动物血液资源的综合利用提供了一条新途径,但利用鸡血清制备ACE抑制肽的研究却鲜有报道。试验采用碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽,通过单因素试验对其工艺条件进行优化,为鸡血资源在功能性食品及医药方面的利用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试验材料
鸡血清蛋白:新鲜鸡血采取于甘肃省兰州市榆中县,提取血清蛋白后经真空冷冻干燥,于-20℃条件下保存待用。
1.1.2 试剂
碱性蛋白酶(150 000 U/g),北京中生瑞泰科技有限公司提供;马尿酰-组氨酰-亮氨酸(HHL),美国Sigma公司提供;血管紧张素转化酶(ACE),于市售新鲜猪肺中提取;茚三酮、酪氨酸、盐酸、乙酸乙酯、氢氧化钠、乙酸酐、吡啶等其他试剂,均为国产分析纯。
1.1.3 仪器与设备
PB-10型便携式台式酸度计,北京格拉威尔公司产品;JA2003N型电子天平,上海天平仪器厂产品;UV2000型紫外可见分光光度计,龙泥柯仪器有限公司产品;TCL-16M型高速台式冷冻离心机,湖南湘仪离心机仪器有限公司产品;WS28型电热恒温水浴锅,西安禾普生物科技有限公司产品。
1.2 试验方法
1.2.1 鸡血清蛋白酶解液的制备
称取适量的鸡血清蛋白粉,加入100 mL双蒸水溶解,配制成一定浓度的鸡血清蛋白溶液,调节pH值至一定数值,按照一定的比例加入碱性蛋白酶,在特定温度下水解一定时间,之后于95℃恒温下水浴灭酶15 min,冷却至室温后,过滤,得到滤液待用。
1.2.2 鸡血清蛋白水解度的测定
采用茚三酮比色法[14]测定鸡血清蛋白水解度(Degree of Hydrolysis,DH),公式如下:
不过说实话,呼伦对专家并不抱多大希望。他要写成这篇文章,其实还是虚荣心在做怪。三万字啊,多大的篇幅!拿给同事们看,他们从此还不得高看他呼伦一眼?——何况还有稿费。——何况还能给单调的日子找些事做。——何况还是国内空白。——何况,还真的有可能成为专家。

式中:A0——水解前鸡血清蛋白溶液本身含有的游离氨基酸数,mmol;
A1——鸡血清蛋白完全酸水解后含有的游离氨基酸数,mmol;
A2——鸡血清蛋白酶解液含有的游离氨基酸数,mmol。
1.2.3 鸡血清多肽ACE抑制率的测定
采用高丹丹等人[15]的方法测定鸡血清多肽的ACE抑制率。取0.1 mL 5.0 mmol/L的HHL溶液于离心管中,加入0.1 mL鸡血清蛋白酶解液,混匀,再加入0.1 mL ACE酶液,于37℃条件下反应1 h,然后立即加入0.25 mL 1.0 mol/L的盐酸终止反应,振荡2 min后静置;之后加入1.5 mL乙酸乙酯,并剧烈振荡以萃取反应生成的马尿酸,于5 000 r/min转速下离心10 min;吸取1.0 mL含有马尿酸的乙酸乙酯于另一个新离心管中,再往新离心管中加入1.0 mL乙酸酐、2.0 mL 0.5%DAB显色剂,于40℃条件下显色30 min,之后测定其在459 nm处的OD值,并根据以下公式计算:
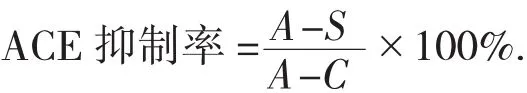
式中:A——用双蒸水代替鸡血清蛋白酶解液所测得的OD值;
S——添加鸡血清蛋白酶解液所测得的OD值;
C——添加乙酸乙酯、乙酸酐和显色剂的参比OD值。
1.2.4 单因素试验
以鸡血清蛋白的水解度及其酶解液的ACE抑制率为指标,在pH值为8.0,底物质量分数6%,酶与底物浓度比6 000 U/g,时间3 h的条件下,研究不同温度(分别为40,45,50,55,60℃) 对水解效果的影响;在温度50℃,底物质量分数6%,酶与底物浓度比6 000 U/g,时间3 h的条件下,研究不同pH值(分别为7.0,7.5,8.0,8.5,9.0) 对水解效果的影响;在温度50℃,pH值8.0,酶与底物浓度比为6 000 U/g,时间3 h的条件下,研究不同底物质量分数(分别为2%,4%,6%,8%,10%)对水解效果的影响;在温度50℃,pH值8.0,底物质量分数6%,时间3 h的条件下,研究不同酶与底物浓度比 (分别为 4 000,5 000,6 000,7 000,8 000 U/g)对水解效果的影响;在温度50℃,pH值8.0,底物质量分数6%,酶与底物浓度比为6 000 U/g的条件下,研究不同时间(分别为1,2,3,4,5 h) 对水解效果的影响。
2 结果与分析
2.1 温度对水解效果的影响
温度对水解效果的影响见图1。
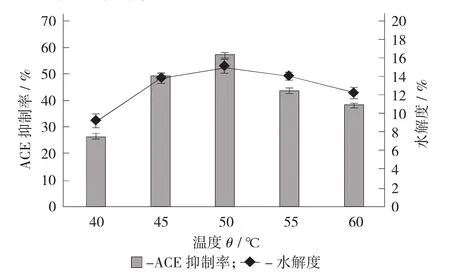
图1 温度对水解效果的影响
由图1可知,在40~60℃,随着温度升高,其ACE抑制率和水解度均先增大后减小,在50℃达到最大值,分别为57.53%±0.98%和15.07%±0.72%,此时水解效果最好。这是因为温度对酶促反应效率影响显著,每种蛋白酶都有最适反应温度。一方面,当温度低于最适反应温度时,随着温度的升高,酶活性增强,酶促反应速率加快,水解效果也随之变好;另一方面,当温度高于最适反应温度时,随着温度的继续升高,酶蛋白会慢慢发生变性,酶活性减弱,酶促反应速率减慢,水解效果也随之变差[16]。因此,50℃为碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽的最适反应温度。
2.2 pH值对水解效果的影响
pH值对水解效果的影响见图2。
由图2可知,其ACE抑制率和水解度随着pH值的升高,呈现出先增大后减小的趋势,且在pH值为8.0时,具有最好的水解效果,分别达到56.84%±0.80%和15.70%±0.67%,pH值低于或高于8.0,其ACE抑制率和水解度均有不同程度的降低。这是因为每一种蛋白酶根据自身特性的不同,都有最适合的反应pH值,在此条件下,反应底物可以与蛋白酶的催化活性中心充分结合,从而使蛋白酶最大限度地发挥其催化作用,得到更多的目标水解产物,pH值过高或过低,位于蛋白酶催化活性部位的可解离基团都不能得到充分解离,其催化活性都会受到一定程度的抑制[17]。因此,确定8.0为碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽的最适pH值。
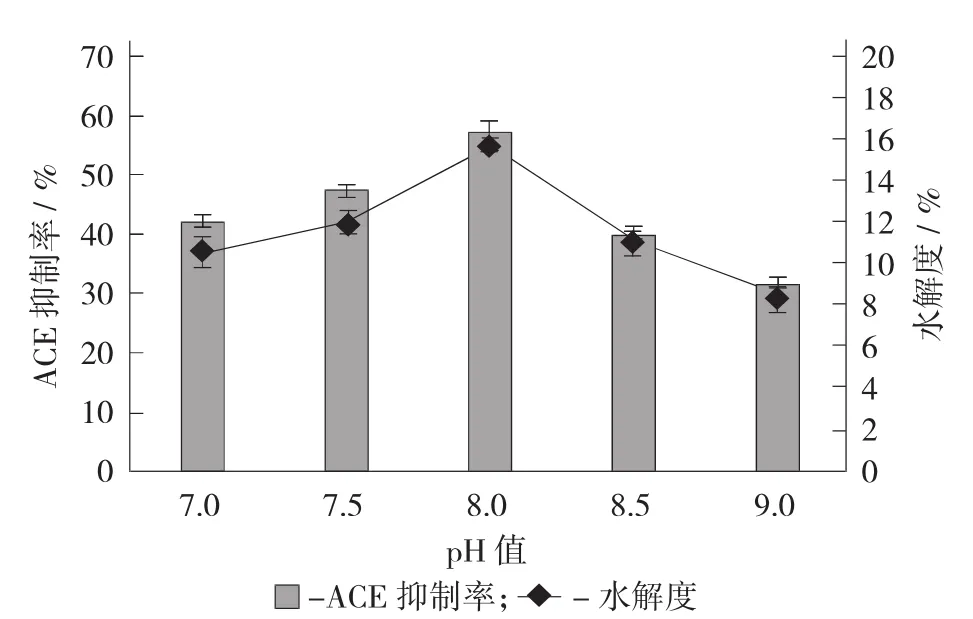
图2 pH值对水解效果的影响
2.3 底物质量分数对水解效果的影响
底物质量分数对水解效果的影响见图3。
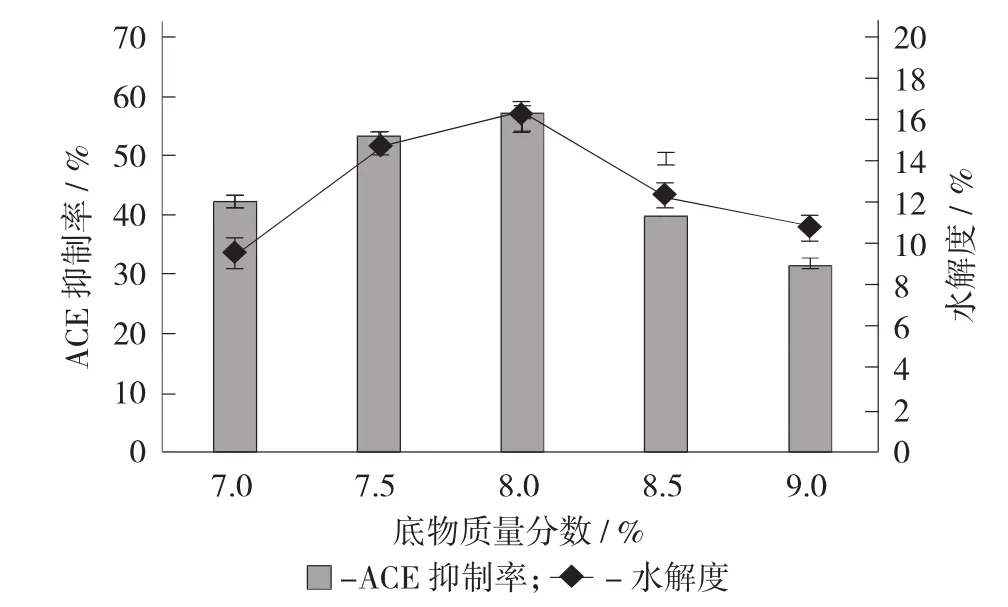
图3 底物质量分数对水解效果的影响
由图3可知,在底物质量分数为2%~6%时,其ACE抑制率和水解度随着底物质量分数的增大逐渐升高,在底物质量分数为6%时,达到最大值,分别为57.86%±0.65%和16.29%±0.41%,之后随着底物质量分数的继续增大,其ACE抑制率和水解度则呈现出下降趋势。这是因为一方面当底物质量分数过低时,过量蛋白酶的存在反而会抑制酶促反应的充分进行,从而导致水解效果变差;另一方面当底物质量分数过高时,溶液过于黏稠,蛋白酶的催化作用受到抑制,从而也会导致水解效果变差。因此,确定碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽的最适底物质量分数为6%。
2.4 酶与底物浓度比对水解效果影响
酶与底物浓度比对水解效果的影响见图4。
由图4可知,当酶与底物浓度比低于6 000 U/g时,随着蛋白酶用量的增加,其ACE抑制率和水解度均呈现出增大的趋势,此后随着酶与底物浓度比继续增大,水解度缓慢上升,但增长速率明显降低,而ACE抑制率则略有下降。这是因为在一定的范围内,随着酶用量的增加,酶促反应速率加快,水解效果逐渐变好,而当加酶量超出一定范围后,蛋白酶的量慢慢趋于饱和,底物的量也逐渐略显不足,此时继续增加蛋白酶用量对水解度不会产生显著影响,而ACE抑制率略有下降,可能是因为目标产物在过量的蛋白酶的作用下发生进一步水解造成的。因此,确定6 000 U/g为碱性蛋白酶水解鸡血清蛋白的最适酶与底物浓度比,此时其ACE抑制率和水解度分别为56.08%±0.19%和16.22%±0.86%。

图4 酶与底物浓度比对水解效果的影响
2.5 时间对水解效果的影响
时间对水解效果的影响见图5。
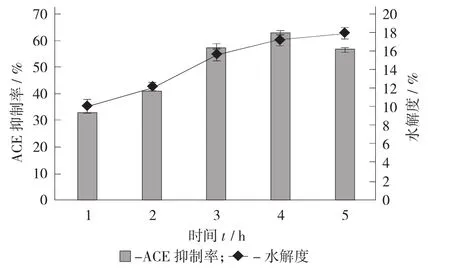
图5 时间对水解效果的影响
由图5可知,水解度随着反应时间的延长逐渐增大,但3 h之后增长速率明显下降,ACE抑制率在4 h之前随着时间的延长呈现出上升趋势,之后略有降低。这是因为随着酶促反应时间的延长,底物浓度逐渐变小,产物浓度逐渐变大,两者之间的竞争性抑制作用逐渐变强,酶的活性也逐渐降低[6]。因此,考虑到节约时间和能源,确定碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽的最佳反应时间为4 h,此时其ACE抑制率和水解度分别为63.07%±0.69%和17.22%±0.31%。
3 结论
采用碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽,以ACE抑制率和水解度为评价指标,通过单因素试验研究了温度、pH值、底物质量分数、酶与底物浓度比、时间对水解效果的影响,确定了碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽最佳工艺条件为温度50℃,pH值8.0,底物质量分数6%,酶与底物浓度比6 000 U/g,时间4 h,此反应条件下其ACE抑制率和水解度分别为63.07%±0.69%和17.22%±0.31%。通过单因素试验得到了碱性蛋白酶水解鸡血清蛋白制备ACE抑制肽的最佳工艺条件,为鸡血资源的综合利用提供新途径,为鸡血清蛋白ACE抑制肽的开发提供理论基础。
参考文献:
[1]曾利平,周红,李俊田,等.鸡血酶解工艺条件的研究 [J].食品与发酵科技,2010,46(2):77-80.
[2]应月,王琴,区子弁,等.鸡血清蛋白的提取及其乳化性初探 [J].食品工业科技,2011,32(6):306-308.
[3]Marquez E,Bracho M,Archile A,et al.Proteins,isoleucine,lysine and methionine content of bovine,porcine and poultry blood and their fractions[J].Food Chemistry,2005(3):503-505.
[4]Zheng Z,Si D,Ahmad B,et al.A novel antioxidative peptide derived from chicken blood corpuscle hydrolysate[J].Food Research International,2018 (1):410-419.
[5]Beikot Z, Penczyńska E.Eating value of chicken blood[J].Medycyna weterynaryjna,2002,58 (3):208-210.
[6]高丹丹,兰家国,赵佩佩,等.中性蛋白酶水解藏羊血清蛋白制备抗氧化肽的研究 [J].食品工业科技,2015(15):229-233,238.
[7]牟雪姣,张强,邢静.鸡血红蛋白抗氧化肽的制备工艺研究 [J].农产品加工,2009(3):54-56.
[8]Chang C Y,Wu K C,Chiang S H.Antioxidant properties and protein compositionsofporcine haemoglobin hydrolysates[J].Food Chemistry,2007(4):1 537-1 543.
[9]胡凤姣.鸡血源抗菌肽分离鉴定及其生物活性的研究[D].北京:中国农业大学,2017.
[10]Nedjararroume N, Duboisdelval V, Miloudi K, et al.Isolation and characterization of four antibacterial peptides from bovine hemoglobin[J].Peptides,2006,27 (9):2 082-2 089.
[11]Adje E Y,Balti R,Kouach M,et al.Obtaining antimicrobial peptides by controlled peptic hydrolysis of bovine hemoglobin[J].International Journal of Biological Macromolecules,2011,49 (2):143-153.
[12]Guang C,Phillips R D.Purification,activity and sequence of angiotensin I converting enzyme inhibitory peptide from alcalase hydrolysate of peanut flour[J].J Agric Food Chem,2009,57(21):10 102-10 106.
[13]Yu Y,Hu J,Bai X,et al.Preparation and function of oligopeptide-enriched hydrolysate from globin by pepsin[J].Process Biochemistry,2006,41 (7):1 589-1 593.
[14]何照范,张迪清.保健食品化学及其检测技术 [M].北京:中国轻工业出版社,1997:141-142.
[15]高丹丹,曹郁生,麦曦.改进的分光光度计法测定食源性多肽血管紧张素转化酶的抑制活性 [J].浙江大学学报(农业与生命科学版),2011,37(2):219-223.
[16]LanX,LiaoD,WuS,etal.Rapidpurificationandcharacterization of angiotensin converting enzyme inhibitory peptides fromlizardfishproteinhydrolysateswithmagneticaffinityseparation[J].FoodChemistry,2015(7):136-142.
[17]Forghani B,Zarei M,Ebrahimpour A,et al.Purification and characterization of angiotensin converting enzyme-inhibitory peptides derived from Stichopus horrens:Stability study against the ACE and inhibition kinetics[J].Journal of Functional Foods,2016 (4):276-290.◇
