银耳多糖最适提取工艺条件探析
2018-04-23孙晨雨张建玲李长婷栾仙德
孙晨雨,王 飞,张建玲,李长婷,闫 杨,栾仙德,孟 超
(泰山医学院,山东泰安 271000)
银耳多糖 (Tremella polysaccharides,TP) 是银耳中一种重要的生物活性物质,能够提高机体的免疫能力,并诱导干扰素的产生,经常食用银耳对预防癌症等多种疾病具有非常显著的效果。银耳多糖在不同程度上对细胞因子IL-1α,IL-6,IL-8的产生起到促进作用,且呈剂量依赖性[1]。银耳多糖具有诱导单核细胞产生白介素IL-1,IL-6和肿瘤坏死因子的作用,而且多糖降解产物具有诱导单核细胞分泌IL-1或IL-6的作用,所以银耳多糖对细胞因子的作用可能是通过各水解片段所共有的结构实现的。银耳多糖通过对IL-2,IL-6和TNF-α的mRNA表达来促进这些细胞因子的生成[2]。
银耳多糖是一种免疫增强剂,可以通过激活免疫细胞来提高机体的免疫功能。根据聂伟等人[3]的研究可知,银耳多糖能够有效地激活淋巴细胞,提高淋巴细胞转化为T淋巴细胞和B淋巴细胞的数量,增强淋巴细胞抵抗肿瘤细胞的能力,并且在服用多糖的期间机体的主要脏器不会受到一般药物副作用的损伤。尤其针对体内白细胞减少的症状,Guo F C等人[4]通过对小鼠进行抑制淋巴瘤试验发现,银耳多糖对小鼠外周白细胞减少的症状有明显的提高白细胞数量的作用。根据李璐等人[5]的试验研究可以得知,银耳多糖对小鼠淋巴瘤有较高的抑制作用,抑制率大约为60%,结合γ射线,能够有效治疗在肿瘤的放疗和化疗过程中所造成的白细胞减少的症状。
根据银耳原料的不同,银耳多糖常用的提取方法有热水浸提法、碱浸提法、酶法提取法和超声波辅助提取法等4种。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
福建古田银耳子实体干品,购买量为120g(置于阴凉干燥处,避免阳光直射)。
1.1.2 复合酶液的制备
精密称取500 U/mg果胶酶0.5 g,10 U/mg纤维素酶1.5 g,100 U/mg中性蛋白酶 2.0 g,并置于100 mL的容量瓶中,加蒸馏水至100 mL刻度线处。摇匀后于50℃下水浴1 h,置于4℃下存放。所使用的果胶酶、纤维素酶和中性蛋白酶,均由济南雨同生物科技有限公司提供。
1.1.3 Sevage试剂
氯仿和正丁醇的配比按照5∶1的比例精确量取,置于玻璃瓶中存放,现配现用。
1.1.4 其他药品及试剂
蒽酮/Anthrone,5 g(S19210),纯度在 95%~99%的正丁醇,于室温下避光保存;98%浓硫酸,避光密封保存;纯度为99.8%的三氯甲烷,密封遮光,置于阴凉通风处保存。
1.1.5 试验仪器
FZ102型高速粉碎机,天津市泰斯特仪器有限公司产品;LQ-A005型电子天平,瑞安市安特称重设备有限公司产品;HH.W21-600型恒温水浴锅,北京中兴伟业仪器有限公司产品;722型可见分光光度计,上海恒平科学器有限公司产品;烧杯、锥形瓶、容量瓶、研砵、10 mL具塞试管、比色皿等。
1.2 试验方法
1.2.1 银耳子实体的处理步骤
(1)称量、研磨。精确称取无杂质银耳子实体干品2.000 g 2份。其中,1份先按料液比1∶80加水,在室温下(20~25℃) 浸泡30 min,再置于小型研钵中充分捣碎,制成银耳浆液;另1份先在高速研磨机中粉碎2 min,再按料液比1∶80加水在室温下浸泡30 min,制成银耳浆液。
(2) 加酶。采用复合酶浸提法[6],调pH值至6.3,加入复合酶1.5%,于50℃条件下反应40 min,迅速升温至80℃灭酶,并在50,60,70,80,90℃下恒温浸提1.0,1.5 h。
(3) 离心。以转速5 000 r/min离心5 min,取离心后银耳浸提液4 mL,与Sevage试剂以5∶1的比例加入各离心管中,摇匀。以转速4 000 r/min离心10 min,除杂蛋白。
(4)测吸光度度。取2 mL的浸提液置于相应的具塞试管中,每个具塞试管加入6 mL的硫酸蒽酮试液,沸水浴10 min,然后冷水浴15 min,作一空白对照(2 mL的蒸馏水加入6 mL的硫酸蒽酮试液)。用分光光度计在波长620 nm处测量其吸光度;记录18支样品溶液的吸光度值,绘出相应的折线图。
1.2.2 硫酸蒽酮法测定多糖含量标准曲线的绘制
(1) 对照品溶液的制备。无水葡萄糖对照品10mg,置于100 mL容量瓶中,稀释至刻度,摇匀,即得0.1 mg/mL的葡萄糖标准液。
(2) 蒽酮试液的制备。取蒽酮0.20 g,加入100 mL浓硫酸溶解即得蒽酮试液,现配现用,置于棕色瓶中4℃放置。
(3)标准曲线的制备。精密量取对照品溶液0,0.2,0.4,0.6,0.8,1.0,1.2 mL,分别加入蒸馏水至2.0 mL。分别精密量取6.0 mL的蒽酮试液,摇匀后冷却15 min。沸水浴10 min后,冷水冷却15 min,测定波长620 nm处吸光度值。以葡萄糖的质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。
2 结果与分析
2.1 标准曲线的绘制
根据不同质量浓度葡萄糖溶液下测得的银耳多糖吸光度所绘制的标准曲线。
不同质量浓度葡萄糖溶液下银耳多糖吸光度标准曲线见图1。
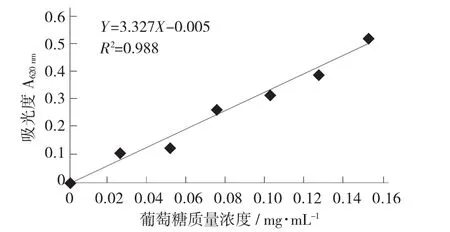
图1 不同质量浓度葡萄糖溶液下银耳多糖吸光度标准曲线
2.2 不同条件下银耳浸提液中银耳多糖吸光度测定的试验结果
浸泡前成粉碎状态的银耳于温度分别为50,60,70,80℃的条件下,浸提1 h后,银耳多糖溶液在波长620 nm处的吸光度分别为0.463,0.657,0.546,0.520;浸提1.5 h后,银耳多糖溶液在波长620 nm处的吸光度分别为0.447,0.629,0.521,0.517。
浸泡后,将再研磨的银耳于温度分别为50,60,70,80,90℃的条件下,浸提1 h后,银耳多糖溶液在波长620 nm处的吸光度分别为0.490,0.501,0.512,0.539,0.520;浸提1.5 h后,银耳多糖溶液在波长620 nm处的吸光度分别为0.432,0.503,0.563,0.604,0.591。
2.3 银耳多糖提取率的计算
根据朗伯-比尔定律表示:A=lg(1/T)=Kbc.式中:A——吸光度;
T——透射比;
K——摩尔吸收系数;
c——吸光物质的质量浓度;
b——吸收层厚度,为1 cm。
根据朗伯-比尔定律求得不同条件下银耳浸提液中银耳多糖的质量浓度。
不同浸提温度下粉碎状态的银耳多糖质量浓度见图2,不同温度下浸泡后研磨的银耳多糖质量浓度见图3。

图2 不同浸提温度下粉碎状态的银耳多糖质量浓度

图3 不同温度下浸泡后研磨的银耳多糖质量浓度
3 结果分析与讨论
3.1 银耳浸提条件的选择
银耳与蒸馏水以1∶80的比例在室温下浸泡30 min,加入复合酶1.5%,于50℃条件下酶促反应40 min,之后在设定温度下浸提1.0,1.5 h。
3.2 银耳多糖提取工艺的优化
根据图2可知,银耳在浸泡后呈粉碎状态时浸提1 h,在50~60℃条件下浸提,银耳多糖的质量浓度不断增加,从0.141 mg/mL增加到0.199 mg/mL。在60℃之后,随着浸提温度的增加,银耳多糖的质量浓度随之下降,银耳多糖的最低质量浓度在80℃时为0.157 8 mg/mL。银耳在浸泡前呈粉碎状态时浸提1.5 h,也是在60℃下浸泡1.5 h的效率最高,得到的银耳多糖质量浓度最高为0.191 mg/mL。所以,在相应的温度下浸提1.5 h后所得到的银耳多糖质量浓度比浸提1 h所得到的银耳多糖质量浓度要低,虽然相差不大,但是考虑到效率和成本的问题,可以选择在60℃下浸提1 h提取银耳多糖。
根据图3可知,银耳在浸泡后呈粉碎状态时浸提1 h,在80℃的提取效率最高,为0.164 mg/mL。在50~80℃条件下浸提,银耳多糖质量浓度不断增加,从0.149 mg/mL增加到0.164 mg/mL。在80℃以后,银耳多糖质量浓度不断减少。银耳在浸泡后呈粉碎状态时浸提1.5 h,是在80℃条件下浸泡1.5 h的效率最高,为0.183 mg/mL。
综上所述,银耳的不同状态在不同温度和不同浸提时间下浸提,并根据计算得到的银耳多糖质量浓度综合比较得知,其在浸泡前呈粉碎状态下以料液比1∶80的加水比浸泡,于60℃条件下浸提1 h所得到的银耳多糖质量浓度最高,银耳多糖的浸提率也最高。
3.3 影响试验的主要因素
在浸泡前被粉碎,结构被破坏,复合酶容易发生作用,使银耳子实层、单子层和担孢子的表面及连接物充分分解,当酶促反应达到一定程度(最适酶促反应时间为40 min),热水浸提温度是影响浸提率的关键。通过提高温度,起到了灭酶作用,又使得可溶于热水的胞内多糖溶出率增加。
3.4 银耳多糖提取工艺的细化
若是没有任何试验依据的情况下,可以采用单因素变量试验。根据单因素试验的结果缩小每个提取条件的范围,再根据缩小后的范围进行多因素多水平的正交试验。
参考文献:
[1]Xia Dong,Lin Z B.Effets of Tremella polysaccha-rides on immune function in mice[J].Acta Pharm Sinica,1989,10(5):453-456.
[2]Chen B.Optimization of extraction of Tremella fuciformis polysaccha-rides and its antioxidant and antitumour activities in vitro[J].Carbohydr Polymer,2010 (7):420-424.
[3]聂伟,张永祥,周金黄.银耳多糖的药理学研究概况 [J].中药药理与临床,2000,16(4):44-46.
[4]Guo F C,Kwakkel R P,Williams B A,et al.Effects of mushroom and herb polysaccharides on cellular and humoral immune responses of Eimefia tenella-infected chickens[J] .Pourlt Sci.,2004 (3):1 124-1 132.
[5]李璐,毕富勇,吕俊.银耳多糖诱导肝癌HepG-2细胞凋亡的研究 [J].实用医学杂志,2009,25(7):1 033-1 035.
[6]侯建明,陈刚,蓝进.银耳多糖对脂类代谢影响的实验报告 [J].中国疗养医学,2008,17(4):234-236.◇
