滑子菇黄酮醇提工艺及抗氧化活性研究
2018-04-21孟鹏举朱振元张翥妮张金豫
孟鹏举,朱振元,张翥妮,杨 凡,张金豫,李 盟
(天津科技大学食品工程与生物技术学院,天津 300457)
滑子菇是珍稀品种,且产量大,具有味道美味、营养丰富的特点。滑子菇黏液对肿瘤有一定抑制作用。黏液中包含黄酮,具有预防大肠杆菌、葡萄球菌等多种细菌感染的作用[1]。黄酮的功效是多方面的,它是一种很强的抗氧剂,可有效清除体内的氧自由基,黄酮化合物是一类重要的并且在植物界分布很广的天然化合物[2]。此类物质对多种疾病有良好的疗效,医用价值甚高[3]。醇提法效率高、成本低,且能将样品里的有效活性成分大量提取出来[4]。试验利用醇提法通过控制料液比、提取时间、超声波功率等因素来提取滑子菇活性成分,完成提取优化工艺过程[5]。经紫外分光光度计进行全波长扫描后,比对波长初步判定滑子菇醇提物中黄酮含量较高,再经显色反应进一步确定黄酮的存在,从而展开滑子菇黄酮的抗氧化活性和抑菌试验的研究。
1 材料与方法
1.1 材料与试剂
新鲜滑子菇,市售;无水乙醇、盐酸、氢氧化钠、邻苯三酚、抗坏血酸、氯化钠、牛肉膏、蛋白胨、琼脂均为分析纯,天津北方天医化学试剂厂提供;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),梯希爱(上海) 化成工业发展有限公司提供;Tris,美国Sigma公司提供;芦丁标准品,上海时代生物科技有限公司提供。
1.2 仪器与设备
KQ-400KDB型超声波清洗仪,沈阳龙腾电子称量仪器有限公司产品;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂产品;DZF-6020型真空干燥箱,上海益恒科技有限公司产品;SP-2102UV型紫外可见分光光度计,上海光谱仪器有限公司产品;GHX-9160B-1型隔水式恒温培养箱,上海福玛实验设备有限公司产品;立式压力蒸汽灭菌器,上海华线医用核子仪器有限公司产品;超净工作台,苏净集团安泰公司产品。
1.3 试验方法
1.3.1 滑子菇黄酮提取
取50 g新鲜滑子菇[6],按一定料液比,加入乙醇溶液后在一定的超声波功率和时间下进行提取,得到滑子菇黄酮[7]。经旋转蒸发仪旋蒸后,得到固体滑子菇黄酮粗品。
1.3.2 单因素试验
(1) 乙醇体积分数对滑子菇黄酮得率的影响。分别设置乙醇体积分数为10%,30%,50%,70%,90%的5个平行试验,在超声波功率250 W,料液比1∶5(g∶mL) 的条件下处理0.5 h,然后测定滑子菇黄酮得率。
(2)提取时间对滑子菇黄酮得率的影响。分别设置提取时间为0.5,1.0,1.5,2.0,2.5 h的5个平行试验,在超声功率250 W,料液比1∶5(g∶mL),乙醇体积分数50%的条件下处理,然后测定滑子菇黄酮得率。
(3)超声功率对滑子菇黄酮得率的影响。分别设置超声功率为250,360,480,560,720 W 5个平行试验,在料液比1∶5(g∶mL),乙醇体积分数50%的条件下处理0.5 h,然后测定滑子菇黄酮得率。
(4)料液比对滑子菇黄酮得率的影响。分别设置料液比为 1∶3,1∶4,1∶5,1∶6,1∶7 (g∶mL)的5个平行试验,在超声波功率250 W,乙醇体积分数50%的条件下处理0.5 h,然后测定滑子菇黄酮得率。
1.3.3 正交试验设计
在4个单因素试验的基础上,进行正交试验,考查乙醇体积分数、提取时间、超声功率和料液比4个因素,根据L9(34)的设计正交试验,从而优化滑子菇醇提提取条件[8-9]。
正交试验因素与水平见表1。
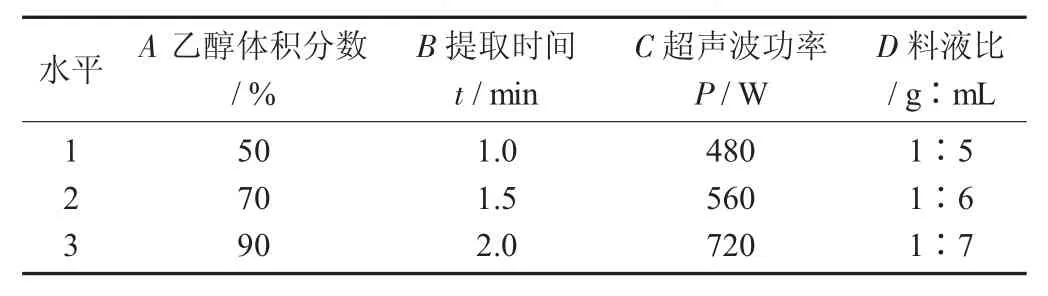
表1 正交试验因素与水平
1.3.4 紫外分光光度计全波长扫描
利用紫外分光光度计全波长扫描法[10]对醇提物进行全波段扫描,测定条件为扫描波长段150~800 nm,扫描高度-0.1~5.0 A,扫描速度1 800 nm/min。
1.3.5 黄酮的颜色反应
黄酮类化合分子可与铝盐、镁盐等反应生成络合物[11]。取1支试管,加入新鲜配置的1%三氯化铝溶液2 mL和10 mg/mL的样品溶液2 mL,静置数分钟观察颜色变化。
1.3.6 AlCl3显色法[12]测定滑子菇黄酮含量
(1) 芦丁标准曲线绘制。依据文献方法[13],配制芦丁标准液,分别精密量取芦丁标准液0,1.0,2.0,3.0,4.0,5.0 mL,以体积分数35%乙醇补足至5.0 mL,加入1%AlCl3溶液4 mL,用体积分数35%乙醇定容,以第1个管为空白对照,于415 nm处测定吸光度。以芦丁标准液浓度为横坐标,吸光度为纵坐标,绘制标准曲线[14]。
(2)黄酮含量的测定。精确量取质量浓度10mg/mL滑子菇黄酮粗品溶液1 mL,按照1.3.6(1) 的方法操作[15],于415 nm处测定吸光度,带入线性回归方程,计算出滑子菇黄酮粗品中总黄酮含量。
(3) D-101型大孔树脂法纯化黄酮。根据文献方法[16],预处理大孔吸附树脂。大孔吸附树脂纯化流程:预处理的D-101型大孔吸附树脂50 mL装柱,70%乙醇溶液200 mL洗脱前提下,洗脱体积流量2.0 BV/h,滑子菇黄酮质量浓度10 mg/mL,pH值6.0。
(4) 纯化后黄酮含量测定。收集1.3.6(3) 中乙醇洗脱流出液,在干燥箱中烘干后得到固体黄酮,精确量取1 g固体黄酮,溶于100 mL无水乙醇,制成10 mg/mL样品溶液,用1.3.6(2) 的方法测定滑子菇黄酮粗品纯化后总黄酮含量[17]。
1.3.7 对羟基自由基的清除作用
采用可见分光光度法[18],在比色皿中依次加入浓度为9 mmol/L FeSO4溶液2 mL,浓度为9 mmol/L水杨酸-乙醇溶液2 mL,滑子菇黄酮2 mL,浓度为8.8 mmol/L H2O2溶液2 mL,其中H2O2启动整个反应[19]。于37℃条件下反应0.5 h。用蒸馏水代替滑子菇黄酮作空白,在510 nm处测定样品吸光度,记录数据。
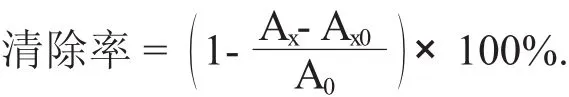
式中:Ax——样品液清除自由基吸光度;
A0——空白对照的吸光度;
Ax0——不加水杨酸时提取液自身的吸光度。
1.3.8 对DPPH自由基的清除作用
配置0.5 mg/mL的VC溶液(作为对照)[20]。将测试样品稀释至5个不同质量浓度。取2 mL滑子菇黄酮溶液及浓度为0.1 mmol/L DPPH自由基溶液2 mL加入到同一试管中,室温下静置30 min后测定其吸光度Asample,同时测定2 mL DPPH溶液与2 mL溶剂混合后的吸光度Acontrol,以及2 mL滑子菇黄酮样品溶液与2 mL无水乙醇混合后的吸光度Ablank。
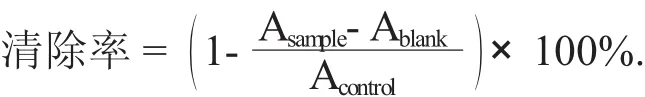
1.3.9 对超氧阴离子自由基的清除作用
取4.5 mL Tris-HCl(pH值8.2) 缓冲液加4.2 mL蒸馏水,于25℃条件下水浴保温20 min,加到25℃预热0.3 mL的3 mmol/L邻苯三酚溶液中,于325 nm处每隔30 s测A值1次,共测5 min,计算对照溶液吸光度随时间的变化率F0。以1 mL滑子菇黄酮溶液替代1 mL蒸馏水,计算滑子菇黄酮溶液吸光度随时间的变化率Fx。以10 mmol/L HCl代替邻苯三酚作为空白[21]。
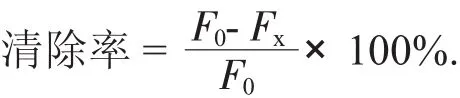
1.3.10 滑子菇黄酮对细菌抑菌特性的研究
(1) 菌种的活化培养[22]。预先将4种供试菌(大肠杆菌、沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌)接种于适宜的培养基中进行活化,然后制成一系列菌悬液,浓度约为107CFU/mL备用。
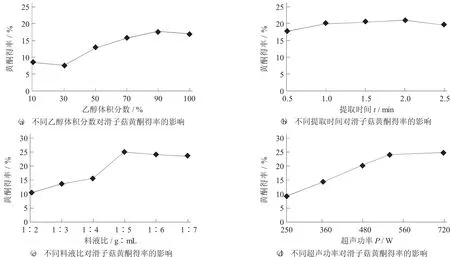
图1 各种因素对滑子菇黄酮得率的影响
(2) 肉汤固体培养基。牛肉膏2.5 g,蛋白胨5 g,NaCl 2.5 g,水 500 mL,琼脂 10 g,pH 值 7.2~7.4。灭菌条件为121℃,20 min。
(3)滑子菇黄酮的抑菌活性测定。分别制备质量浓度依次为8,16,32,64 mg/mL的样品,利用纸片法,对4种供试菌进行试验,倾倒平板后于37℃条件下培养24 h,检测抑菌活性情况。
2 结果与分析
2.1 单因素试验分析结果
各因素对滑子菇黄酮得率的影响见图1。
由图1(a) 可知,随着乙醇体积分数的不断增大,滑子菇黄酮的得率呈现先减小后逐渐增大的趋势线。当最大体积分数为90%时,滑子菇黄酮得率最大。在正交试验中选取50%,70%,90%这3个对滑子菇黄酮得率影响最大的水平。由图1(b)可知,随着提取时间的延长,滑子菇黄酮得率呈现先增大后减小的趋势,在提取时间为1.5 h时滑子菇黄酮得率达到最大值,选取1.0,1.5,2.0 h为宜。由图1(c) 可知,在料液比1∶5时滑子菇黄酮得率最大。可能是因为在1∶5的料液比的情况下,乙醇提取液相对于滑子菇黄酮差不多达到饱和的状态,选1∶5,1∶6,1∶7(g∶mL) 较合适。由图 1(d) 可知,随着超声功率的不断增加,滑子菇黄酮得率在不断增加,但是增长率在不断下降甚至趋向于零,选取480,560,720 W为宜。
2.2 正交试验结果分析
以乙醇体积分数、提取时间、料液比、超声波功率为4个因素,进行四因素三水平L9(34)的正交试验进一步优化滑子菇黄酮醇提的工艺条件。
正交试验分析结果见表2。
由表2可知,4个因素对滑子菇黄酮得率的影响顺序为B>C>A>D。超声功率和提取时间对滑子菇黄酮得率的影响较大,乙醇体积分数和料液比对滑子菇黄酮得率的影响较小;滑子菇黄酮提取的最佳条件为A2B3C1D1,对此条件进行验证试验,得率为2.989%,高于正交试验设计中的组合,因此确定滑子菇黄酮醇提的最优工艺条件为乙醇体积分数70%,提取时间2 h,料液比1∶5,超声波功率480 W。
2.3 紫外分光光度计全波长扫描结果
滑子菇醇提物全波长扫描见图2。
由图2可以看出,滑子菇醇提物经过紫外分光光度计全波长扫描后,在190~230 nm出现吸收峰,在250~800 nm处无明显吸收峰。多糖吸收波长在562~630 nm,大部分黄酮类化合物的特征吸收在200~300 nm,所以可以初步确定滑子菇醇提物成分中含有黄酮。
2.4 黄酮颜色反应结果
样品溶液与1%AlCl3溶液反应后,溶液颜色变为黄色,并生成黄色络合物,符合黄酮类化合物显色反应结果,表明滑子菇醇提物成分中确实含有黄酮类化合物。
2.5 芦丁标准曲线的绘制
芦丁标准曲线见图3。
根据试验数据可得到如图3所示的芦丁标准曲线,其线性回归方程与相关系数分别为Y=0.104 1X+0.000 5,R2=0.998 4。由此可知,芦丁标准品溶液在0~0.08 mg/mL的质量浓度呈较良好的线性关系。
2.6 黄酮含量测定结果
根据试验数据和2.5中回归方程,计算出滑子菇黄酮粗品中总黄酮含量为3.29%。
2.7 纯化后黄酮含量测定结果
根据试验数据和2.5中回归方程,计算出滑子菇
黄酮粗品纯化后总黄酮含量为41.47%。
2.8 滑子菇黄酮抗氧化活性的测定结果分析2.8.1 DPPH自由基清除率的测定结果
DPPH自由基清除率见表3。
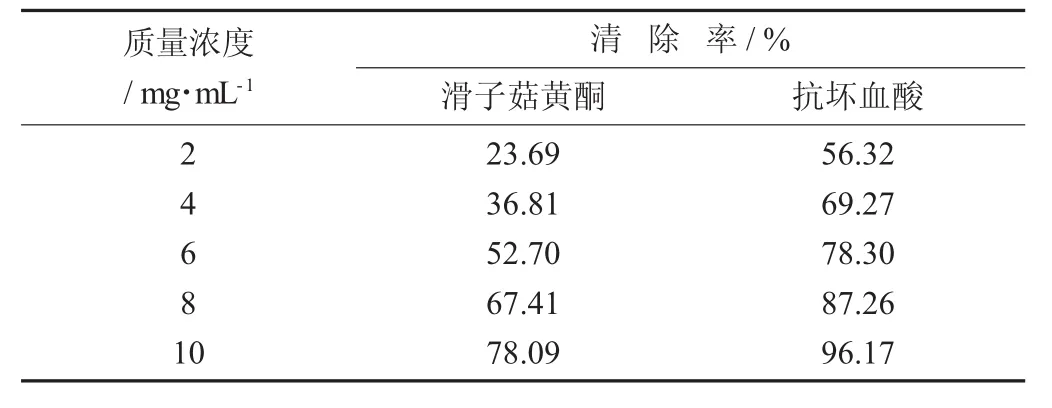
表3 DPPH自由基清除率
由表3可知,随着滑子菇黄酮质量浓度的升高,不同质量浓度之间存在显著性差异(p<0.05)。质量浓度为10 mg/mL时,滑子菇黄酮对DPPH自由基的清除率升高到78.09%。结果表明,滑子菇黄酮对DPPH自由基具有很好的清除能力。
2.8.2 羟基自由基(·OH)清除率的测定结果
羟基自由基(·OH) 清除率见表4。
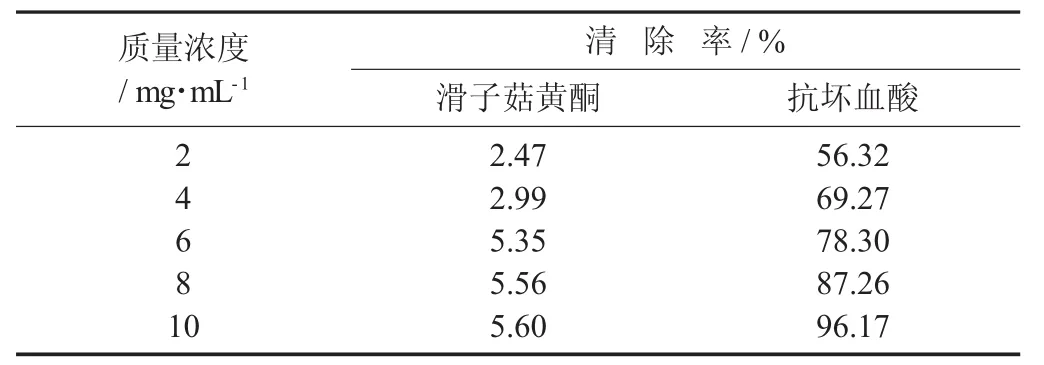
表4 羟基自由基(·OH) 清除率
由表4可知,滑子菇黄酮对羟基自由基的清除作用随着质量浓度的增长,逐渐变大,但清除率较低。其清除作用在其质量浓度为10 mg/mL时为5.60%,明显差于VC。这说明滑子菇黄酮对羟基自由基有一定的清除作用,但清除能力不强。
2.8.3 超氧阴离子自由基(O2-)清除率的测定结果
试验数据:F0=0.067 8;Fx1=0.103 1;Fx2=0.093 8;Fx3=0.084 8;Fx4=0.075 8;Fx5=0.062 7 (x1~x5分别代表滑子菇醇提物的质量浓度10~50 mg/mL)。说明虽然F值即变化率随着滑子菇黄酮质量浓度在逐渐降低,但是Fx值始终比F0的值要大,这也就是说明,滑子菇黄酮对于超氧阴离子自由基并无清除作用。
2.9 滑子菇黄酮对细菌抑菌特性的研究结果
观察平板,结果显示在涂布有大肠杆菌菌悬液的平板上出现了明显抑菌圈,且样品溶液浓度越大,抑菌效果越明显,而涂布有其他3种细菌菌悬液的平板上无抑菌圈出现。说明滑子菇黄酮对大肠杆菌有明显抑菌作用,对沙门氏菌、金黄色葡萄球菌和枯草芽孢杆菌这3种细菌没有抑菌效果。
3 结论
(1)试验对新鲜滑子菇黄酮的醇提条件进行单因素试验分析和正交试验分析,得到最优醇提条件为乙醇体积分数70%,提取时间2 h,超声功率480 W,料液比1∶5(g∶mL),此条件下滑子菇黄酮的得率最大,为2.989%。
(2)用紫外分光光度法将滑子菇醇提物进行全波长扫描后,初步判定滑子菇醇提物的成分主要是黄酮,再经颜色反应鉴定,验证了黄酮的存在。滑子菇黄酮在醇提后得到滑子菇黄酮粗品,粗品中总黄酮含量为3.29%,经D-101型大孔吸附树脂精制后,其总黄酮含量为41.47%。
(3)在进行抗氧化活性试验中,当滑子菇黄酮质量浓度为10 mg/mL时,DPPH自由基的清除率为78.09%;当滑子菇醇提物质量浓度为10 mg/mL时,羟基自由基的清除率为5.60%;滑子菇黄酮对超氧阴离子无清除作用。综上说明,滑子菇黄酮有一定的清除自由基、抗氧化的能力,但是均弱于抗坏血酸。
(4) 对滑子菇黄酮进行细菌抑菌特性的研究,滑子菇黄酮对大肠杆菌有明显抑菌作用,且黄酮浓度越大,抑菌效果越明显,对沙门氏菌、金黄色葡萄球菌和枯草芽孢杆菌这3种细菌没有抑菌效果。
参考文献:
[1]朱建华.食用菌栽培技术 [M].北京:中国计量出版社,1999:1 071-1 073.
[2]Ogawah, Okaday, Kamisakot, et al.Beneficial effect of xanthoangelol,a chalcone compound from Angelica keiskei,on lipid metabolism in stroke-prone spontaneously hypertensive rats[J].Clin Exp Pharmacol Physiol,2007,34 (3):238-243.
[3]刘仲则.中草药黄酮类化合物心血管活性成分概述[J].中草药,1987,18(4):34-36.
[4]Dina Rodrigues,Ana C.Freitas,Sérgio Sousa,et al.Chemical and structural characterization of Pholiota nameko extracts with biological properties[J].Food Chemistry,2017(2):176-185.
[5]丁既鹏,李世林.醇提法和超声波法提取金银花中黄酮类物质的研究 [J].中国实验方剂学杂志,2005,11 (4):64-67.
[6]Huang B,Ban X,He J S,et al.Heteroprotrective andantioxidant activity of ethanolicextracts of edible lotus(Nelum bonucifera Gaern).leaves[J].Food Chemistry,2010(12):873-878.
[7]贺婷,向莹,陈健.滑子菇多糖超声辅助提取工艺及抗氧化活性评价 [J].食品工业科技,2013,34(7):235-238.
[8]李雪丹.滑子菇不同潮期营养成分的测定及其多糖的提取纯化研究 [D].保定:河北农业大学,2015.
[9]臧玉红,刘晓东,刘云鹤,等.从滑子菇中提取核糖核酸的工艺研究 [J].中国酿造,2012,31(2):79-81.
[10]程凡升,生吉萍,王仁爱,等.平菇液体培养液全波长光谱特性与漆酶产量关系研究 [J].光谱学与光谱分析,2009,29 (8):2 157-2 160.
[11]王威,周增辉,崔妍,等.山楂叶黄酮物质提取方法的研究及结构分析 [J].中国食品添加剂,2000(4):7-11.
[12]郑媛媛,李辰,封士兰,等.油橄榄叶中总黄酮含量测定方法探讨 [J].光谱学与光谱分析,2011,31(2):547-550.
[13]陈婵,林叶,丁玲,等.柚皮总黄酮抑菌效果及抗氧化活性测定 [J].农产品加工,2016(17):36-38,40.
[14]王静霞,黄艳菲,赵小燕,等.荞麦和商品苦荞茶中总黄酮的含量测定 [J].食品工业科技,2013,34(2):58-60.
[15]Ma M S,Baez I Y,Lee H G,et al.Purification and identification of angiotensin I-converting enzyme inhibitory peptide from buckwheat[J].Food Chemistry,2006 (1):36-42.
[16]陈乃富,张莉,陈科,等.大孔吸附树脂法纯化蕨菜黄酮的初步研究 [J].食品工业科技,2007,28(8):82-85.
[17]戴富才,赵娣,商文雨,等.正交法优化大孔树脂提纯罗布麻中总黄酮的工艺 [J].离子交换与吸附,2016,32(2):174-184.
[18]戴宏杰.虎斑乌贼肌肉糖蛋白分离纯化、结构分析及其抗氧化活性初步研究 [D].杭州:浙江工商大学,2015.
[19]Zeng Y W,Zhao J L,Peng Y H.A comparative study on the free radical scavenging activities of some fresh flowers in Southern China[J].LWT-Food Science and Technology,2008 (10):1 586-1 591.
[20]Begona B,Veronica N,Maria M,et al.In vitro antioxidant activity of red grape skins[J].European Food Research and Technology,2004(2):173-177.
[21]Scartezzini P,Speroni E.Review on some plants of Indian traditional medicine with antioxidant activity[J].J Ethnophamacology,2000(1-2):23-43.
[22]唐俊妮,王琼,韦吉敏,等.洋葱汁对五种常见食源性病源细菌抑菌效果研究 [J].西南民族大学学报(自然科学版),2015,41(3):277-284.◇
