苜蓿叶蛋白ACE抑制肽的制备
2018-04-21马洪鑫李明生高丹丹陈士恩
马洪鑫,余 琼,李明生,高丹丹,陈士恩
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
0 引言
目前,高血压已成为危害国民身体健康的头号杀手,也是引起脑血管病、心脏病、肾脏病发生和死亡的最主要因素。由高血压造成的相关并发症给社会和家庭造成了巨大的经济负担。高血压是一种人类最常见的慢性病,治疗和预防高血压是目前人们最为关注的医学课题。
高血压是持续血压过高的疾病,是一种以动脉压升高为特征的疾病,主要原因是体内血管紧张素转化酶(ACE) 的调节作用[1]。ACE既是血管紧张素转化酶,也是肾素-血管紧张素系统中的关键酶,对高血压有着至关重要的调控作用。ACE抑制剂是治疗高血压病的有效药物,但临床所用的ACE抑制剂大多为化学合成剂,会产生许多不良反应,如咳嗽、味觉功能紊乱、皮疹等。因此,人们越来越倾向于寻找天然来源的ACE抑制剂。苜蓿是一种粗蛋白质含量高、营养丰富的豆科牧草,其叶片蛋白含量很高。苜蓿叶蛋白是一种具有高开发价值的新型蛋白质产品,苜蓿叶蛋白经酶解提取后,可制备出具有抑制血管紧张素转化酶(ACE) 活性物质。目前,国内外对苜蓿叶蛋白的研究与开发主要集中于提取工艺和营养功效上,而有关其蛋白质的功能机理及其酶解后的蛋白肽研究甚少,特别是ACE抑制肽的生物活性研究更是鲜见报道。试验以苜蓿叶为原料提取苜蓿叶蛋白,并利用不同蛋白酶对其进行酶解,以制备出具有抑制血管紧张素转化酶(ACE)活性物质[2],并以酶解温度、酶解pH值、底物质量分数为指标,选出最佳酶解条件,为苜蓿的开发和利用提供新的途经。
1 材料与方法
1.1 材料与试剂
紫花苜蓿(品种为阿尔冈金),种植于西北民族大学校园内的紫花苜蓿;胰蛋白酶、中性蛋白酶、木瓜蛋白酶、碱性蛋白酶、胃蛋白酶、风味蛋白酶、马脲酰-组氨酰-亮氨酸(HHL)、乙酸乙酯,1 mol/L氢氧化钠、1mol/L盐酸、ACE。
1.2 主要设备
ISO 9001型电子天平,赛多利斯科学仪器(北京)有限公司产品;JJ-2型组织捣碎匀浆机,江苏金坛市环宇科学仪器厂产品;H2050R型台式高速冷冻离心机,湖南长沙湘仪离心机仪器有限公司产品;LGJ-10型真空冷冻干燥机,北京松原华兴科技发展有限公司产品;HWS-28型电热恒温水浴锅,上海一恒科学仪器有限公司产品;数控定时超声波清洗机,上海声彦超声波仪器有限公司产品;微电脑便携式酸度计;UV-1800型紫外分光光度计,深圳市怡华新电子有限公司产品。
1.3 试验方法
1.3.1 样品的采集及预处理
苜蓿的最佳收割期为初花期,以2~3茬的苜蓿为试验材料,收割后的苜蓿应在阴凉处存放,存放时间最好不要超过3 d,将收割的苜蓿清洗去除杂物,然后去杆取叶,便于打浆。
1.3.2 苜蓿叶蛋白的提取
称取一定量的苜蓿叶,按适当的料液比用组织捣碎机,以转速10 000 r/min打浆5 min,然后用纱布过滤汁液,再用滤纸过滤,得到含有苜蓿叶蛋白的苜蓿绿色草汁。采用2次水浴加热的方法,将含有苜蓿叶蛋白的苜蓿绿色草汁加热到50℃,然后在恒温水浴锅内恒温1 h。冷却后装入离心管中,以转速10 000 r/min离心25 min,取上清液。再次采用水浴加热的方法将第1次加热冷却离心后的上清液加热到85℃,然后在恒温水浴锅内恒温7 min。冷却后装入离心管,以转速10 000 r/min离心25 min,即得到苜蓿叶蛋白浓缩物[3-4]。采用真空冷冻装置干燥,即得到干燥的苜蓿蛋白粉。
1.3.3 酶解苜蓿叶蛋白粉制备ACE抑制肽
取适量苜蓿叶蛋白粉用蒸馏水将其溶解为一定质量分数的酶解底物,在90℃恒温水浴锅中预处理10 min,冷却至设定温度后,用1 mol/L NaOH或1 mol/L HCl调节pH值至最适范围内,酶用量为底物质量的3.5%,酶解过程中用1 mol/L NaOH或1 mol/L HCl调节维持pH值在各种酶最适pH值±0.05之间。酶解结束后在沸水浴中灭酶10 min,迅速冷却,并在4℃,10 000 r/min条件下离心20 min,取上清液测定ACE抑制率[5],将上清液冷冻干燥即得苜蓿ACE抑制肽。
不同蛋白酶用量及反应条件见表1。
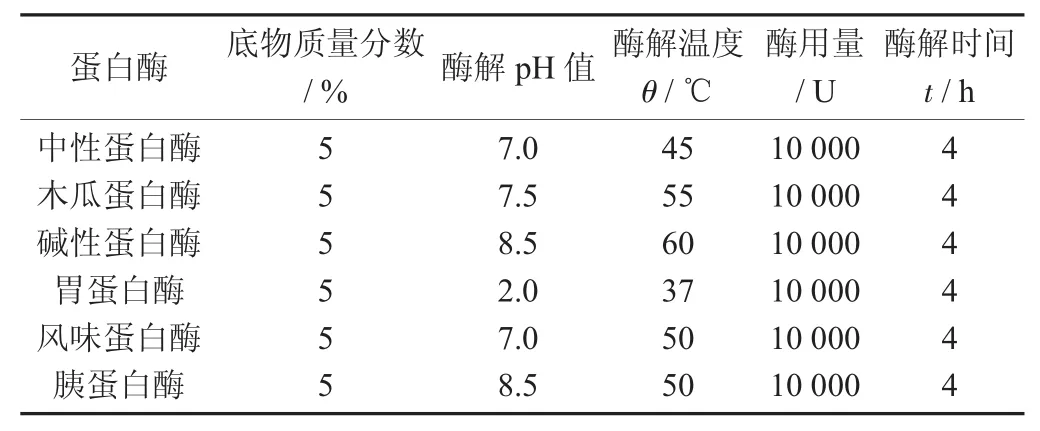
表1 不同蛋白酶用量及反应条件
(1) 酶解温度对苜蓿叶蛋白提取的影响。以ACE抑制率为指标,设45,50,55,60,65℃5个处理水平进行试验,按1.3.3操作考查酶解温度对苜蓿叶蛋白提取的影响。
(2) 底物质量分数对苜蓿叶蛋白提取的影响。以ACE抑制率为指标,设定底物质量分数2%,3%,4%,5%,6%5个处理水平进行试验,按1.3.3操作考查底物质量分数对苜蓿叶蛋白提取的影响。
(3)酶解pH值对苜蓿酶叶蛋白提取的影响。以ACE抑制率为指标,以pH值6.5~8.5作为沉降苜蓿叶蛋白的最佳范围。以1 mol/L NaOH或1 mol/L HCl调节pH值,设定pH值6.5,7.0,7.5,8.0,8.5共5个处理水平进行试验,考查pH值对苜蓿叶蛋白提取的影响,方法同上。
1.3.4 ACE抑制肽的抑制率测定
ACE在37℃,pH值8.3的条件下催化分解血管紧张素转化酶的底物Hip-His-Leu(HHL)产生马尿酸,该物质在波长228 nm处具有特征吸收峰。当加入ACE抑制剂时,ACE对HHL的催化分解作用受到抑制,马尿酸的生成量减少。通过测定加入抑制剂前后生成马尿酸紫外吸收的大小差别,即可计算出抑制率的大小[6-9]。
吸取 80 μL 酶解物加入 200 μL,5 mmol HHL(含有200 mmol/L NaCl硼酸缓冲液,pH值8.3) 中,于37℃条件下水浴预热5 min。立即加入20 μL ACE(0.002 U/mL) 启动反应,恒温保持30 min后,加入0.25 mL浓度为1 mol/L的HCl终止反应,然后取1.5 mL乙酸乙酯加入各管,均匀混合15 s,以转速4 000 r/min离心15 min后,取出1.0 mL酯层转入另一试管,在95℃的烘箱中经30 min烘干,再重新溶于3.0 mL去离子水中,测定OD228处光密度[10]。
酶活单位定义:1单位酶活定义为在37℃,1 min内催化HHL形成1 mol马尿酸的酶用量。活性抑制率按下式计算:
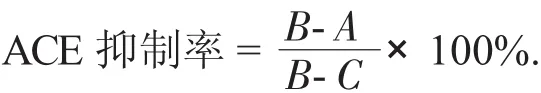
式中:A——ACE及ACE抑制肽都加入的条件下测得的吸光度;
B——不加ACE抑制肽条件下测定的吸光度;
C——不加ACE条件下测得的吸光度。
2 结果与分析
2.1 不同蛋白酶酶解物的ACE抑制率不同蛋白酶酶解物的ACE抑制率见图1。
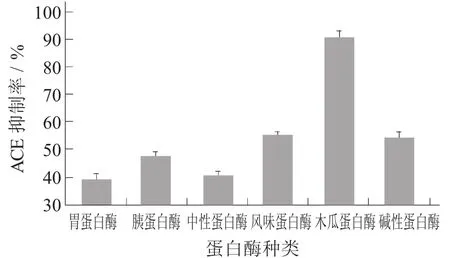
图1 不同蛋白酶酶解物的ACE抑制率
采用碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶、风味蛋白酶、胃蛋白酶6种商品蛋白酶酶解苜蓿蛋白,对其4 h酶解物的ACE抑制率进行测定。从图1可知,不同蛋白酶的酶解物的ACE抑制率是有一定差异的,蛋白酶的选择在生产生物活性肽的过程中十分重要。其中,木瓜蛋白酶水解物的ACE抑制效果最好,抑制率达到90.69%±2.77%,其他蛋白酶水解物也有一定的ACE抑制活性,抑制率如下:风味蛋白酶55.36%±0.98%,碱性蛋白酶54.39%±2.38%,胰蛋白酶48.01%±1.07%,中性蛋白酶41.74%±1.22%,胃蛋白酶39.28%±1.87%。因此,选择木瓜蛋白酶酶解苜蓿蛋白制备ACE抑制肽。
2.2 酶解单因素试验结果
2.2.1 酶解温度对ACE抑制率的影响
酶解温度对ACE抑制率的影响见图2。
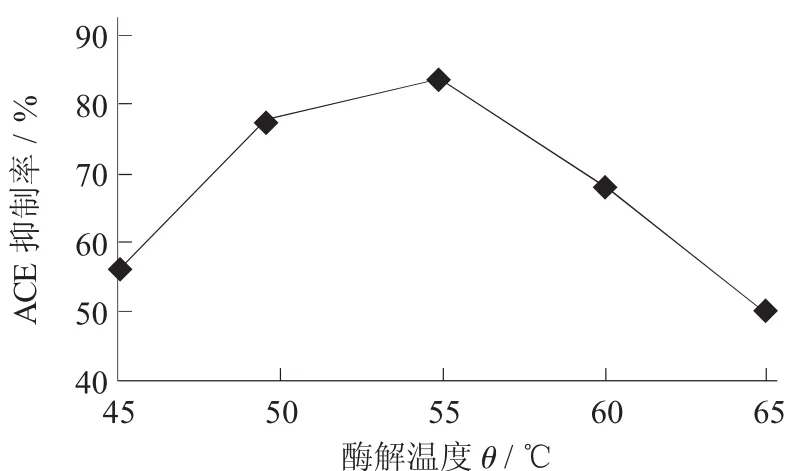
图2 酶解温度对ACE抑制率的影响
在酶解温度分别为45,50,55,60,65℃,酶解时间为4 h时,酶解温度对ACE抑制率如图2所示。当酶解温度从45℃升高到55℃,ACE抑制率逐渐升高;当酶解温度继续升高时则ACE抑制率呈逐渐下降趋势。这表明一定范围内酶解温度上升有利于酶促反应的进行,但酶解温度过高,会导致蛋白酶变性,从而使酶活性减弱。当酶解温度为55℃时,ACE抑制率最高(83.26%±0.61%),因此确定最佳酶解温度为55℃。
2.2.2 底物质量分数对ACE抑制率的影响
底物质量分数对ACE抑制率的影响见图3。
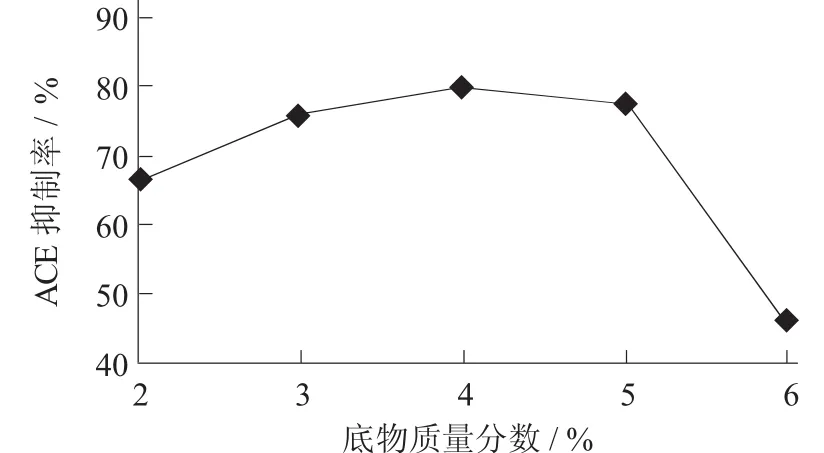
图3 底物质量分数对ACE抑制率的影响
观察了不同酶用量与底物质量分数的影响,在底物质量分数分别为2%,3%,4%,5%,6%;酶解温度50℃,酶解pH值7.5,酶解时间4 h时进行酶解。从图3可看出,当底物质量分数从2%增加到4%时,酶解物的ACE抑制率明显增加(68.85%±0.04%~81.18%±0.04%);而当底物质量分数持续增加到6%时,酶解物的ACE抑制率反而有所下降(51.03%±0.07%)。由此可见,底物质量分数为4%(抑制率81.18%±0.04%) 最为适宜。
2.2.3 酶解pH值对ACE抑制率的影响
酶解pH值对ACE抑制率的影响见图4。
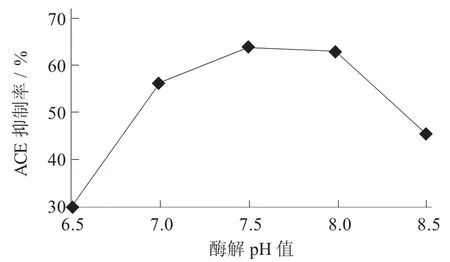
图4 酶解pH值对ACE抑制率的影响
木瓜蛋白酶的作用pH值范围较广,所以酶解pH值从6.5~8.5的梯度进行分析。从图4可看出,木瓜蛋白酶在不同pH值条件下酶解苜蓿蛋白,其酶解产物的ACE抑制率有显著差异。在酶解pH值从6.5~7.5时,酶解物的ACE抑制率逐渐增加;当酶解pH值为7.5时,ACE抑制率达到最大(64.87%±0.49%)。当酶解pH值继续增加时,ACE抑制率随着酶解pH值的增加而下降。由此可见,木瓜蛋白酶酶解苜蓿蛋白酶的最适pH值为7.5。
3 结论
苜蓿叶蛋白来源广泛、营养丰富,不含动物性胆固醇,蛋白质中氨基酸含量丰富,是一种营养价值丰富且能降血脂的保健食品成分。试验目的是筛选酶解制备ACE抑制肽的最佳用酶,根据试验结果可知,在这6种商品蛋白酶中,木瓜蛋白酶抑制率为90.69%±2.77%,是酶解苜蓿蛋白制备ACE抑制肽的最佳用酶,其最佳酶解反应条件为酶解pH值7.5,底物质量分数4%,酶解时间4 h。试验仅是对苜蓿叶蛋白ACE抑制肽酶解用酶的初步筛选,试验中各酶解用酶均在其最适酶解温度和酶解pH值条件下进行酶解反应。试验未进行单因素优化试验,因此无法获得更精确的影响结果,这些问题将在接下来的研究中完成。
参考文献:
[1]张焱.大豆蛋白ACE抑制肽的酶法制备及分离纯化 [D].合肥:合肥工业大学,2007.
[2]贺玉薇,王松柏,许俊,等.苜蓿天然成分的营养保健功能及其开发前景 [G]//第二届中国苜蓿发展大会暨牧草种子、机械、产品展示会.北京:中国草学会,2003.
[3]刘青广.苜蓿叶蛋白的提取及深加工技术的研究 [D].石河子:石河子大学,2005.
[4]王峰.紫花苜蓿叶蛋白四种提取工艺比较研究 [D].北京:北京林业大学,2005.
[5]陈飞平.苋籽ACE抑制的分离纯化及其性质评价 [D].重庆:西南大学,2013.
[6]高丹丹.棉籽抗氧化多肽和ACE抑制多肽的研究 [D].南昌:南昌大学,2010.
[7]Cushman D W,Cheung H S.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung.[J].Biochemical Pharmacology,1971,20 (7):1 637-1 642.
[8]Chang B W,Chen R L,Huang I J,et al.Assays for angiotensin converting enzyme inhibitory activity.[J].Analytical Biochemistry,2001(1):84-88.
[9]Shihabi Z K.Analysis of angiotension-converting enzyme by capillary electrophoresis.[J].Journal of Chromatography,1999(5):185-188.
[10]姚成虎,王志耕,梅林,等.胃蛋白酶水解珠蛋白获得ACE抑制肽的工艺优化 [J].农业工程学报,2008,24(5):284-288.◇
