QuEChERS-气相色谱-串联质谱测定牛奶中有机氯农药及多氯联苯的分析
2018-04-20付文雯周陶鸿王会霞
付文雯,罗 彤,朱 影,周陶鸿,文 红,王会霞*
有机氯农药和多氯联苯属于持久性环境有机污染物,虽已禁用多年,但由于其难降解,具有毒性、亲脂性、半挥发性和生物富集性等特点,在土壤、沉积物、水和部分食品中仍能检测到,并且通过生物富集和食物链对人体健康产生威胁,环境暴露和膳食暴露是人类面临持久性有机污染物的两大途径[1-5]。因此,建立简单、快速、有效的有机氯农药和多氯联苯的检测方法,对于保证食品安全和保护人类健康具有重大的现实意义。
目前,有机氯农药和多氯联苯残留量常用的检测方法有气相色谱电子捕获检测法、气相色谱-质谱法[6-8]等。由于有机氯农药和多氯联苯在样品中含量低,且食品基质复杂,在分析前通常需要用有机溶剂辅助微波、超声等进行提取、凝胶渗透色谱、固相萃取、基质分散固相萃取[9-12]等方法进行净化后再浓缩上样分析。这样不仅操作繁琐而且耗时,灵活性不强,对前处理的辅助设备要求也高。QuEChERS(quick, easy, cheap, effective, rugged and safe)由美国化学家Lehotay等于2003年提出的一种用于蔬菜、水果等农产品中多农药残留量检测的快速前处理技术[13-15],其优势在于操作简单、分析速度快、且回收率、准确度等较高。QuEChERS是基于基质分散萃取机理,其基本流程是采用乙腈提取,萃取盐析分层,最后在有机层中加入吸附剂除去基质干扰物达到净化目的,目前,有超过200 种农药残留可采用此方法进行测定[16]。根据不同样品基质以及不同目标物的理化特性差异,可以通过调整提取溶剂、吸附剂等改进QuEChERS前处理技术,让其应用于更加广泛的领域。根据资料显示,该方法经过改良后也应用于动植物样品中农药残留[17-19],其中还包括中药材样品[20],茶叶中尼古丁[21]和动物源性食品中兽药残留[22-23]的检测,但在牛奶样品中的应用报道较少。因此,本研究拟沿用QuEChERS方法的思路建立牛奶样品的快速前处理方法,通过气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)分析样品,以基质标准曲线定量,建立QuEChERS-GC-MS/MS法检测牛奶中有机氯农药和多氯联苯残留的方法,为实现牛奶中有机氯农药和多氯联苯残留的快速监测提供实验依据。
1 材料与方法
1.1 材料与试剂
牛奶 市购;正己烷(色谱纯);有机氯标准品 农业部环境保护科研监测所;多氯联苯标准品 美国Accustandard公司;N-丙基乙二胺(N-propylethylenediamine,PSA)、弗罗里硅土填料、MgSO4、C18填料 北京迪马科技有限公司;浓硫酸(优级纯)。
1.2 仪器与设备
TSQ 8000 GC-MS/MS联用仪 赛默飞世尔科技(中国)有限公司;AIIegra X-22R多功能台式冷冻离心机 美国贝克曼公司;XH-C涡旋混合器 江苏金怡仪器科技公司;MSA125P-1CE-DU分析天平 德国Sartorius公司。
1.3 方法
1.3.1 标准溶液配制
标准储备液:将8 种有机氯农药(六六六(α-hexachlorocyclohexane,α-HCH)、β-HCH、γ-HCH、δ-HCH、滴滴伊(pp’-dichlor odiphenyldichloroethylene,pp’-DDE)、滴滴滴(pp’-dichlorodiphenyldichlorothane,pp’-DDD)、滴滴涕(op’-dichlorodiphenyltrichloroethane,op´-DDT)、pp’-DDT)标准品和7 种多氯联苯(2,4,6-三氯联苯(2,4,6-trichlorobiphenyl,PCB28)、PCB52、PCB101、PCB118、PCB153、PCB138、PCB180)标准品,用正己烷稀释至1 μg/mL,4 ℃保存备用。
1.3.2 样品前处理
准确称取5.0 g样品至50 mL离心管中,加入30%硫酸-甲醇2 mL,2 g无水硫酸镁,陶瓷均质子,涡旋5 min,放入-18 ℃冷冻5 min,加入10 mL正己烷溶液,涡旋5 min,以4 000 r/min离心3 min,取上层清液2 mL加入弗罗里硅土100 mg、C18150 mg、MgSO4200 mg,涡旋1 min,取上清液过0.22 μm滤膜,上机测定。
1.3.3 仪器工作条件
色谱条件:色谱柱:HP-1701MS毛细管柱(30.0 m×0.32 mm,0.25 μm);升温程序:150 ℃保持1 min,以8 ℃/min升温至230 ℃,保持9 min;以10 ℃/min升温至250 ℃,保持8 min;进样口温度250 ℃,流速1.0 mL/min;进样量1.0 μL;进样方式:不分流进样。
质谱条件:电子电离源;电离能量70 eV,离子源温度280 ℃,传输线温度270 ℃,溶剂延迟7.5 min,灯丝电流100 μA,多反应监测模式,其具体参数见表 1,有机氯和多氯联苯的总离子流图见图1。
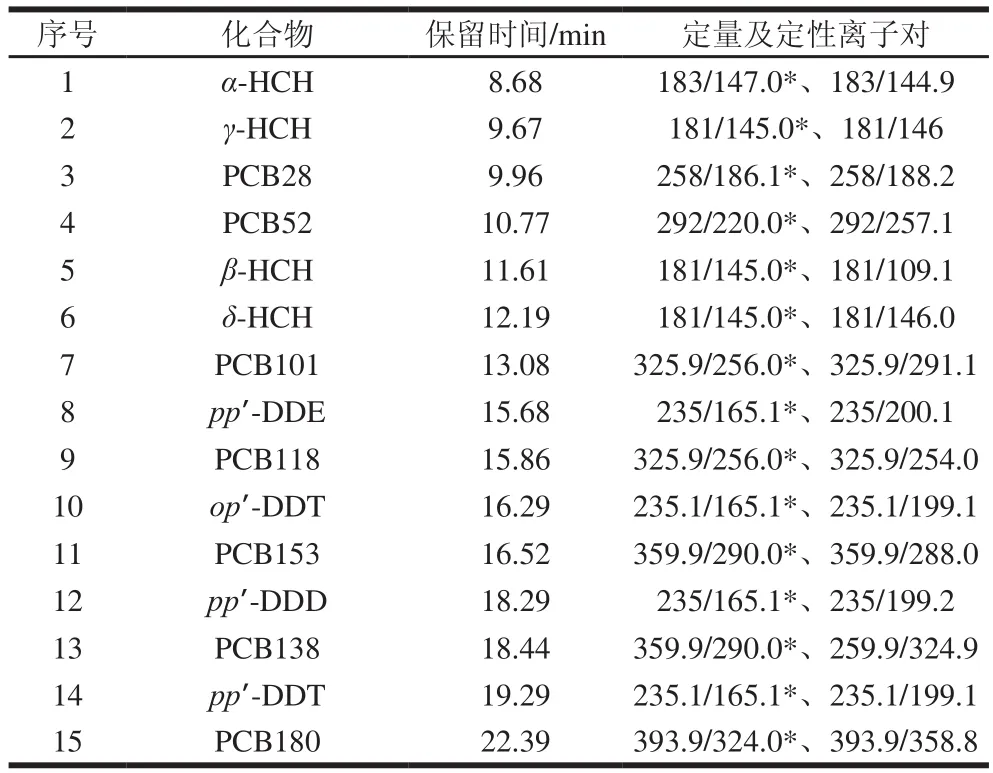
表1 有机氯农药和多氯联苯保留时间、定性及定量离子对Table 1 Retention times, qualitative ions and quantitative ions of organochlorine pesticide and polychlorinated biphenyls
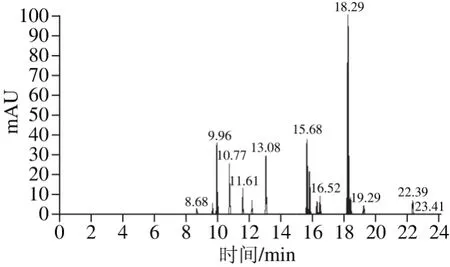
图1 有机氯农药和多氯联苯总离子流图Fig. 1 Total ion chromatogram of organochlorine pesticide and polychlorinated biphenylsin standards
2 结果与分析
2.1 提取试剂的优化
乳及乳制品基质复杂,含有蛋白质、脂类、酚类、碳水化合物等杂质,在提取前对其进行一定处理,可以提高提取的效率。本实验以纯牛奶为研究对象,分别比较了在添加B(4% KOH-甲醇)、C(10%硫酸-甲醇)、D(亚铁氰化钾-乙酸锌(1∶1))、E(3%乙酸)作用后对提取效率的影响(A为阴性对照),结果见图2。
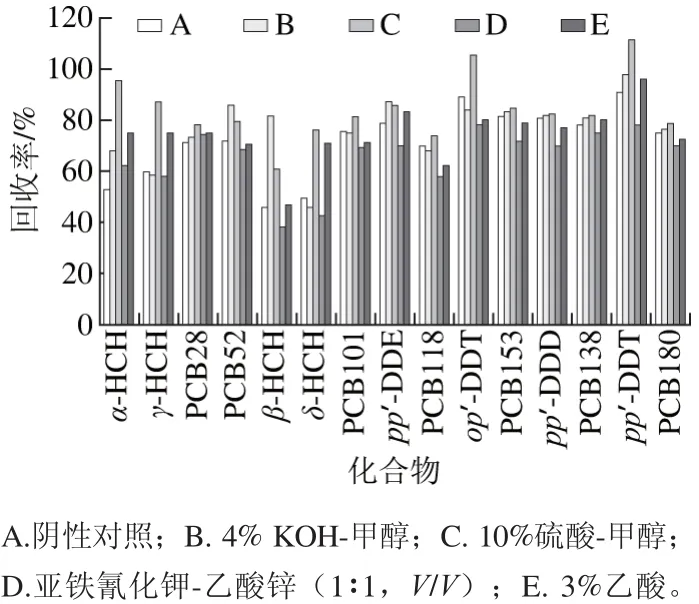
图2 不同处理方式对提取效率的影响Fig. 2 Effect of different pretreatments on extraction efficiency
脂肪在碱性条件下水解生成甘油和高级脂肪酸的钠盐,采用KOH-甲醇进行前处理,可以有效降低牛奶里的脂肪含量[24-25],从而提高提取的效率,除γ-HCH、δ-HCH外,其余指标回收率均较高,可能是HCH在碱性环境中稳定性弱于酸性环境的原因。采用硫酸-甲醇进行甲酯化,高浓度的硫酸可以破坏牛奶中蛋白质、脂肪等有机物[26],使样品在一定程度上“碳化”,而且酸催化酯化在含水样品中也可以进行[27],因此硫酸-甲醇能很好地消除蛋白质和脂肪的干扰,有利于下一步的提取,并且各指标在酸性环境稳定性均较好,采用10%硫酸-甲醇进行甲酯化后再进行提取各指标的回收率均较高。
2.2 硫酸-甲醇体积分数的优化
称取5 份相同浓度的加标样品5.0 g,分别加入A(5%硫酸-甲醇)、B(10%硫酸-甲醇)、C(20%硫酸-甲醇)、D(30%硫酸-甲醇)、E(40%硫酸-甲醇)2 mL,加入2 g无水硫酸镁,陶瓷均质子,涡旋5 min,放入-18 ℃冷冻5 min,加入10 mL正己烷溶液,涡旋5 min,以4 000 r/min离心3 min,取上层清液2 mL加入弗罗里硅土200 mg、C18100 mg、MgSO4300 mg,具体结果见图3。
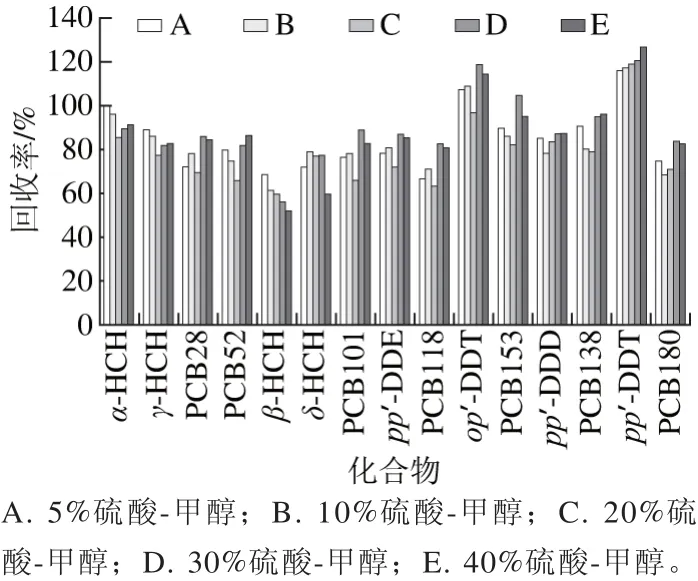
图3 硫酸-甲醇体积分数对提取效率的影响Fig. 3 Effect of sulfuric acid concentration mixed with methanol on extraction efficiency
反应的温度和酸质量分数对酸催化甲酯化的影响都比较大[27],本研究的宗旨是快速有效,因此采用提高硫酸的质量分数和加无水硫酸镁来替代加热,牛奶中含有大量的水分,高体积分数的硫酸-甲醇加入时会放热,无水硫酸镁加入时也会放热,利用这个温度来催化反应的进行。但值得注意的是,需要在离心管中加入陶瓷均质子,无水硫酸镁容易产生结块,而陶瓷均质子可以打碎结块,充分分散基质,提高提取效率。实验结果表明,在30%硫酸-甲醇水平下各指标回收率均相对较好。
2.3 净化填料的优化
常用的净化剂有PSA、C18、弗罗里硅土、GCB等固相萃取填料,它们分别对有机酸、非极性、极性物质、色素等有不同程度的吸附,但前期预实验发现PSA对δ-HCH有强烈的吸附,根据本实验样品及目标物质的特性,最终选用C18、弗罗里硅土为净化剂。据相关文献报道,无水硫酸镁的脱水效果比无水硫酸钠强[28],本实验中选用无水硫酸镁为脱水剂。在5 μg/kg加标水平下,以2 mL提取液为研究对象,对净化条件进行优化。
2.3.1 C18用量的选择
实验固定弗罗里硅土用量为200 mg,MgSO4用量为300 mg,取2 mL提取液6 份,分别加入A(50 mg)、B(100 mg)、C(150 mg)、D(200 mg)、E(250 mg)、F(300 mg)C18。结果表明,大部分指标的回收率随着C18用量的增加呈现先增加后下降的状态,并在C18为150 mg时达到最大值。C18主要在去除非极性杂质方面效果良好[29],而有机氯农药和多氯联苯属于非极性较强的化合物,C18用量过大,吸附完杂质,过多的C18会对目标化合物产生吸附,因此,最终选用C18用量为150 mg,结果见图4。
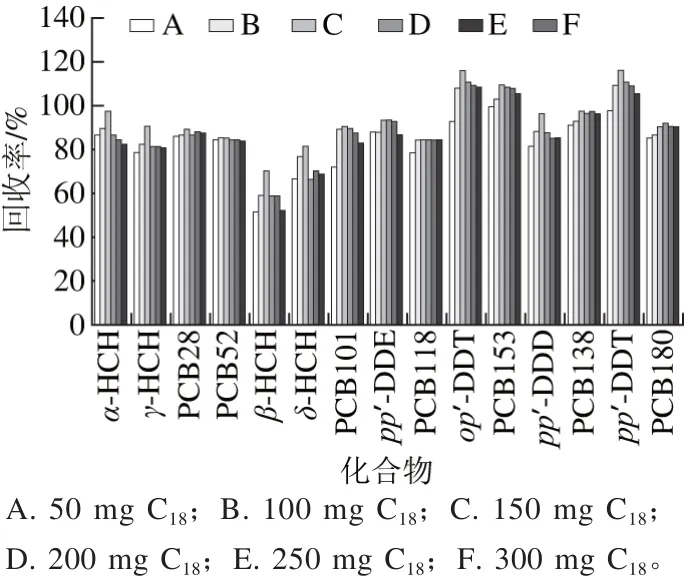
图4 C18用量对提取效率的影响Fig. 4 Effect of C18 dosage on extraction efficiency
2.3.2 MgSO4用量的选择
实验固定弗罗里硅土用量为200 mg,C18用量为150 mg,取2 mL提取液6 份,分别加入A(50 mg)、B(100 mg)、C(200 mg)、D(300 mg)、E(400 mg)、F(500 mg)MgSO4。此处MgSO4的作用仍然是去除提取液中的水分,进样溶液中如果水分含量高对仪器和柱子有损耗,也会降低柱效,影响实验结果。实验结果表明,MgSO4用量为200 mg时,各组分平均回收率最高(图5)。
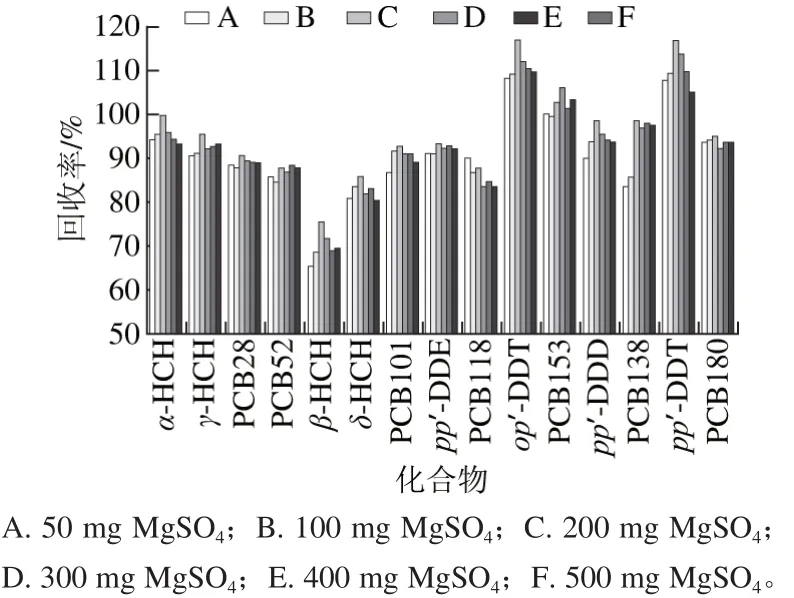
图5 MgSO4用量对提取效率的影响Fig. 5 Effect of MgSO4 dosage on extraction efficiency
2.3.3 弗罗里硅土用量的选择
实验固定MgSO4用量为200 mg,C18用量为150 mg,取2 mL提取液6 份,分别加入A(50 mg)、B(100 mg)、C(150 mg)、D(200 mg)、E(250 mg)、F(300 mg)弗罗里硅土。弗罗里硅土对极性干扰的吸附有很好的作用[30],实验发现,随着弗罗里硅土用量的增加,各指标的回收率有的呈现先下降后上升的趋势,有的指标变化不大,综合各指标平均回收率和经济因素,最终选用弗罗里硅土为50 mg,结果见图6。

图6 弗罗里硅土用量对提取效率的影响Fig. 6 Effect of Florisil dosage on extraction efficiency
2.4 基质效应的考察结果
基质效应是残留检测中普遍存在的现象,会对分析方法的重复性、灵敏度、准确度等产生影响,表现为基质抑制或增强效应。基质效应=基质匹配校准曲线的斜率/溶剂标准校准曲线的斜率[29],基质效应越接近1,则基质效应越小,反之亦然,结果见表2。

表2 线性方程和基质效应Table 2 Linear equations and matrix effect ratio
由表2可以看出,pp’-DDT、op’-DDT、γ-HCH、β-HCH的基质效应较大,7 种多氯联苯相对基质效应影响相对较小,实验中可以采用配制基质标准曲线、加入分析保护剂、盐析等降低基质效应的影响。本实验中采用配制基质标准曲线降低基质效应。
2.5 检出限、回收率、精密度实验结果
实验以3 倍信噪比计算检出限。方法的准确度用回收率表示,添加量分别为0.5、5.0、50.0 μg/kg,每个添加水平重复测定6 次。方法的精密度用6 次平行测定的相对标准偏差(relative standard deviation,RSD)表示。表3表明,目标成分检出限为0.1~0.3 μg/kg,加标回收率范围为85.5%~115.2%,RSD为3.5%~9.8%(n=6),低于10%。

表3 样品的检出限、平均回收率和RSDTable 3 LODs, average recoveries and RSDs of the method
3 结 论
本实验通过对前处理方式、常用净化剂的种类和用量等进行选择和优化,建立了快速测定牛奶中有机氯及多氯联苯残留量的GC-MS/MS分析方法。方法简单、快速、净化效果好、灵敏度高、重复性好,可满足牛奶中有机氯及多氯联苯残留量的快速筛查和定量分析要求。
参考文献:
[1] 贺心然, 宋晓娟, 逄勇, 等. 连云港市典型蔬菜基地土壤中重金属和有机氯污染调查与评价[J]. 环境监控与预警, 2014, 6(4): 39-42.DOI:10.3969/j.issn.1674-6732.2014.04.010.
[2] 陈晓娟, 皇甫静. 持久性有机污染物(POPs)的危害及现状分析[J].污染防治技术, 2011, 24(6): 17-21.
[3] KRAMER S, HIKEL S M, ADAMS K, et al. Current status of the pidemiologic evidence linking PCBs and non-Hodgkin Lymphoma and the role of immune dysregulation[J]. Environmental Health Perspectives, 2012, 120: 1067-1075.
[4] DIRTU A, COVACI A. Estimation of daily intact of organohalogenated contaminants from food consumption and indoor dust ingestion in Romania[J]. Environment Science and Technology,2010, 44(16): 6297-6304.
[5] 任小花. 典型苯系类有机氯农药氧化降解机理的理论研究[D].济南: 山东大学, 2013: 1-15.
[6] 卫生部. 食品中指示性多氯联苯含量的测定: GB 5009.190—2014[S]. 北京: 中国标准出版社, 2014.
[7] OTTONELLO G, FERRARI A, MAGI E. Determination of polychlorinated biphenyls in fish: optimisation and validation of a method based on accelerated solvent extraction and gas chromatography-mass spectrometry[J]. Food Chemistry, 2014, 142:327-333. DOI:10.1016/j.foodchem.2013.07.048.
[8] 孙秀梅, 胡红美, 钟志, 等. 气相色谱法测定贻贝中的多氯联苯和有机氯农药[J]. 广州化工, 2014, 42(14): 134-136. DOI:10.3969/j.issn.1001-9677.2014.14.048.
[9] 颜慧, 张文丽, 蒋家骁, 等. 加速溶剂萃取-气相色谱/串联质谱法测定土壤中20 种有机氯农药[J]. 分析试验室, 2015, 34(6): 722-726.
[10] 吴金浩, 李爱, 刘桂英, 等. 微波辅助萃取-气相色谱法检测裙带菜中的多氯联苯和有机氯农药残留[J]. 环境化学, 2013, 32(1): 156-161.DOI:10.7524/j.issn.0254-6108.2013.01.024.
[11] 时磊, 沈小明, 胡璟珂, 等. 不同方法提取海岸带沉积物中多氯联苯及有机氯农药测定的比较[J]. 理化检验: 化学分册, 2014, 50(9):1113-1116.
[12] 李星, 曹彦忠, 张进杰, 等. 凝胶渗透色谱-气相串联质谱同时测定海产品中34 种多氯联苯和76 种农药[J]. 中国食品学报, 2014, 14(5):169-179.
[13] 邓小娟, 李文斌, 晋立川, 等. QuEChERS-气相色谱法测定牛奶中24种有机氯及菊酯类农药残留[J]. 食品科学, 2016, 37(18): 141-145.DOI:10.7506/spkx1002-6630-201618023.
[14] FAN Y G. Determination of organphosphorus pesticides in chewing cane juices by QuEChERS clean up and GC-NPD[J]. Journal of Anhui Agricultural Sciences, 2013(4): 8-11.
[15] 曹小丽, 刘素华, 刘仲, 等. 气相色谱-串联质谱结合QuEChERS方法检测蔬菜釆、水果中62 种农药残留[J]. 中国卫生检验杂志, 2015,25(8): 1119-1124.
[16] 刘满满, 康澍, 姚成. QuEChERS方法在农药多残留检测中的应用研究进展[J]. 农药学学报, 2013, 15(1): 8-22. DOI:10.3969/j.issn.1008-7303.2013.01.02.
[17] MOLINA-RUIZ J M, CIESLIK E, WALKOWSK I. Optimization of the QuEChERS method for determination of pesticide residues in chicken liver samples by gas chromatography-mass spectrometry[J].Food Analytical Methods, 2015, 8(4): 898-906. DOI:10.1007/s12161-014-9966-8.
[18] LUO Y B, LI X, JIANG X Y, et al. Magnetic graphene as modified quick, easy, cheap, effective, rugged and safe adsorbent for the determination of organochlorine pesticide residues in tobacco[J].Journal of Chromatography A, 2015, 1406: 1-9. DOI:10.1016/j.chroma.2015.05.066.
[19] HAN Y T, ZOU N, SONG L E, et al. Simultaneous determination of 70 pesticide residues in leek, leaf lettuce and garland chrysanthemum using modified QuEChERS method with multi-walled carbon nanotubes as reversed-dispersive solid-phase extraction materials[J].Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2015, 1005: 56-64. DOI:10.1016/j.jchromb.2015.10.002.
[20] 吴剑威, 徐荣, 赵润怀, 等. QuEChERS-气相色谱法快速检测五十种中药材中九种有机氯农药残留的方法研究[J]. 分析科学学报, 2011,27(2): 167-170.
[21] THRANE C, ISEMER C, ENGELHARDT U H. Determination of nicotine in tea (Camellia sinensis) by LC-ESI-MS/MS using a modified QuEChERS method[J]. European Food Research and Technology, 2015, 241: 227-232. DOI:10.1007/s00217-015-2447-5.
[22] 王飞, 宓捷波, 李淑静, 等. 改良的QuEChERS样本前处理/高效液相色谱-串联质谱法检测猪肉中四环素类兽药的残留[J]. 分析测试学报, 2017, 36(2): 272-275. DOI:10.3969/j.issn.1004-4957.2017.02.021.
[23] KARAGEORGOU E G, SAMANIDOU V F. Development and validation according to European Union Decision 2002/657/EC of an HPLC-DAD method for milk multi-residue analysis of penicillins and amphenicols based on dispersive extraction by QuEChERS in MSPD format[J]. Journal of Separation Science, 2011, 34(15): 1893-1901.
[24] 梁飞雁. 碱皂化净化-气相色谱法测定鳕鱼中的多氯联苯[J].食品研究与开发, 2016, 37(18): 146-149. DOI:10.3969/j.issn.1005-6521.2016.18.034.
[25] 农业部. 乳与乳制品中多氯联苯的测定 气相色谱法: NY/T 1661—2008[S]. 北京: 中国标准出版社, 2008.
[26] 吴益春, 祝世军, 罗海军, 等. 酸消化气相色谱法测定鱼肉中指示性多氯联苯研究[J]. 食品安全质量检测学报, 2015, 6(3): 923-928.
[27] 裴怀全. 水产品脂肪酸气相色谱测定方法的比较优化及应用[D].长春: 吉林农业大学, 2012: 1-6.
[28] 张爱芝, 王全林, 曹丽丽, 等. QuEChERS-超高效液相色谱-串联质谱法测定蔬菜中250 种农药残留[J]. 色谱, 2016, 34(2): 158-164.DOI:10.3724/SP.J.1123.2015.09026.
[29] 达晶, 王钢力, 曹进, 等. QuEChERS-液相色谱-串联质谱法测定植物性食品中30 种氨基甲酸酯类农药残留[J]. 色谱, 2015, 33(8): 830-837. DOI:10.3724/SP.J.1123.2015.04013.
[30] 李月. 表面活性剂合成改性弗罗里硅土及其在农药分析中的应用[D].沈阳: 东北大学, 2008: 2-20. DOI:10.7666/d.y1842337.
