黄瓜和土壤中吡唑醚菌酯和霜脲氰同步检测及其降解分析
2018-04-20洪思慧佘永新曹晓林郑鹭飞王珊珊金茂俊劳水兵闫飞燕
洪思慧,佘永新,*,张 超,曹晓林,郑鹭飞,王珊珊,金茂俊,邵 华,金 芬,劳水兵,闫飞燕,王 静,*
吡唑醚菌酯(结构式见图1a)是一种甲氧基丙烯酸酯类杀菌剂,具有杀菌谱广、低毒等特点,其通过抑制线粒体呼吸阻止细胞色素合成,广泛应用于防治黄瓜霜霉病和白粉病[1-2]。霜脲氰(结构式见图1b)是20世纪70年代美国杜邦公司研制的一种新型杀菌剂,其通过抑制孢子萌发,从而杀伤病原菌,主要用于防治黄瓜、葡萄等作物的霜霉病[3-4]。

图1 吡唑醚菌酯(a)和霜脲氰(b)的结构式Fig. 1 Chemical structures of pyraclostrobin (a) and cymoxanil (b)
在现代农业中,由于杀菌剂的频繁单一使用,易引起霜霉病菌对吡唑醚菌酯、霜脲氰等杀菌剂的耐药性,不仅给黄瓜霜霉病的防治带来困难,更使杀菌剂残留量增加,危害人体健康[5-6]。多种农药联合使用是植物病原菌抗药性治理的对策之一[7-8],合理配伍不仅提高防治效果,还可以降低农药在作物和土壤中的残留量。近年来,人们分别对吡唑醚菌酯或霜脲氰在黄瓜中的残留动态进行研究[9-13],但两者复配在黄瓜不同生长阶段进行使用后,其消解速率和半衰期等动态规律鲜见报道。因此,研究吡唑醚菌酯和霜脲氰复配后在黄瓜和土壤中的残留变化及消解动态,对评估联合农药的安全性具有重要的现实意义。
目前,液相色谱-质谱法是检测吡唑醚菌酯和霜脲氰残留的主要分析方法之一[14-18]。其前处理方法主要采用固相萃取[19-21]、液液萃取[12,22]等,均存在消耗有机试剂量大、过程繁琐等缺点,且只针对单一农药。因此,基于快速和高效的提取方法,建立黄瓜和土壤中吡唑醚菌酯和霜脲氰的同步检测方法显得尤为必要。QuEChERS(quick, easy, cheap, effective, rugged, safe)是Anastassiades等[23]于2003年提出,具有快速、简易、廉价、有效、稳定、安全等特点[24],在农药残留检测中得到了广泛应用[25-30]。
本实验以黄瓜和土壤为研究对象,采用QuEChERS净化,筛选和优化不同分散固相萃取吸附剂加入量等条件,建立黄瓜和土壤中QuEChERS-反相液相色谱-串联质谱同步检测吡唑醚菌酯和霜脲氰残留量方法;通过两年三地的田间残留实验,研究42%吡唑醚菌酯·霜脲氰水分散粒剂在黄瓜和土壤中残留动态及最终残留量,以期确定吡唑醚菌酯和霜脲氰在黄瓜上的安全间隔期,为其安全使用提供一定理论支持。
1 材料与方法
1.1 材料与试剂
吡唑醚菌酯标准品(纯度99.5%)、霜脲氰标准品(纯度99.5%) 德国Dr. Ehrenstorfer GmbH公司;质量分数42%吡唑醚菌酯·霜脲氰水分散粒剂(其中吡唑醚菌酯质量分数为6%,霜脲氰质量分数为36%) 陕西标正作物科学有限公司;乙腈、甲酸(均为色谱纯)美国Fisher公司;氯化钠、无水硫酸镁(分析纯) 北京化学试剂公司;N-丙基乙二胺吸附剂(primary secondary amine,PSA)、十八烷基键合硅胶吸附剂(C18) 天津博纳艾杰尔公司;超纯水 法国MilliQ公司。
供试黄瓜品种分别为“津春4号”(黑龙江实验点)、“德亚DV-11”(山东实验点)和“津杂2号”(北京实验点)。
1.2 仪器与设备
1200液相色谱仪 美国Agilent公司;API2000串联四极杆质谱仪 美国ABSciex公司;十万分之一天平瑞士Mettler Toledo公司;涡旋混匀器 海门市其林贝尔仪器有限公司;高速冷冻离心机 美国Thermo公司。
1.3 方法
1.3.1 田间实验设计
田间实验分别于2015~2016年在黑龙江哈尔滨、山东济南和北京3 地进行。供试药剂为42%吡唑醚菌酯·霜脲氰水分散粒剂,按NY/T 788—2004《农药残留试验准则》[31]要求设置实验小区、空白对照区、低剂量处理区、高剂量处理区和消解动态处理区。小区面积15 m2,重复3 次,随机排列,小区间设保护带。
1.3.1.1 消解动态实验
黄瓜消解动态按推荐高剂量的1.5 倍(有效成分330.75 g/(h·m2))于黄瓜果实成长至成熟个体一半大小时喷雾施药1 次;土壤消解动态也按推荐高剂量的1.5 倍(有效成分330.75 g/(h·m2)),在实验地旁另选一空地与黄瓜消解动态同时施药。另设清水空白对照。于施药后0、1、3、5、7、14、21 d采样。
黄瓜样本的采集:随机在实验小区内不同方向及上下不同部位采集6~12 条(不少于2 kg)动态施药时确已着药、生长正常、无病害的黄瓜。切成1 cm3大小的碎块,四分法取150 g,-20 ℃低温保存;土壤样本的采集:在实验小区中随机6~12 点用土钻采土1 kg以上,采样深度为0~10 cm,每个实验小区取样1~2 kg,去除杂草碎石,混匀,用四分法留取200 g,-20 ℃低温保存。
1.3.1.2 最终残留实验
设定2 个施药剂量,低剂量按有效成分含量220.5 g/(h·m2),高剂量按有效成分含量330.75 g/(h·m2)分别施药3 次和4 次,施药间隔期为7 d,分别于距最后一次施药后2、3、5、7 d时采样。每个实验小区取6 个以上的采样点(不少于2 kg),采集生长正常、无病害、成熟的黄瓜果实;土壤取样深度为0~15 cm,其余采样方法同1.3.1节。
1.3.2 样品前处理
致公党与中国共产党、国民党的关系是致公党历史研究的重要内容,研究者多将致公党历史研究置于多党合作制度框架下,兼论中国共产党的统一战线政策与国民党一党专制政策,进而梳理了致公党与中国共产党走向合作的原因、经过及意义。
黄瓜样品:准确称取10 g粉碎的黄瓜样品(精确至0.01 g)于50 mL离心管中,加入10 mL乙腈,涡旋2 min,再加入4 g无水硫酸镁和1 g氯化钠,涡旋2 min,5 000 r/min离心5 min。取上清液1.0 mL加入25 mg PSA和50 mg C18,涡旋2 min,5 000 r/min离心5 min。上清液经0.22 μm微膜过滤,待测。
土壤样品:准确称取10 g土壤样品(精确至0.01 g)于50 mL离心管中,净化时加入50 mg PSA,其余步骤同上。
1.3.3 检测条件
色谱条件:XBndgeTMC18色谱柱(2.1 mm×150 mm,5 µm);柱温30 ℃;进样体积5 µL;流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸-乙腈;流速为0.4 mL/min。梯度洗脱条件:0~3 min,流动相B:5%~90%,保持2 min; 5~6.5 min,流动相B:90%~5%。系统平衡3.5 min。
质谱条件:采用正离子扫描,具体参数见表1。
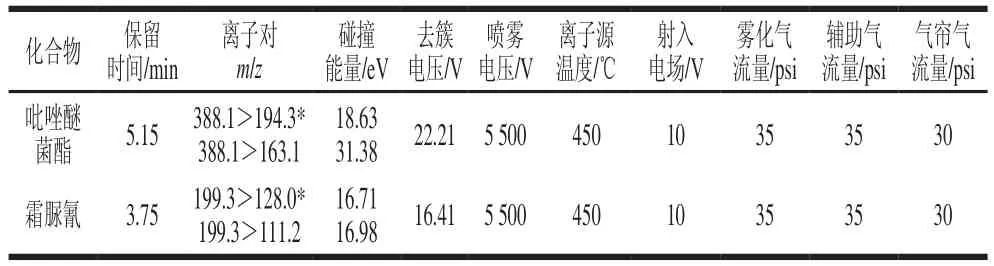
表1 吡唑醚菌酯和霜脲氰检测质谱参数Table 1 Mass spectrometric parameters for pyraclostrobin and cymoxanil
分别使用空白黄瓜和土壤样品提取液,配制基质匹配标准工作溶液质量浓度为50、100、200、400、800 μg/L,在上述液相色谱-质谱条件下测定,分别以吡唑醚菌酯和霜脲氰基质匹配标准溶液的质量浓度为横坐标,峰面积为纵坐标,绘制标准工作曲线。
分别添加质量浓度0.05、0.1、0.5 mg/kg 3 个水平,计算回收率,结合信噪比和NY/T 788—2004要求,计算定量限(limit of quantitation,LOQ)。
2 结果与分析
2.1 样品前处理及色谱条件优化结果
本实验选择比较PSA、C18和石墨化炭黑(graphitizingof carbon black,GCB)3 种净化剂的使用方式和用量对黄瓜和土壤中目标物净化回收效果的影响。当单独施加GCB时,霜脲氰的回收率低于70%,说明GCB对霜脲氰有吸附作用,故不考虑加入GCB。对PSA和C18用量进行优化的结果显示,分别在黄瓜中加入25 mg PSA和50 mg C18,在土壤中加50 mg PSA,黄瓜和土壤中吡唑醚菌酯和霜脲氰的回收率均在70%以上。
首先考察乙腈-水流动相体系的色谱分离效果,结果显示霜脲氰的响应值偏低。由于加入少量甲酸可以提高电喷雾离子源的离子化效率,提高灵敏度,优化峰形。故比较了乙腈-水、乙腈-0.1%甲酸溶液、0.1%甲酸溶液-0.1%甲酸-乙腈溶液3 种流动相体系,结果显示0.1%甲酸溶液-0.1%甲酸-乙腈溶液流动相体系的响应值最高且峰型良好。因此,选择0.1%甲酸溶液-0.1%甲酸-乙腈溶液作为流动相。
2.2 方法学评价
实验考察了上述方法的线性范围、准确度和精密度,结果表明,在50~800 μg/L质量浓度范围内,吡唑醚菌酯的峰面积(y)与质量浓度(x)间呈良好的线性关系,回归方程分别为:y=195x+3 810,r=0.998 2(黄瓜);y=155x+10 100,r=0.996 1(土壤)。同样,霜脲氰峰面积(y)与质量浓度(x)间也呈良好的线性关系,回归方程分别为:y=6.5x+1.81,r=0.998 8(黄瓜);y=9.13x-25.4,r=0.998 5(土壤)。

表2 黄瓜和土壤中吡唑醚菌酯和霜脲氰的添加回收率及相对标准偏差(n=5)Table 2 Average recoveries and relative standard deviations (RSDs)for pyraclostrobin and cymoxanil in cucumber and soil samples (n= 5)
由表2可知,在0.05、0.1、0.5 mg/kg添加水平下,吡唑醚菌酯在黄瓜和土壤中的平均回收率分别为70.45%~78.46%和95.88%~97.68%,相对标准偏差分别为0.70%~10.64%和3.68%~13.33%;霜脲氰在黄瓜和土壤中的平均回收率分别为90.65%~95.34%和97.72%~107.08%,相对标准偏差分别为6.18%~9.16%和0.52%~12.95%。依据NY/T 788—2004中对LOQ的规定,本方法对黄瓜和土壤中吡唑醚菌酯和霜脲氰的LOQ均为0.05 mg/kg。
2.3 吡唑醚菌酯和霜脲氰在黄瓜和土壤中的消解动态结果
2.3.1 吡唑醚菌酯和霜脲氰在黄瓜中的消解动态
在2015~2016年两年三地(黑龙江、山东、北京)田间实验中,2015年,除了山东实验点消解动态实验中0 d的黄瓜样品残留量为0.117 mg/kg之外,黑龙江、山东、北京消解动态实验中其余所有黄瓜样品均未检测到吡唑醚菌酯,其残留量均小于0.050 mg/kg;2016年,除了山东实验点消解动态实验中0 d的黄瓜样品残留量为0.153 mg/kg之外,黑龙江、山东、北京消解动态实验中其余所有黄瓜样品均未检测到吡唑醚菌酯,其残留量均小于0.050 mg/kg。两年三地的田间实验消解动态表明:以1.5 倍高推荐剂量下,吡唑醚菌酯分别于黄瓜上施药后1 d,其残留量小于LOQ。
2015年,黑龙江、山东、北京消解动态实验中所有黄瓜样品均未检测到霜脲氰,其残留量均小于0.050 mg/kg;2016年,除了黑龙江消解动态实验中3、5 d的黄瓜样品残留量为0.077 mg/kg和0.197 mg/kg之外,黑龙江、山东、北京消解动态实验中其余所有黄瓜样品均未检测到霜脲氰,其残留量均小于0.050 mg/kg。两年三地的田间实验消解动态表明:以1.5 倍高推荐剂量下霜脲氰分别于黄瓜上施药后7 d,其残留量小于LOQ。
2.3.2 吡唑醚菌酯和霜脲氰在土壤中的消解动态
2015年,在黑龙江、山东和北京3 个实验点的田间实验中,土壤样品吡唑醚菌酯的原始沉积量分别为0.148、1.140、0.258 mg/kg,分别在施药后3、7、3 d残留量小于LOQ;2016年,3 个实验点的田间实验中,土壤样品吡唑醚菌酯的原始沉积量分别为0.188、0.432、小于0.050 mg/kg,分别在施药后3、1、0 d残留量小于LOQ。两年三地的田间实验消解动态表明:以1.5 倍高推荐剂量下,吡唑醚菌酯于土壤上施药后7 d残留量小于LOQ。
2015年,除了黑龙江、山东和北京实验点中0 d的土壤样品残留量分别为0.059、0.060 mg/kg和0.167 mg/kg之外,黑龙江、山东、北京实验点中所有土壤样品均未检测到霜脲氰,其残留量均小于0.050 mg/kg;2016年,除了山东实验点中0 d的土壤样品残留量为0.062 mg/kg之外,黑龙江、山东、北京实验点中其余所有土壤样品均未检测到霜脲氰,其残留量均小于0.050 mg/kg。两年三地的田间实验消解动态表明:以1.5 倍高推荐剂量下,霜脲氰于土壤上施药后1 d,其残留量小于LOQ。
在本实验中,由于2 种农药在施药后的大部分样品中残留量小于LOQ,故均不能拟合出黄瓜和土壤中消解反应动力学方程,未能得出半衰期。这可能与农药自身性质、剂型、浓度、施药方式、植株自身的生长发育状况、所在的生长条件(包括阳光、土壤和微生物等)等诸多因素有关。从以上黄瓜和土壤的消解数据均可得出,在合理使用情况下,42%吡唑醚菌酯·霜脲氰水分散粒剂不会造成黄瓜和土壤中吡唑醚菌酯和霜脲氰残留污染。
2.4 吡唑醚菌酯和霜脲氰在黄瓜和土壤中的最终残留结果

表3 黄瓜和土壤中吡唑醚菌酯和霜脲氰的最终残留量(n=3)Table 3 Final residues of pyraclostrobin and cymoxanil in cucumber and soil samples (n= 3)
从表3可以看出,42%吡唑醚菌酯·霜脲氰水分散粒剂在有效成分220.5 g/(h·m2)和330.75 g/(h·m2)剂量下分别施药3~4 次,施药间隔期为7 d,距末次施药间隔期为2、3、5、7 d的情况下,吡唑醚菌酯和霜脲氰在黄瓜中的最终残留量分别为ND~0.090 mg/kg和ND~0.060 mg/kg;在土壤中的最终残留量分别为ND~0.584 mg/kg和ND~0.317 mg/kg。吡唑醚菌酯和霜脲氰在黄瓜中的最高残留量分别为0.090 mg/kg和0.060 mg/kg,均低于我国规定的黄瓜上吡唑醚菌酯的最大残留限量(0.5 mg/kg)及霜脲氰的最大残留限量(0.5 mg/kg)。因此,42%吡唑醚菌酯·霜脲氰水分散粒剂以330.75 g/(h·m2)高剂量在黄瓜果实生长至一半大小时开始施药,共3 次,施药间隔7 d时,推荐采收安全间隔期为3 d。
3 结 论
基于QuEChERS前处理技术,采用高效液相色谱-串联色谱技术,建立了同时检测黄瓜和土壤中吡唑醚菌酯和霜脲氰的残留分析方法。相比较复杂、耗时、污染大的传统前处理和色谱分析方法,本实验建立的残留分析方法具有快速、高效、稳定、灵敏度高等优点,方法的准确度、精密度及灵敏度均满足农药残留检测要求,可用于实际样品的检测。采用该方法研究黑龙江、山东和北京2015~2016年黄瓜和土壤中吡唑醚菌酯和霜脲氰的残留动态,实验结果表明,42%吡唑醚菌酯·霜脲氰水分散粒剂中吡唑醚菌酯和霜脲氰在黄瓜和土壤中残留量均低于我国规定的黄瓜上吡唑醚菌酯的最大残留限量(0.5 mg/kg)及霜脲氰的最大残留限量(0.5 mg/kg),在合理使用情况下,不会造成黄瓜和土壤中吡唑醚菌酯和霜脲氰残留污染。
参考文献:
[1] 吴迪, 聂向云, 张希跃, 等. 土壤中吡唑醚菌酯的残留分析方法和消解动态研究[J]. 农药科学与管理, 2012, 33(7): 25-28. DOI:10.3969/j.issn.1002-5480.2012.07.013.
[2] 杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂: 吡唑醚菌酯[J]. 现代农药, 2012, 11(4): 46-50. DOI:10.3969/j.issn.1671-5284.2012.04.013.
[3] 王运浩. 食品农药残留与分析控制技术展望[J]. 现代科学仪器,2003(1): 8-12. DOI:10.3969/j.issn.1003-8892.2003.01.003.
[4] 亦冰. 新颖杀菌剂霜脲氰/唑菌酮的开发及作用特性[J]. 世界农药,2001(5): 32-34.
[5] 杨向黎, 林爱军, 王军. 我国农药混剂的开发与应用现状[J].山东农业大学学报, 2001, 32(4): 544-548. DOI:10.3969/j.issn.1000-2324.2001.04.030.
[6] SILVA-JUNIOR G J, SPÓSITO M B, MARIN D R, et al. Efficacy and timing of application of fungicides for control of Citrus postbloom fruit drop[J]. Crop Protection, 2014, 59: 51-56. DOI:10.1016/j.cropro.2014.01.012.
[7] BRENT K J. Fungicide resistance in crop pathogens: how can it be managed[M]. Brussels: FRAC Monograph NO.1, 1995: 1-48.
[8] RAUPACH G S, KLOEPPER J W. Mixtures of plant growthpromoting Rhizobacteria enhance biological control of multiple cucumber pathogens[J]. Phytopathology, 1998, 88(11): 1158-1164.DOI:10.1094/PHYTO.1998.88.11.1158.
[9] 闫晓阳, 徐金丽, 徐光军, 等. 高效液相色谱法检测吡唑醚菌酯在烟叶和土壤中的残留及消解动态[J]. 农药学学报, 2013, 15(5): 528-533. DOI:10.3969/j.issn.1008-7303.2013.05.08.
[10] 闫嘉琦, 王睿, 许允成, 等. 72%霜脲·锰锌可湿性粉剂中霜脲氰在人参上的残留动态及最终残留[J]. 农药, 2016(4): 275-279.
[11] 赵方方, 谢德芳, 吕岱竹. 香蕉及土壤中吡唑醚菌酯残留的高效液相色谱分析[J]. 西北农林科技大学学报(自然科学版), 2016(1): 97-101; 110.
[12] 张惠贤, 沈菁, 彭西甜. 支撑液液萃取-高效液相色谱质谱快速检测环境水样中的吡唑醚菌酯和己唑醇[J]. 广东化工, 2015(20): 115-116. DOI:10.3969/j.issn.1007-1865.2015.20.061.
[13] 杨玉梅, 杨仁斌, 肖少怀, 等. 高效液相色谱法测定番茄及其种植土壤中霜脲氰残留的研究[J]. 湖南农业科学, 2014(2): 52-54.
[14] TP A S, BANERJEE K, JADHAV M, et al. Residue dissipation and processing factor for dimethomorph, famoxadone and cymoxanil during raisin preparation[J]. Food Chemistry, 2015, 170: 180-185.DOI:10.1016/j.foodchem.2014.08.008.
[15] 刘军, 张仙, 沈菁, 等. 液相色谱-质谱法对柑橘中吡唑醚菌酯残留的检测[J]. 湖北农业科学, 2014, 53(19): 4698-4700. DOI:10.14088/j.cnki.issn0439-8114.2014.19.050.
[16] 汤永娇, 袁宏球, 朱珠, 等. 超高效液相色谱法测定芒果中啶酰菌胺和吡唑醚菌酯[J]. 食品科学, 2014, 35(20): 175-179. DOI:10.7506/spkx1002-6630-201420035.
[17] 黄志波, 吴春梅, 李敬钊, 等. 固相萃取-超高效液相色谱-质谱/质谱法同时测定蔬菜中7 种杀菌剂的残留量[J]. 广东农业科学, 2011,38(24): 80-83. DOI:10.16768/j.issn.1004-874x.2011.24.003.
[18] 王燕, 王春伟, 高洁, 等. 高效液相色谱-串联质谱法研究吡唑醚菌酯在人参根、茎、叶和土壤中的残留动态及最终残留量[J]. 华南农业大学学报, 2014, 35(3): 69-73.
[19] 杨茜茹, 范力欣, 钱训. 气相色谱法检测小麦籽粒、植株及土壤中吡唑醚菌酯残留量[J]. 食品安全质量检测学报, 2017, 8(4): 1460-1465.
[20] 李瑞娟, 于建垒, 宋国春, 等. 60%唑醚·代森联水分散粒剂中吡唑醚菌酯在葡萄和土壤中的残留分析[J]. 环境化学, 2010, 29(4):619-622.
[21] 王亚慧, 侯志广, 密东林, 等. 高效液相色谱法同时测定马铃薯及其土壤中的霜脲氰和嘧菌酯[J]. 农药, 2014, 53(11): 815-817; 820.DOI:10.16820/j.cnki.1006-0413.2014.11.011.
[22] 刘艳萍, 王思威, 孙海滨. 田间条件下氟唑菌酰胺和吡唑醚菌酯在芒果上的残留及消解动态[J]. 农药学学报, 2016, 18(4): 509-515.DOI:10.16801/j.issn.1008-7303.2016.0071.
[23] ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D, et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “eispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431.
[24] CARPIO A, ARROYO-MANZANARES N, RÍOS-MORENO A, et al. Development of a QuEChERS-based extraction method for the determination of destruxins in potato plants by UHPLC-MS/MS[J].Talanta, 2016, 146: 815-822. DOI:10.1016/j.talanta.2015.06.008.
[25] HE Z, WANG L, PENG Y, et al. Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatographytandem mass spectrometry-based method[J]. Food Chemistry, 2015,169: 372-380. DOI:10.1016/j.foodchem.2014.07.102.
[26] RIZZETTI T M, KEMMERICH M, MARTINS M L, et al.Optimization of a QuEChERS based method by means of central composite design for pesticide multiresidue determination in orange juice by UHPLC-MS/MS[J]. Food Chemistry, 2016, 196: 25-33.DOI:10.1016/j.foodchem.2015.09.010.
[27] 林涛, 邵金良, 刘兴勇, 等. QuEChERS-超高效液相色谱-串联质谱法测定蔬菜中41 种农药残留[J]. 色谱, 2015, 33(3): 235-241.
[28] 吴岩, 姜冰, 徐义刚, 等. QuEChERS-液相色谱-串联质谱法同时测定果蔬中16 种农药残留[J]. 色谱, 2015, 33(3): 228-234.
[29] 王连珠, 周昱, 黄小燕, 等. 基于QuEChERS提取方法优化的液相色谱-串联质谱法测定蔬菜中51 种氨基甲酸酯类农药残留[J]. 色谱,2013, 31(12): 1167-1175.
[30] BRUZZONITI M C, CHECCHINI L, DE CARLO R M, et al.QuEChERS sample preparation for the determination of pesticides and other organic residues in environmental matrices: a critical review[J].Analytical and Bioanalytical Chemistry, 2014, 406(17): 4089-4116.DOI:10.1007/s00216-014-7798-4.
[31] 农业部. 农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
