基于酪蛋白自组装法制备α-生育酚/酪蛋白纳米粒及其α-生育酚稳定性分析
2018-04-20徐伟丽米雅清何胜华佟云娇
何 盼,徐伟丽,*,米雅清,何胜华,李 洋,佟云娇
α-生育酚(α-tocopherol,α-TOC)广泛分布在动植物油中,其化学结构式为C29H50O2,分子结构式如图1所示[1-2]。α-TOC为淡黄色油状液体,不溶于水,在无氧条件下即使加热到200 ℃也不易分解,但对氧十分敏感,其在碱性条件下特别容易氧化[3-4]。一般认为生育酚的主要功能是抗氧化作用,其在人体内的抗氧化作用主要表现为延缓衰老、抗不育、提高免疫力等,在医学上广泛用于治疗心血管疾病、抗肿瘤和预防衰老,并取得了良好的效果[5-7]。但由于α-TOC不溶于水,很难添加于食品中,又因为其结构特性,易被氧化破坏,使得生物利用率较低甚至失去生物活性,使α-TOC在储藏和应用方面存在一定的局限性。采用纳米体系对其进行保护是目前解决这一问题最有效的手段之一。
酪蛋白(casein,CN)广泛存在于牛奶中,在牛奶中形成的高度水合胶粒称为CN胶束[8-10],CN表面的两亲基团使CN包埋疏水性分子的同时可形成纳米粒子悬液[11-18]。由于CN能自组装成纳米粒从而成为包埋营养物质的良好载体[19-23];其自身也具有较高的营养价值,水解后可以产生生物活性肽和多种氨基酸,在人体内具有其他生理作用[10]。因此选择CN作为载体,通过自组装形成α-TOC/CN纳米颗粒并测试其稳定性,从而改善α-TOC的光敏性、热敏性、易氧化等加工适应性,保持其原有的化学特性和生物活性,并实现可控释放,为解决α-TOC的应用局限性提供参考,以期扩大α-TOC在食品加工中的应用和深化CN资源的开发利用。
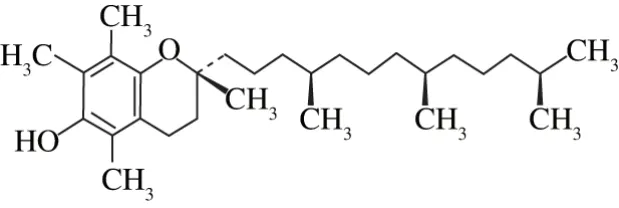
图1 α-TOC结构式Fig. 1 Structure of α-TOC
1 材料与方法
1.1 材料与试剂
α-TOC、酪蛋白酸钠 美国Sigma公司;柠檬酸三钾 天津市致远化学试剂有限公司;磷酸氢二钾天津市天力化学试剂有限公司;无水氯化钙 天津市光复精细化工研究所;盐酸 哈尔滨伊世达有限公司;氢氧化钠 天津市永大化学试剂有限公司。
1.2 仪器与设备
BSA223S型电子分析天平 赛多利斯科学仪器(北京)有限公司;pHS-3C型实验室pH计 上海伟业仪器厂;101-2A型电热鼓风干燥箱 天津市泰斯特仪器有限公司;79-3型恒温磁力搅拌器 上海司乐仪器厂;XMTD-3302型电热恒温水浴锅、RHYG-4S型电动搅拌器 常州市人和仪器厂;NanoZS90型激光粒度仪 英国Malvern仪器有限公司;Quanta x50 FEG扫描电镜 FEI香港有限公司;Nicolet 6700傅里叶变换红外光谱仪、SuperModulyo型真空冷冻干燥机 美国Thermo Fisher公司;H-7650透射电子显微镜、F-2700荧光分光光度计 日本Hitachi公司;UV-2100型紫外-可见光分光光度计 尤尼柯(上海)仪器有限公司;BCD-221型4 ℃冰箱 河南新飞电器集团有限公司;BCD-208K/A型-20 ℃冰箱 青岛海尔有限公司;Winne801光相关纳米粒度仪 济南微纳颗粒仪器有限公司。
1.3 方法
1.3.1 α-TOC/CN纳米粒的制备
α-TOC溶液的制备:250 mg α-TOC溶于10 mL无水乙醇中,充分溶解后4 ℃避光保存。
根据Semoet等[24]的方法制备重组CN胶束:在200 mL 5%酪蛋白酸钠溶液(溶于蒸馏水中)中加入3 mg α-TOC(对照只加同体积乙醇)、4 mL 1 mol/L柠檬酸三钾、24 mL 0.2 mol/L K2HPO4溶液和20 mL 0.2 mol/L CaCl2溶液。而后每隔15 min在37 ℃恒温浴边搅拌边加入2.5 mL 0.2 mol/L K2HPO4溶液和5 mL 0.2 mol/L CaCl2溶液,共计8 次。使用0.1 mol/L HCl溶液或1 mol/L NaOH溶液调节pH值为6.7,用蒸馏水定容到400 mL。然后适度搅拌1 h(350 r/min),每个实验都重复进行。
样品和对照分散体系(10 mL)被放置在拧紧盖的20 mL小瓶中,于74 ℃恒温水浴热处理20 s以便更好地形成自组装粒子。
1.3.2 单因素试验
以荧光强度为评价指标,固定其他条件按照上述制备方法分别对组装温度(25、28、32、37、44、48 ℃)、α-TOC与CN质量比(1∶5、1∶10、1∶20、1∶50、1∶100、1∶200、1∶300、1∶400、1∶500)、pH值(6.4、6.6、6.8、7.0、7.2、7.4)进行单因素试验。使用荧光光度计测定相对荧光强度,其中激发波长为301 nm,发射波长为409 nm(稀释倍数为2)。以确定自组装法的最佳组装温度、质量比和pH值。
1.3.3 α-TOC/CN纳米粒的表征
1.3.3.1 粒径测定
将α-TOC/CN纳米粒用激光粒度仪分析其粒径,对照组用200 mL 5%的酪蛋白酸钠溶液定容至400 mL。粒径测定参照Thiebaud等[25]的方法:用去离子水将样品稀释至原来体积的1/10,室温静置1 h,以破坏CN胶束。接着再稀释至1/1 000,稀释液于20 ℃适度搅拌。取100 mL处理好的样品用激光粒度仪进行粒径分析。
1.3.3.2 形貌观察
将干燥后的纳米颗粒喷金,在Quanta x50 FEG扫描电镜下(加速电压5 kV)观察外部形态。取一滴纳米溶液加到铜网上,采用漂浮法进行负染,负染剂为3%铀染色,负染时间为35 s,置于透射电镜下观察形貌(加速电压80 kV)。
1.3.3.3 傅里叶变换红外光谱分析
将纳米颗粒压片后进行衰减全反射傅里叶变换红外光谱分析,波数范围为400~4 000 cm-1,分辨率为4 cm-1。
1.3.4 α-TOC含量的测定
1.3.4.1 α-TOC包封率和载药量计算
CN重组装后的体系中除有包埋的α-TOC,还有游离的α-TOC。测定α-TOC总质量和游离α-TOC质量,按公式(1)和(2)计算纳米粒的包封率和载药量:

1.3.4.2 α-TOC标准曲线的绘制
精确称取200 mg 93% α-TOC醇溶液溶于50 mL正己烷中,待完全溶解后用正己烷定容至100 mL,配制成2 mg/mL的α-TOC溶液,作为标准品备用液。取1 mL样品溶液置于10 mL容量瓶中,用正己烷定容至刻度,作为工作液。精确吸取工作液0.5、1.0、1.5、2.0、2.5 mL置于10 mL容量瓶中,加正己烷稀释至刻度,摇匀。用正己烷作空白,用紫外分光光度计于297 nm波长处分别测定标准溶液的吸光度,以α-TOC质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得出线性回归方程为y=0.006 4x-0.003 5,R2=0.999 6。
1.3.4.3 样品游离α-TOC质量的测定
游离的α-TOC用膜分离方法获得:4 000×g离心30 min,游离的α-TOC会渗透到滤液接收器,封装在CN纳米颗粒的α-TOC会留在过滤装置。滤液中得到的游离α-TOC先用氮气流除去乙醇,然后用正己烷提取至适当的浓度,最后彻底涡旋,用紫外分光光度计测定在297 nm波长处的吸光度。代入回归方程,算出游离α-TOC的质量。
1.3.5 α-TOC/CN纳米粒稳定性的测定
将α-TOC/CN纳米粒于培养皿中-20 ℃冷冻过夜,放入冷冻干燥机真空干燥48 h,调蒸馏水pH值至与样品pH值相同,用其溶解冻干样品并用相关纳米粒度仪测定粒径大小。
1.3.5.1 贮存稳定性
实验设置4 ℃以及室温2 个条件,将样品在4 ℃(或室温)避光贮存48 h后与无水乙醇等体积混合磁力搅拌,加入200 μL 1 mol/L NaOH溶液,用正己烷对α-TOC进行萃取,直到水相呈无色透明。正己烷相于297 nm波长处测定吸光度,根据公式(3)计算保留率:

1.3.5.2 组装温度对α-TOC稳定性的影响
将实验组和对照组样品分别置于60 ℃下避光保存48 h,计算保留率。
1.3.5.3 氧化剂对α-TOC稳定性的影响
将实验组与对照组样品各取1 mL分别加入1 mL 20 μg/mL FeCl3溶液,室温避光保存48 h,计算保留率。
1.4 数据分析
采用SPSS 13.0软件进行显著性分析,采用单因素Duncan法进行多重比较,显著水平为P<0.05。
2 结果与分析
2.1 单因素试验结果
2.1.1 组装温度对α-TOC/CN纳米粒相对荧光强度的影响
CN能够发出荧光,当α-TOC与CN形成α-TOC/CN纳米粒时,CN的疏水基团发生荧光淬灭[26],自组装包埋形成的α-TOC/CN纳米粒相对荧光强度比未包埋的α-TOC相对荧光强度低。因此,可以通过测定相对荧光强度的大小来反映复合纳米粒的结合强度。
组装温度的改变会影响CN结构上的变化,从而影响α-TOC/CN纳米粒的结合,因此确定最适操作温度会提高纳米粒的结合强度。取3 mg α-TOC于400 mL CN溶液中(pH 6.7),对不同组装温度下制备的α-TOC/CN纳米粒相对荧光强度的测定结果如图2所示,结果表明:在25~37 ℃范围内,相对荧光强度波动不大;当37~48 ℃时,相对荧光强度逐渐增大,这可能是由于温度升高导致蛋白质部分变性使得大部分α-TOC与CN不能紧密的结合。由图2可知,组装温度为37 ℃左右时,纳米粒的相对荧光强度最小(P<0.05),结合程度最高。
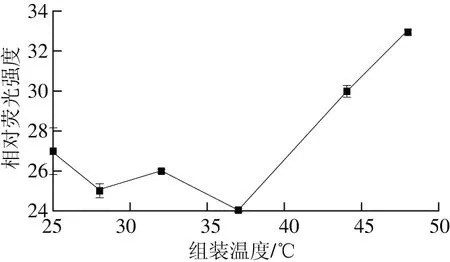
图2 组装温度对α-TOC/CN纳米粒的影响Fig. 2 Effect of temperature on fluorescence intensity of α-TOC/CN nanocomposites
2.1.2 α-TOC与CN质量比对α-TOC/CN纳米粒相对荧光强度的影响
据于钰等[10]实验研究,纳米复合物的包埋程度受原料量的影响,因此本实验通过测定α-TOC与CN质量比以确定CN对α-TOC的包埋程度。在pH 6.7、组装温度37 ℃条件下,对不同质量比条件下制备的纳米粒相对荧光强度测定结果如图3所示,结果表明:质量比在1∶5~1∶100时,相对荧光强度变化不大,可能是由于与CN结合的α-TOC有限,导致α-TOC大部分都还处于未结合状态,从而导致这一范围内相对荧光强度高且变化不大,当质量比为1∶100~1∶300时,相对荧光强度急剧下降,纳米粒结合的程度较高,其原因可能是在质量比为1∶100时虽然α-TOC的含量较高但其大部分以微晶形式存在,使得进入CN被包埋的较少,而在质量比1∶300时α-TOC是以分子形式存在,更易于结合到CN的疏水微区中,使得两者的结合程度较高[10],而质量比为1∶300~1∶500时,相对荧光强度又逐渐增加,这可能是由于随着质量比的减小,溶液中α-TOC虽都能达到最大程度的结合,但未包埋的CN增多,所以其相对荧光强度又逐渐升高。因此当α-TOC与CN质量比为1∶300时,α-TOC与CN结合程度较高(P<0.05)。
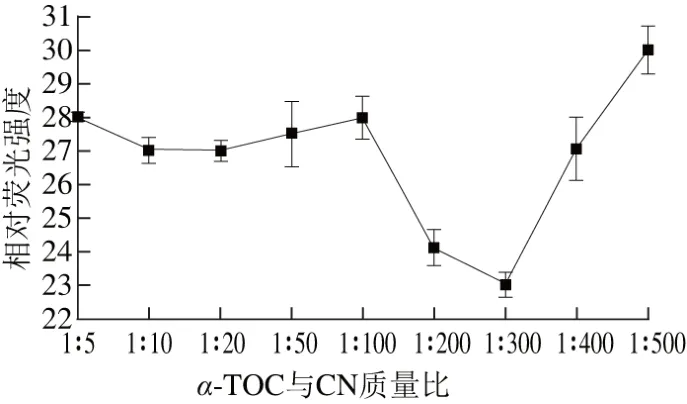
图3 α-TOC与CN质量比对α-TOC/CN纳米粒的影响Fig. 3 Effect of α-TOC to sodium caseinate ratio on fluorescence intensity of α-TOC/CN nanoparticles
2.1.3 pH值对α-TOC/CN纳米粒相对荧光强度的影响
pH值的变化会改变聚合物的带电状态,从而影响聚合物分子之间的静电作用、盐键作用、氢健作用和疏水作用以及聚合物分子结合程度[11]。在组装温度37 ℃、α-TOC与CN质量比为1∶300的条件下,对不同pH值下制备的α-TOC/CN纳米粒荧光强度的测定结果如图4所示。结果表明:随着pH值的升高,纳米粒相对荧光强度呈现先减小后增大的趋势,在pH值为6.8时,纳米粒相对荧光强度最小(P<0.05),结合程度最高,这可能是由于在pH 6.8时使得α-TOC与CN疏水基团氢键结合能力最强,使得其相对荧光强度最小,同时Sáiz-Abajo等[27]也表示在利用CN自组装时在pH 6.7附近效果最佳。因此选用pH 6.8为制备α-TOC/CN纳米粒最佳pH值。
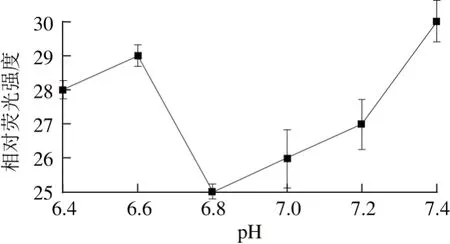
图4 pH值对α-TOC/CN纳米粒的影响Fig. 4 Effect of pH value on fluorescence intensity of α-TOC/CN nanoparticles
2.2 α-TOC/CN纳米粒的表征结果
2.2.1 α-TOC/CN纳米粒粒径

图5 α-TOC/CN纳米粒粒径的测定Fig. 5 Particle size distribution of α-TOC/CN nanoparticles
由图5可知,α-TOC/CN纳米粒平均粒径为(135.6±13.7)nm,粒径范围为80.3~306.5 nm,且多分散系数为0.157,表明经自组装后纳米颗粒分散性良好,粒径分布较均匀,体系稳定,适合用于后期研究[28]。
2.2.2 形貌观察
最佳条件下所制备的α-TOC/CN纳米粒扫描电镜和透射电镜结果如图6所示,复合纳米颗粒形状类似圆状,分散性良好,粒径分布比较均匀,粒径与之前用激光粒度仪所测的结果一致。

图6 α-TOC/CN纳米粒扫描电镜图(A)与透射电镜图(B)Fig. 6 SEM (A) and TEM (B) images of α-TOC/CN nanoparticles
2.2.3 傅里叶变换红外光谱结果
α-TOC/CN纳米粒与未包埋α-TOC的CN纳米粒红外光谱测试如图7所示,3 000 cm-1附近的宽峰为CN中N—H键伸缩振动所致,α-TOC/CN纳米粒在此处的吸收峰为3 300.25 cm-1,而对照CN纳米粒的吸收峰为3 307.20 cm-1,通过对比可知,分子间、分子内氢键作用使得该峰的伸缩振动频率向低波数方向移动,表明α-TOC与CN的氢键作用增强了[29]。而α-TOC/CN纳米粒中1 659.14 cm-1及CN纳米粒中1 658.96 cm-1峰均能说明两者具有α-螺旋结构,有利于蛋白质在油水界面上快速吸附和定向。在920.20 cm-1处,α-TOC/CN纳米粒出现了一小峰,可能是由于α-TOC与CN结合后引起CN中N—H面外弯曲振动引起的,再次证明了α-TOC与CN之间存在相互作用力。通过上述分析证明了α-TOC被成功包埋进入CN内部。

图7 α-TOC/CN纳米粒与CN纳米粒的红外光谱图Fig. 7 FTIR spectra of CN and α-TOC/CN nanoparticles
2.3 α-TOC包封率和载药量
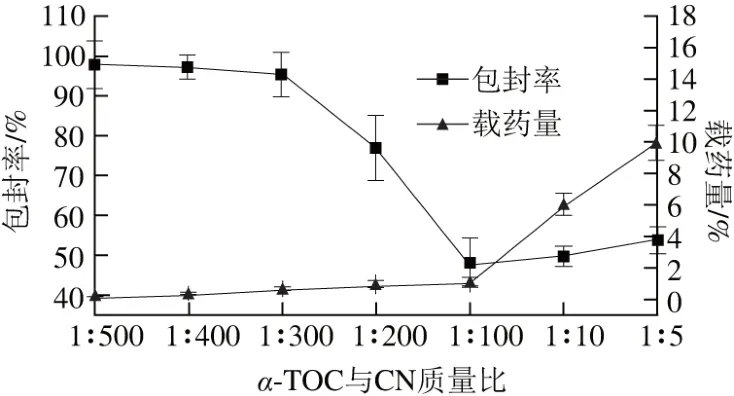
图8 α-TOC包封率和载药量Fig. 8 Encapsulation efficiency and drug loading capacity of α-TOC
从图8可以看出,随着α-TOC加入量的增加,α-TOC/CN纳米粒包封率先降低后增大,载药量逐渐增大,在α-TOC与CN质量比为1∶10时包封率和载药量都呈上升趋势,该测量结果与于钰[10]的研究结果相符合。质量比为1∶300~1∶100时,由于α-TOC含量增加,在溶液中以微晶形式存在的α-TOC也增多,使得α-TOC不易与CN结合,所以其包封率会逐渐下降。在α-TOC与CN质量比为1∶300时,包封率和载药量分别为(97.97±7.38)%和(0.33±0.03)%。
2.4 α-TOC/CN纳米粒的稳定性分析
2.4.1 冻干对纳米粒粒径的影响
将α-TOC/CN纳米粒溶液进行冻干处理后,测定其粒径结果如图9所示,经冻干后的纳米粒粒径并未发生大幅改变(P>0.05),因此可知α-TOC/CN纳米粒具有良好的冻干稳定性。

图9 冻干前后α-TOC/CN纳米粒粒径变化Fig. 9 Change in particle size of α-TOC/CN nanoparticles after freeze drying
2.4.2 4 ℃贮存稳定性

图10 4 ℃避光30 d贮存α-TOC和α-TOC/CN的保留率Fig. 10 Retention rates of α-TOC and α-TOC/CN during 30 d storage at 4 ℃
由图10可知,随着贮存时间的延长,α-TOC保留率逐渐降低,但与纯品α-TOC相比,α-TOC/CN纳米粒保留率更高(P<0.05),由此可知,在4 ℃条件下,经过CN的包埋提高了α-TOC的贮存稳定性。
2.4.3 室温贮存稳定性

图11 室温避光贮存α-TOC和α-TOC/CN纳米粒的保留率Fig. 11 Retention rates of α-TOC and α-TOC/CN during 30 d storage at room temperature
由图11可知,随着贮存时间的延长,虽然α-TOC/CN纳米粒和α-TOC的保留率都逐渐降低,但与纯品α-TOC相比,α-TOC/CN纳米粒保留率更高且下降较缓慢(P<0.05),因此可知室温下经过包埋的α-TOC要比纯品的α-TOC贮存稳定性好。
2.4.4 氧化剂对α-TOC稳定性的影响
综合比较α-TOC/CN纳米粒和α-TOC纯品分别经4 ℃保存、室温贮存、60 ℃加热处理和氧化剂FeCl3处理避光保存48 h后所测得的保留率,结果如图12所示。在各种处理中经过包埋的α-TOC要比未包埋的α-TOC保留率有所提高,其中4 ℃和FeCl3组α-TOC纳米粒的保留率显著提高。4 ℃处理的纳米粒与对照组相比没有显著差异(P>0.05),故4 ℃贮存效果最好。

图12 不同处理条件下α-TOC和α-TOC/CN保留率Fig. 12 Retention rates of α-TOC and α-TOC/CN with different treatments
3 结 论
采用自组装法包埋疏水性α-TOC,在制备α-TOC/CN纳米粒最佳条件的同时考察了不同条件下α-TOC/CN纳米粒稳定性的变化。结果表明,当制备条件为组装温度37 ℃、pH 6.8、α-TOC与CN质量比1∶300时,α-TOC与CN结合较紧密,为制备纳米复合物的最佳条件。所得纳米粒平均粒径为(135.6±13.7)nm,包封率为(97.97±7.38)%,载药量为(0.33±0.03)%。纳米粒大小均一且分散性较好。此外,经过冻干以及在不同温度(4 ℃、室温、60 ℃)和氧化剂FeCl3的处理后,由稳定性测试结果可知该纳米粒具有良好的稳定性,其中在4 ℃下贮存该纳米粒稳定性最好。用CN包埋α-TOC不仅提高了α-TOC的稳定性,同时在操作方法上较为简单和经济,除酸碱外未添加过多化学试剂,安全性高,符合食品加工标准,为CN进一步资源化利用提供了可能。
参考文献:
[1] BASIRI L, RAJABZADEH G, BOSTAN A. Alpha-tocopherolloaded niosome prepared by heating method and its release behavior[J]. Food Chemistry, 2016, 221: 620-628. DOI:10.1016/j.foodchem.2016.11.129.
[2] SCHERF H, MACHLIN L J, FRYE T M, et al. Vitamin E biopotency:comparison of various ‘natural-derived’ and chemically synthesized α-tocopherols[J]. Animal Food Science Technology, 1996, 59: 115-126.DOI:10.1016/0377-8401(95)00892-6.
[3] GALLIA F, AZZIB A, BIRRINGERC M, et al. Vitamin E: emerging aspects and new directions[J]. Free Radical Biology and Medicine,2017, 102: 16-37. DOI:10.1016/j.freeradbiomed.2016.09.017.
[4] PEH H Y, TAN W D, LIAO W P, et al. Vitamin E therapy beyond cancer:tocopherol versus tocotrienol[J]. Pharmacology & Therapeutics, 2016,162: 152-169. DOI:10.1016/j.pharmthera.2015.12.003.
[5] BOREL P, DESMARCHELIER C. Genetic variations involved in vitamin E status[J]. International Journal of Molecular Sciences, 2016,17(12): 2-11. DOI:10.3390/ijms17122094.
[6] SCHMÖLZ L, BIRRINGER M, LORKOWSKI S, et al. Complexity of vitamin E metabolism[J]. World Journal of Biological Chemistry,2016, 7(1): 14-43. DOI:10.4331/wjbc.v7.i1.14.
[7] BOONNOY P, KARTTUNENCD M, WONG-EKKABUT J. Alphatocopherol inhibits pore formation in oxidized bilayers[J]. Physical Chemistry Chemical Physics, 2017, 19(8): 5699-5704. DOI:10.1039/c6cp08051k.
[8] TAVARESA G M, CROGUENNEC T, CARVALHOC A F, et al. Milk proteins as encapsulation devices and delivery vehicles:applications and trends[J]. Trends in Food Science & Technology,2014, 37(1): 5-20. DOI:10.1016/j.tifs.2014.02.008.
[9] ATAMER Z, POST A E, SCHUBERT T. Bovine beta-casein:isolation, properties and functionality[J]. International Dairy Journal,2017, 66: 115-125. DOI:10.1016/j.idahyj.2016.11.010.
[10] 于钰. 酪蛋白自组装纳米粒的超声制备及其应用[D]. 青岛: 中国海洋大学, 2012: 2-14.
[11] 刘燕. 酪蛋白胶束结构与功能特性的研究[D]. 扬州: 扬州大学,2007: 1-20.
[12] 钱列生, 莴汉明. 食品微胶囊技术[J]. 中山大学学报论丛, 2007(9):201-205. DOI:10.3969/j.issn.1674-3202.2007.09.055.
[13] 殷婷, 管骁. 大麦醇溶蛋白负载白藜芦醇自组装纳米颗粒及其性质研究[J]. 分析测试学报, 2015, 34(1): 67-72. DOI:10.3969/j.issn.1004-4957.2015.01.010.
[14] 孙欢利, 陈维, 程茹, 等. 纳米靶向药物释放系统: 载体交联与生物响应性药物释放[R]. 大连: 全国高分子学术论文报告会, 2011.
[15] 项惠丹. 抗氧化微胶囊壁材的制备及其在微胶囊化鱼油中的应用[D]. 无锡: 江南大学, 2008: 1-7.
[16] QU B, ZHONG Q X. Casein-maltodextrin conjugate as an emulsifier for fabrication of structured calcium carbonate particles as dispersible fat globule mimetics[J]. Food Hydrocolloids, 2017, 66: 61-70.DOI:10.1016/j.foodhyd.2016.12.022.
[17] FAIZULLIN D A, KONNOVA T A, HAERTL T, et al. Secondary structure and colloidal stability of beta-casein in microheterogeneous water-ethanol solutions[J]. Food Hydrocolloids, 2017, 63: 349-355.DOI:10.1016/j.foodhyd.2016.09.011.
[18] ZHANG Z P, ZHANG R J, CHEN L, et al. Designing hydrogel particles for controlled or targeted release of lipophilic bioactive agents in the gastrointestinal tract[J]. European Polymer Journal, 2015,72: 698-716. DOI:10.1016/j.eurpolymj.2015.01.013.
[19] 周辉辉. 自组装法制备核壳结构的茶多酚-明胶-葡聚糖符合凝聚胶束[D]. 长沙: 中南大学, 2012: 1-10.
[20] 许小丁, 陈昌盛, 陈荆晓, 等. 多肽分子自组装[J]. 中国科学: 化学,2011, 41(2): 221-238. DOI:10.1360/032010-782.
[21] 阚茗铭, 叶发银, 赵国华. 多酚-蛋白质共价作用及其对食品体系的影响研究进展[J]. 食品科学, 2015, 36(1): 245-249. DOI:10.7506/spkx1002-6630-201501047.
[22] 代志凯, 周迪, 刘爱琴, 等. 辛烯基琥珀酸淀粉酯制备高含量β-胡萝卜素微胶囊[J]. 中国食品添加剂, 2013(3): 180-185. DOI:10.3969/j.issn.1006-2513.2013.03.024.
[23] BETZ M, KULOZIK U. Whey protein gels for the entrapment of bioactive anthocyanins from bilberry extract[J]. International Dairy Journal, 2011, 21(9): 703-710. DOI:10.1016/j.idairyj.2011.04.003.
[24] SEMO E, KESSELMAN E, DANINO D, et al. Casein micelle as a natural nano-capsular vehicle for nutraceuticals[J]. Food Hydrocolloids, 2007,21(5): 936-942. DOI:10.1016/j.foodhyd.2006.09.006.
[25] THIEBAUD M, DUMAY E, PICART L, et al. High-pressure homogenisation of raw bovine milk. Effects on fat globule size distribution and microbial inactivation[J]. International Dairy Journal,2003, 13(6): 427-439. DOI:10.1016/S0958-6946(03)00051-7.
[26] ESMAILI M, HHAFFARI S M, MOVAHEDI Z M, et al. Beta caseinmicelle as a nano vehicle for solubility enhancement of curcumin; food industry application[J]. LWT-Food Science and Technology, 2011,44(10): 2166-2172. DOI:10.1016/j.lwt.2011.05.023.
[27] SÁIZ-ABAJO M J, GONZALEZ-FERRERO C, MORENO-RUIZ A, et al. Thermal protectionof β-carotene in re-assembled casein micelles during different processing technologies applied in food industry[J]. Food Chemistry, 2013, 138: 1581-1587. DOI:10.1016/j.foodchem.2012.11.016.
[28] RAMPINO A, BORGOGNA M, BLASI P, et al. Chitosan nanoparticles: preparation, size evolution and stability[J]. International Journal of Pharmaceutics, 2013, 455(1/2): 219-228. DOI:10.1016/j.ijpharm.2013.07.034.
[29] 顾小红, 孟旭, 汤坚. 豆浆凝固过程中大豆蛋白质二级结构的研究[J]. 分析科学学报, 2006, 22(6): 675-687. DOI:10.3969/j.issn.1671-6132.2007.02.005.
