可溶可逆聚合物Eudragit S-100对猪胰脂肪酶的固定化
2018-04-20袁久刚张庆娟余圆圆范雪荣
袁久刚, 申 璇, 张庆娟, 余圆圆, 王 平, 王 强, 范雪荣
(1.江南大学 生态纺织教育部重点实验室,江苏 无锡 214122;2.山东如意集团,山东 济宁 272000)
脂肪酶能在油水界面上催化酯水解、酯交换以及酯合成等反应,广泛应用于食品、医药、纺织以及日化等工业中[1-2]。然而受脂肪酶蛋白天然性质的局限,这种催化剂在很多情况下不能满足催化反应的要求;另外,昂贵的价格、较低的回收利用性和催化稳定性又使其在工业上的应用受到极大限制。
固定化是脂肪酶改性常用的方法之一,通过固定化修饰,脂肪酶分子稳定性得到大幅度提高,而且固定化脂肪酶极易与反应物和产物分离,这使得反应过程的可控性以及酶的重复利用性都得到提高,有助于降低成本[3-4]。目前,固定化常用的载体主要有吸附用的多孔性载体如大孔树脂[5]、有机硅藻土[6],包埋采用的海藻胶、卡拉胶等[7],此外还有共价交联采用的各种有机大分子载体如多糖类物质等[8]。
这些载体及其固定化方法各有优点,但是大部分固定化脂肪酶都是采用水不溶性载体,这导致催化反应过程中底物与酶的接触以及产物的扩散都被限制,而对于可溶性大分子底物以及一些高分子聚合物的催化反应,如动物纤维脱脂,纺织品去污、废弃涤纶的降解等,这种不溶性载体就会大大限制脂肪酶的催化效率。因此,若能寻找一种智能型的固定化载体,使其在催化反应时处于溶解状态,而在反应结束时又可以通过改变某种条件使其不溶,便可以很好地解决这一问题。
Eudragit S-100便是这样一种智能型的可溶可逆高分子聚合物。它主要由甲基丙烯酸和甲基丙烯酸甲酯共聚而成,其突出的优点是溶解性可通过改变pH调节,在pH值高于5.5时溶解,pH值低于4.5时沉淀[9-10]。这种溶解-沉淀可逆特性使其在应用于生物酶固定化时可表现出独特的优势,即:固定化改性酶可在溶解状态下催化不溶性底物反应,而反应结束后,固定化酶又可以转变为不溶状态进行回收。而且,EudragitS-100还具有无毒、相对价廉、与酶亲和性等优点。因此,将其作为酶的固定化材料具有得天独厚的优势。
以Eudragit系列树脂为载体来制备固定化酶,可以通过吸附、包埋和共价结合的方法对酶进行固定化。本文作者试图利用共价结合的方法采用该树脂对脂肪酶进行固定化修饰。该研究有益于改善传统固定化脂肪酶存在的异相催化效率低以及回收困难的特点。
1 材料与方法
1.1 试剂与仪器
猪胰脂肪酶 (100-500 units/mg protein(using olive oil (30 min incubation),Sigma 公 司 产 品 ;Eudragit S-100,阿拉丁试剂有限公司产品;EDC,阿拉丁试剂有限公司产品;其他化学试剂均购自国药集团化学试剂有限公司,分析纯级别。
Rapid恒温振荡水浴锅,厦门瑞比公司产品;UV-1800紫外可见分光光度仪,日本岛津企业管理(中国)有限公司产品;F-4600荧光分光光度仪,日本Hitachi产品;FA25高速搅拌器,上海弗鲁克流体机械制造有限公司产品。
1.2 实验方法
1.2.1蛋白质含量的测定根据文献[11],采用考马斯亮蓝G-250(Bradford法)测定蛋白质含量。
1.2.2脂肪酶酶活测定按照江慧芳等人[12]的研究方法,以橄榄油聚乙烯醇乳化液作为底物,采用铜皂法进行测定,其相对酶活定义为:

式(1)中,ER为相对酶活,E 为所测酶活值,Em为该组所测最大酶活值。
1.2.3Eudragit溶液配制将5 g Eudragit S-100粉末加入到70 mL蒸馏水中,用3 mol/L NaOH溶液调pH 11,完全溶解后,用3 mol/L HCl溶液调pH 7.2,然后加蒸馏水定容至100 mL,得到5 g/dL的Eudragit S-100溶液。
1.2.4脂肪酶的固定化取一定量配制好的Eudragit S-100溶液,用pH 7.2的磷酸盐缓冲液将其稀释到 2%(W/V),加入 EDC(0.2 g/dL),在 30 ℃下磁力搅拌1 h,使Eudragit S-100分子上的羧基充分活化,然后向溶液中逐滴加入酶液,于恒温振荡器反应 6 h(200 r/min),反应结束后,用 0.5 mol/L 乙醇铵溶液滴定至pH=8,终止固定化修饰。最后用pH 7的Tris-盐酸缓冲液(0.1 mol/L)定容至50 mL,得到溶解状态下的Eudragit S-100共价修饰脂肪酶,于4℃下储存备用。
1.2.5平均氨基修饰率测定采用TNBS分光光度法进行测试[13]。取2份各1 mL TNBS溶液,分别加入1.5 mL未修饰酶和固定化酶溶液,在室温条件下静置30 min,然后测定溶液在420 nm条件下的吸光度值。平均氨基修饰率按以下公式(2)计算:
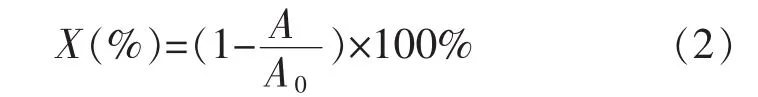
式(2)中,X为平均氨基修饰率,A为修饰后蛋白质溶液的吸光度值,A0为修饰前蛋白质溶液的吸光度值。
1.2.6荧光光谱检测采用F-4600荧光分光光度计,设定激发波长为280 nm,狭缝宽度为5 nm,扫描速度为12 000 nm/min,电压400 V,响应时间为0.1 s。测定脂肪酶在280~550 nm内的发射光谱。
1.2.7修饰酶可逆可溶性测试修饰剂Eudragit S-100和其固定化修饰酶的溶解性会随着溶液pH的改变而发生变化,具有可逆可溶性。参照Dourado等人[14]的方法,以溶液在470 nm下的吸光度值来表征修饰剂和修饰酶的溶解性。以溶质完全不溶解时溶液的吸光度值为100%,溶质完全溶解时溶液的吸光度值为0%。
1.2.8重复使用性能取一定量的修饰酶,边搅拌边滴加醋酸溶液,调节溶液的pH至4.0,静置30 min后离心,保留沉淀,沉淀用pH为4.0的缓冲溶液冲洗3次,洗涤后的沉淀溶解于pH为7.5的缓冲溶液,并定容至初始体积,然后测试该酶液的活力。重复该操作5次,视为重复使用修饰酶5次,以酶液的初始酶活为100%,计算每次使用时修饰酶的相对酶活。
2 结果与讨论
2.1 Eudragit S-100对脂肪酶的平均氨基修饰率
蛋白质中的游离氨基可以与还原糖的醛基末端发生羰胺缩合反应,从而使游离态的氨基成为结合态,因此,采用TNBS法可以测得脂肪酶经过Eudragit S-100固定化修饰后的平均氨基修饰率。对不同固定化时间下的修饰脂肪酶进行TNBS分光光度法测定,结果如图1所示。
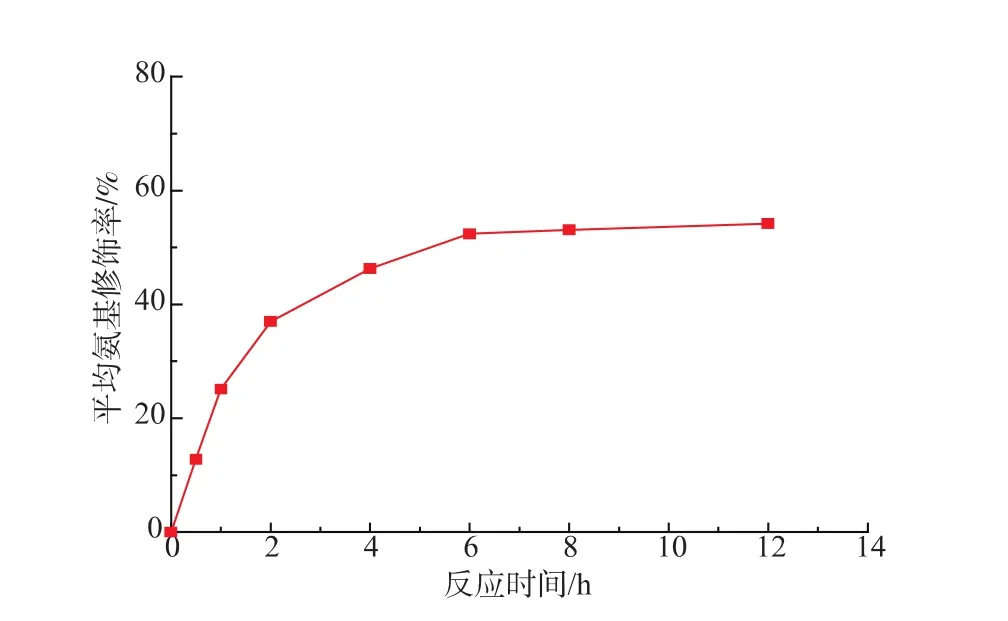
图1 不同反应时间对氨基修饰率的影响(反应温度15℃)Fig.1 Effect of reaction time on modification rate of free amino(reaction temperature 15 ℃)
从图1可以明显看出,脂肪酶中的氨基确实与Eudragit S-100树脂中的羧基进行了反应,实现了在Eudragit S-100上的固定化。另外,从图中也可以看出:当时间较短时,Eudragit S-100不能对猪胰脂肪酶进行有效的固定化修饰,因此其氨基修饰率较低。随着固定化时间的延长,脂肪酶的平均氨基修饰率也逐渐提升,当反应进行6 h后,Eudragit S-100固定化脂肪酶的平均氨基修饰率达到52.4%,再延长反应时间,其氨基修饰率并未有较大幅度提升。这主要是由于蛋白质的空间位阻以及Eudragit S-100本身含有的活化羧基数目有限,使得脂肪酶中能够参与修饰的游离氨基已经全部参与反应,因此,其平均氨基修饰率不再发生变化。
2.2 固定化修饰对脂肪酶构象的影响
在天然蛋白质分子结构中,酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)在280 nm的激发波长下会发射荧光,而固定化修饰剂Eudragit S-100则没有荧光特性,因此根据溶液的荧光光谱特征,可以分析蛋白结构的变化[15]。对不同时间固定化修饰后的脂肪酶进行荧光光谱检测,结果如图2所示。
从图2中可以看出,在280 nm的激发波长下,原酶的最大发射波长为343 nm,一般认为该内源荧光来源于色氨酸残基。经过固定化的脂肪酶则在345~346 nm处有荧光吸收,其强度也发生了变化,通常认为这是由于固定化修饰导致脂肪酶构象发生变化所致。荧光发射光谱红移,说明原来位于酶分子内部的色氨酸残基向酶分子表面发生了迁移[16];而峰强度呈现先增大后下降的趋势,说明在修饰过程中,随着反应时间的延长,脂肪酶的蛋白结构由α-螺旋向β-折叠转变,最初蛋白结构被拉伸、展开,使得色氨酸残基暴露数量先增加,峰强度变大,而后随着正确折叠,蛋白质分子结构变得紧凑,氨基酸暴露数量也减少,最终导致荧光强度降低[17]。但是,折叠程度过大不利于脂肪酶酶活的表达,因此,结合图1中的氨基修饰率可以看出,固定化修饰时间不易过长。

图2 不同反应时间下原酶与固定化脂肪酶的荧光光谱Fig.2 Fluorescence spectra of native lipase and immobilized lipase after different reaction time
2.3 固定化修饰对脂肪酶最适温度的影响
温度对酶的催化反应影响极大,只有在最适温度下,酶的催化活力才能得到最大程度的发挥。对不同温度下游离脂肪酶和固定化修饰脂肪酶的酶活力进行测定,结果如图3所示。

图3 固定化修饰对脂肪酶最适温度的影响Fig.3 Effectofimmobilization on the optimum temperature of lipase
从图3可以发现,Eudragit S-100固定化修饰前后脂肪酶的最适温度均为40℃左右,固定化修饰对脂肪酶的最适温度并没有造成很大影响。但是从实际的绝对酶活力也可以看出,除了降低脂肪酶在最适温度条件下的酶活外,固定化脂肪酶在其它温度条件下都较游离脂肪酶有更高的绝对酶活力,尤其是在较低反应温度条件下,固定化修饰后的脂肪酶比游离脂肪酶有更高的水解活力。造成这种现象的原因可能是:固定化修饰后,脂肪酶与Eudragit S-100载体进行了多点共价连接,可以有效防止酶分子伸展变形,提高了脂肪酶对外界温度变化的适应性。
2.4 固定化修饰对脂肪酶最适pH的影响
对不同pH下游离脂肪酶和Eudragit S-100固定化脂肪酶的酶活分别进行测试,结果如图4所示。

图4 固定化修饰对脂肪酶最适pH的影响Fig.4 Effect of immobilization on the optimum pH of lipase
从图4可以发现,无论是游离脂肪酶还是固定化脂肪酶,随着pH的逐渐增加,酶活均呈现先增大后降低的趋势。在酸性条件下游离脂肪酶的酶活较低,而在碱性条件下酶活迅速增大并在pH为7.5~8.0时酶活达到最大值,这与猪胰脂肪酶的碱性水解特性非常相符。固定化后脂肪酶的最适反应pH也在7.5~8.0之间,相比于游离脂肪酶,其最适pH值向碱性方向略有移动,这主要是由于Eudragit S-100树脂本身为阴离子性物质,因此与其结合后,脂肪酶的微环境发生了变化,导致其最适pH值发生了变化[18-19]。
2.5 固定化脂肪酶的可溶可逆性
Eudragit S-100本身具有pH响应的可逆可溶性,但是当Eudragit作为载体与脂肪酶共价连接后,形成的固定化修饰酶能否保留Eudragit的可逆可溶性,其响应pH范围会否发生改变,对于脂肪酶的催化以及回收都有重要影响。本文参照Yu Yuanyuan等人[20]的方法对Eudragit S-100固定化脂肪酶的可逆可溶性进行了研究,结果如图5所示。
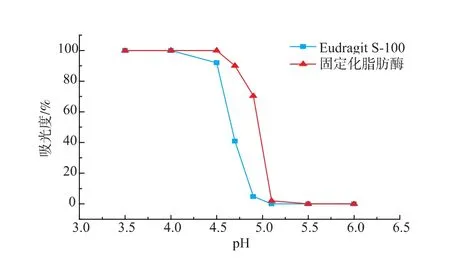
图5 固定化脂肪酶的可溶可逆性Fig.5 Reversible solubility of immobilized lipase
从图5中可以看出,当溶液pH大于5.5时,Eudragit S-100和固定化修饰酶溶液在470 nm处的吸光度均为0%,说明此时修饰剂与固定化脂肪酶均能完全溶解;而当溶液pH低于4时,所有溶液的吸光度值达到最大值,此时修饰剂与修饰酶均已完全沉淀。另外,从图中可以看出,Eudragit S-100与酶共价交联后,其溶解度的pH变化范围向pH大的方向发生了移动。这是因为Eudragit S-100自身是酸性的,当其与酶发生共价连接后,结构中的自由羧基数目减少,从而导致溶解度的pH变化范围向pH大的方向移动。总体来看,脂肪酶与Eudragit S-100进行固定化修饰后,树脂的可溶可逆性没有被破坏,而且其pH响应范围也介于脂肪酶最适pH以下,对于脂肪酶的催化水解以及回收都不会造成太大影响。
2.6 固定化脂肪酶的可重复使用性
将固定化修饰酶溶液的pH调节至4.0,修饰酶会沉淀析出。利用该性质,可以回收使用固定化酶。对不同次数回收后的固定化脂肪酶活力进行测试,结果如图6所示。Fig.6Reuse of immobilized lipase

图6 固定化脂肪酶的可重复使用性
从图6可以看出,Eudragit S-100固定化修饰脂肪酶在一次使用后,其脂肪酶酶活力的保留率约为92%,经过5次重复使用后,脂肪酶酶活力的保留率仍为45%,表现出较好的重复使用性能。在重复使用过程中出现酶活损失的主要原因如下:首先,酶在每次回收过程中无法确保100%回收,沉淀以及冲洗过程会损失一部分酶;其次,在回收过程中,反复调节溶液的pH值改变酶的状态,可能会对酶的活性部位产生影响,导致部分酶失活;最后,酶在使用过程中需要在40℃条件下进行,长时间处于此温度也会导致部分酶失活。
3 结 语
从以上分析可以看出,活化后的可溶可逆载体Eudragit S-100能够成功用于猪胰脂肪酶的固定化修饰,固定化修饰之后,猪胰脂肪酶与载体进行了多点共价交联,而且经过有序折叠,分子结构变得较为紧凑,这导致固定化酶具有较好的温度稳定性和pH稳定性,但是酶活有一定损失。同时,固定化之后的脂肪酶保留了原载体pH响应的可溶可逆性,能够比较方便的从溶液中进行回收,并且具有一定的重复使用性能。
参考文献:
[1]HASAN F,SHAH A A,HAMEED A.Industrial applications of microbial lipase[J].Enzyme and Microbial Technology,2006,39(2):235-251.
[2]DAVIS B G,BOYER V.Biocatalysis and enzymes in organic synthesis[J].Natural Product Reports,2001,18(6):618-640.
[3]YANG Yong,LI Yanfeng,BAI Yongxu,et al.Progress in carrier materials employed in immobilization of enzymes[J].Chemistry,2007(4):257-263.(in Chinese)
[4]LIYang,WEIWei,CAOQian,etal.Newmaterialsforimmobilizedlipase[J].Journal of the Chinese Cereals and Oils Association,2014,29(7):122-128.(in Chinese)
[5]HE Jing,XU Yan,MA Hui,et al.Effect of surface hydrophobicity/hydrophilicity of mesoporous supports on the activity of immobilized lipase[J].Journal of Colloid and Interface Science,2006,298(2):780-786.
[6]MEUNIER S M,LEGGE R L.Evaluation of diatomaceous earth as a support for sol-gel immobilized lipase for transesterification[J].Journal of Molecular Catalysis B:Enzymatic,2010,62(1):53-57.
[7]WON K,KIM S,KIM K J,et al.Optimization of lipase entrapment in Ca-alginate gel beads[J].Process Biochemmistry,2005,40(6):2149-2154.
[8]CHIOU S H,WU W T.Immobilization of Candida rugosa lipase on chitosan with activation of the hydroxyl groups[J].Biomaterials,2004,25(2):197-204.
[9]KHAN M Z I,PREBEG Z,KURJAKOVIC N.A pH-dependent colon targeted oral drug delivery system using methacrylic acid copolymers:I.Manipulation of drug release using Eudragit(R) L100-55 and Eudragit(R) S100 combinations[J].Journal of Controlled Release,1999,58(2):215-222.
[10]WANG R,KIM J H,KIM B S,et al.Preparation and characterization of non-covalently immobilized amylosucrase using a pH-dependent autoprecipitating carrier[J].Bioresource Technology,2011,102(10):6370-6374.
[11]丛峰松.生物化学实验[M].上海:上海交通大学出版社,2005:119-120.
[12]JIANG Huifang,WANG Yaqin,LIU Chunguo.Comparison and improvement of three determination methods for lipase activity[J].Chemistry&Bioengineering,2007,24(8):72-75.(in Chinese)
[13]ZHANG Y Q,TANG L R,AN X,et al.Modification of cellulase and its application to extraction of diosgenin from Dioscorea zingiberensis C.H.Wright[J].Biochemical Engineering Journal,2009,47(1-3):80-86.
[14]DOURADO F,BASTOS M,MOTA M,et al.Studies on the properties of Celluclast/Eudragit L-100 conjugate[J].Journal of Biotechnology,2002,99(2):121-131.
[15]BURSTEIN E A,VEDENKINA N S,IVKOVA M N.Fluorescence and the location of tryptophan residues in protein molecules[J].Photochemistry and Photobiology,1973,18(4):263-279.
[16]QIN Yimin,TANG Jiangtao,WEI Yuanan,et al.Chemical modification and active sites of β-fructosyl-transferase from Aspergillus oryzae GX0011β[J].China Biotechnology,2008,28(6):84-88.(in Chinese)
[17]XIONG Yahong,SU Jianhong,LIU Xiaoping.Study on the hydrolysis catalyzed by modified pocine pancreas lipase by kinetics and thermodynamics[J].Journal of Molecular Catalysis(China),2010,24(5):435-442.(in Chinese)
[18]SHARMA S,KAUR P,JAIN A,et al.A smart bioconjugate of chymotrypsin[J].Biomacromolecules,2003,4(2):330-336.
[19]SILVA C J S M,ZHANG Q H,SHEN J S,et al.Immobilization of proteases with a water soluble-insoluble reversible polymer for treatment of wool[J].Enzyme and Microbial Technology,2006,39(4):634-640.
[20]YU Y Y,YUAN J G,WANG Q,et al.Cellulase immobilization onto the reversibly soluble methacrylate copolymer for denim washing[J].Carbohydrate Polymers,2013,95(2):675-680.
