肺癌体素内不相干运动参数值测量的短期可重复性及影响因素
2018-04-20江建芹蔡荣芳尹剑兵许一鸣何海艳
江建芹,蔡荣芳,崔 磊*,尹剑兵,许一鸣,马 航,何海艳
(1.盐城市第一人民医院影像科,江苏 盐城 224001;2.南通大学第二附属医院影像科,3.胸外科,4.呼吸科,江苏 南通 226001)
DOI:10.13929/j.1003-3289.201707142
DWI体素内不相干运动(intravoxel incoherent motion, IVIM)模型是利用多个b值区分水分子的真性扩散及微循环灌注形成的假性扩散,获得纯扩散系数(true diffusion coefficient, D)及伪扩散系数(pseudo-diffusion coefficient, D*)、灌注分数(perfusion fraction, f),可为早期预测和评估肺癌疗效提供更多信息[1]。但IVIM评估疗效至少需2次检查,而影响前后2次检查稳定性的因素很多,为确保各参数值在病灶治疗前后及在不同病灶间具有可比性,2次检查的可重复性是关键。本研究评估肺癌短期重复扫描IVIM参数值的可重复性,并比较肺癌类型、病灶大小、位置对短期测量可重复性的影响。
1 资料与方法
1.1 一般资料 收集2015年8月—2016年3月经病理或临床随访证实为肺癌的38例患者(38个病灶),男26例,女12例,年龄32~82岁,平均(63.4±11.8)岁;轴位CT示病灶最大径1.6~10.5 cm,平均(3.54±1.98)cm,CT和MR检查时间间隔1~11天,平均 (2.0±1.7)天。纳入标准:①CT显示病灶最大径>1.5 cm,且磨玻璃密度、钙化、坏死、空洞成分小于病灶体积的1/3;②检查前未接受任何抗肿瘤治疗及穿刺、支气管镜等侵入性检查;③无MR检查禁忌证。排除标准:①经组织学或临床随访证实为良性病变以及病变性质不明;②图像质量差,存在明显伪影,无法进行评判。本研究经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Verio 3.0T MR扫描仪,8通道相控阵体表线圈。嘱患者仰卧,头先进,扫描范围自胸廓入口至肺下界。扫描序列包括MR常规平扫(冠状位和轴位T2W、轴位T1W)及IVIM扫描。IVIM采用轴位单次激发自旋平面回波序列,10个b值分别为0、50、100、150、200、250、300、500、800、1 000 s/mm2,自由呼吸方式,TR 7 600 ms,TE 67 ms,矩阵128×160,FOV 38 cm×31 cm,层厚6 mm,层间距 6.6 mm,采集时间661 s。在第1次扫描结束后,嘱患者休息,30 min后采用相同参数设置行第2次T2W及IVIM扫描(间隔0.5~1.0 h)。
1.3 数据分析 采用德国癌症研究中心开发的开源图像处理软件(medical imaging interaction toolkit, MITK;MITK Diffusion, Version 2014; DKFZ, Heidelberg, Germany;www.mitk.org),将扫描所得多b值DWI图像加载到MITK软件的IVIM模块下,将b值调至200 s/mm2,参考T2WI,于肿瘤最大层面的IVIM图上距离病灶边界内缘5 mm手动勾画ROI,避开肉眼所见钙化、血管、坏死、伪影等,记录软件自动计算所得f、D、D*值,测量3次,取均值。
由2名测量者(测量者A、B分别有8年、3年MRI阅片经验)分别独立测量并记录,对每次扫描图像分别测量2次,间隔至少2周。
[2]方法,在轴位肺窗图像上(窗宽1 400 HU、窗位-66 HU)将病灶分为上、中、下3个区域(上中以气管隆嵴为界,中下以肺静脉为界)。
1.4 统计学分析 采用SPSS 22.0统计分析软件,符合正态分布的计量资料以±s表示,非正态分布者以中位数(四分位间距)表示。采用配对样本t检验(正态分布)或Wilcoxon检验(非正态分布)比较重复测量和重复扫描的系统误差。采用组内相关系数(intraclass coefficient, ICC)评价同一测量者和不同测量者的一致性和可重复性,ICC>0.75为一致性好。通过组间变异系数(within coefficient of variation, WCV;前后两次测量所得数据差值的绝对值之和与两次所得数据均值之和的比值)比较肺癌类型(周围型、中央型)、最大径(≥2 cm、<2 cm)、位置(上、中、下肺野)对各参数值测量变异程度的影响。
2 结果
38例中,31例经病理证实,其中腺癌18例,鳞癌7例,小细胞癌3例,腺癌伴鳞癌分化1例,未明确非小细胞肺癌类型2例;余7例经临床6个月以上随访证实,均未接受抗肿瘤治疗,其中4例随访见多发转移灶,另3例随访1个月、3个月复查病灶明显增大。中央型和周围型肺癌病灶大小及分布见表1。

表3 2次扫描测量不同类型、大小、位置肺癌D、D*、f的WCV(%)

表1 不同类型肺癌病灶的最大径及分布(例)
所有参数2次测量的误差差异均无统计学意义(P均>0.05)。同一测量者和测量者间一致性好(ICC为0.845~0.986)。D*和f值的变异系数(WCV为19.88%~36.83%)明显高于D值(WCV为2.97%~4.62%),见表2。
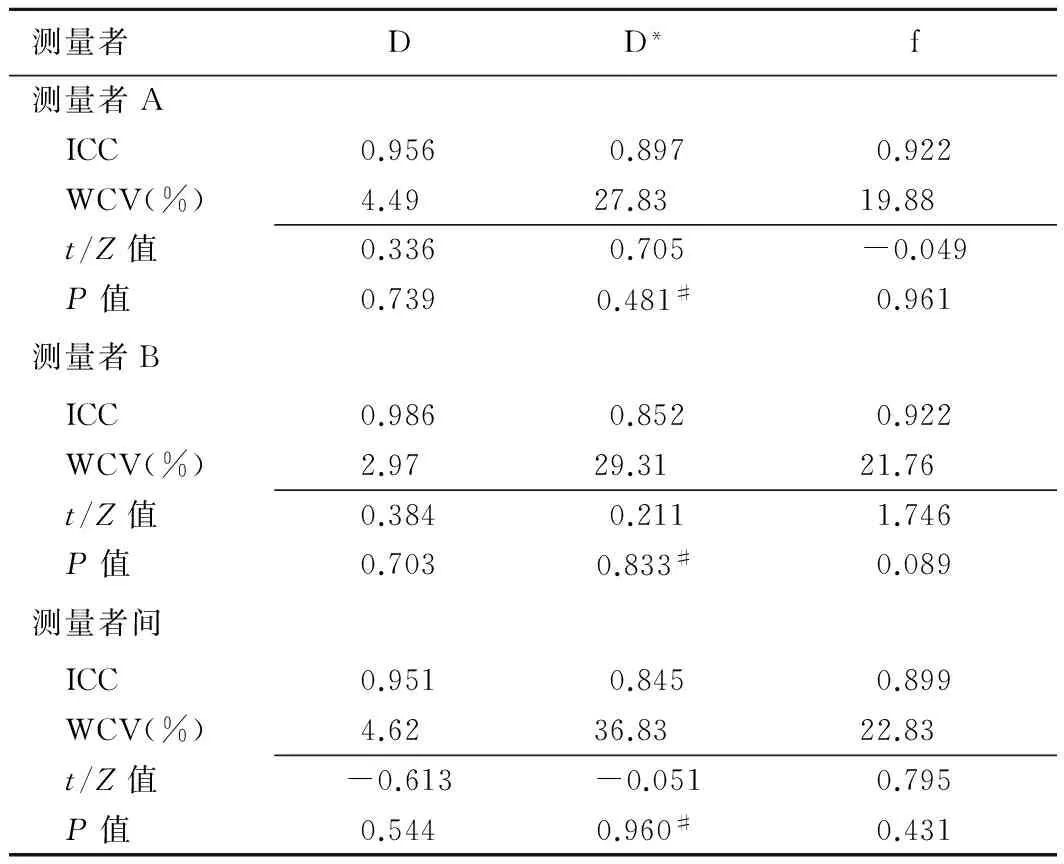
表2 同一测量者和2名测量者间IVIM参数测量的可重复性和一致性
注:#:采用Wilcoxon非参数检验;余采用配对样本t检验
2次扫描测量的D值WCV为7.63%~14.44%,D*和f的WCV为22.02%~79.70%;除D*值外,周围型肺癌D和f的WCV低于中央型肺癌;对≥2 cm病灶,D值的WCV较小,而f的WCVs较大;D值从上至下肺野WCV依次增加,f值在中肺野WCV最大,D*值在上肺野的WCV最大,见表3,图1、2。
3 讨论
IVIM是近年来发展的新技术,目前在肺癌诊断[3-5]、鉴别肺癌与阻塞性肺不张[6]等方面已显示出可行性和临床价值。对鼻咽癌等肿瘤治疗后评价IVIM参数值的变化率,可早期反映放化疗疗效以及抗血管生成药疗效[7-8];但在肺癌疗效评估方面仅见于治疗前参数对同步放化疗疗效预测[9]。既往研究[3,10-12]表明,IVIM灌注参数可重复性较低,评估2次扫描测量各参数值可重复性是合理运用IVIM参数值评估肺癌疗效的前提。
由于前后2次检查的时间间隔较短,肿瘤内微环境改变或患者基础代谢的变化可忽略不计,各参数值重复扫描的差异主要来源于呼吸运动、心脏搏动、磁敏感等伪影导致的测量误差及观察者的测量误差[10]。本研究中同一测量者和不同测量者D值的可重复性最好,提示D值可代表肿瘤组织内水分子扩散运动能力的特性,受测量及扫描的误差影响较小;而D*和f的短期可重复性相对较差,提示D*和f的临床价值有待商榷,与既往研究[10-11]结果类似,其原因可能在于目前采用的非线性最小二乘法拟合模型(nonlinear least squares, NLLS)导致灌注参数的测量误差增大,增加低b值的数量可提高其拟合准确性[11-12]。受限于设备,本研究中低b值(≤200 s/mm2)数量已取到最多;其次,ROI放置位置不同,可能导致排除血管和坏死成分有差异;有学者[13]认为其他流动现象如管状流动或腺体分泌也可导致在低b值下的信号衰减,且可能难以与灌注效应区分,提示在改进后处理算法的基础上提高IVIM参数在低信噪比时的测量准确性,可使D*、f更加可靠。
本研究发现,除外D*,周围型肺癌的测量变异稍低于中央型肺癌,可能因中央型肺癌多紧邻肺门,随着扫描时心脏、大血管搏动幅度的差异,病灶位置发生错配,邻近血管的部分容积效应导致图像信号强度增加,且伴随的阻塞性肺炎或肺不张可导致勾画ROI难度增加。病灶的部分容积效应随病灶增大而降低,Bernardin等[2]研究显示,当恶性肺肿瘤最大径<2 cm时,ADC值的可重复性较差。在肺癌疗效评估方面,经有效治疗后多数病灶变小,故本研究纳入最大径<2 cm病灶,结果显示D与Bernardin等[2]对ADC值的研究结果相符,但D*、f存在差异,因随病灶增大,肿瘤不均质性增加,表现为更多坏死和新生血管[14],而D*、f与组织内血管成分相关[6],勾画ROI时易受是否真正避开血管的影响而使差异增大。有关病灶位置,由于呼吸伪影从上肺野到下肺野逐渐增大[15],因此理论上上肺野病灶的测量变异程度最小,下肺野病灶的测量变异程度最大。本研究仅D值与之相符,且发现中央型肺癌f值最不稳定;上肺野病灶中D*的测量误差增加,可能因肺尖易受磁化率伪影及脂肪抑制不充分的影响[7],T2透射效应增加,D*图像伪影也随之增加。以上结果提示,评估肺癌疗效时,尽量选择较大、较均匀的病灶,且在检查前规范化呼吸训练,并尽可能使用心电门控技术;其次还需注意肺尖区伪影的处理,尽可能使线圈贴紧病灶或加用颈线圈;对中央型肺癌f值进行测量时,需注意避开血管。

图1 患者女,47岁,中央型肺腺癌(病灶最大径为4.5 cm) A、B.第1次扫描(A)和第2次扫描(B)的IVIM图(b=800 s/mm2); C、D.分别生成的IVIM曲线图(红色的点代表D值的拟合,黑色的点代表D*、f值的拟合)。测量者A的2次测量结果分别为:D=1.18×10-3 mm2/s和1.23×10-3 mm2/s,D* = 15.90×10-3 mm2/s和8.45×10-3 mm2/s,f=12.15%和5.16%。测量者B的2次测量结果分别为:D=1.15×10-3 mm2/s和1.20×10-3 mm2/s,D* =11.43×10-3 mm2/s和5.47×10-3 mm2/s,f=9.90%和3.97%

图2 患者男,51岁,周围型肺腺癌(病灶最大径为2.1 cm) A、B.第一次扫描(A)和第二次扫描(B)的IVIM图(b=800 s/mm2); C、D.分别生成的IVIM曲线图(红色的点代表D值的拟合,黑色的点代表D*、f值的拟合)。测量者A的测量结果分别为:D=0.84×10-3 mm2/s和0.79×10-3 mm2/s,D*=17.39×10-3 mm2/s和148.51×10-3 mm2/s,f=11.01%和2.65%。测量者B的测量结果分别为:D=0.84×10-3 mm2/s和0.81×10-3 mm2/s,D*=5.47×10-3 mm2/s和148.51×10-3 mm2/s,f=6.66%和0.13%
本研究的局限性:①样本量少,且为前瞻性研究,病灶的分布不均匀;②仅31例有组织病理学结果;③b值的数量偏少;④因小病灶(<2 cm)非中心层面的容积效应高、误差大,且体积法较为繁琐,仅选择单一层面ROI;⑤影响肺癌短期可重复性的因素较多,本研究仅探讨病灶类型、大小、位置,对于其他因素有待进一步探讨。
总之,本研究评估了IVIM参数值在肺癌短期重复扫描的可重复性,其中D值可重复性好,而D*、f的可重复性较差;肺癌的类型、大小和位置是短期重复扫描可重复性的影响因素。
[
]
[1] Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: Application to diffusion and perfusion in neurologic disorders. Radiology, 1986,161(2):401-407.
[2] Bernardin L, Douglas NH, Collins DJ, et al. Diffusion-weighted magnetic resonance imaging for assessment of lung lesions: Repeatability of the apparent diffusion coefficient measurement. Eur Radiol, 2014,24(2):502-511.
[3] Koyama H, Ohno Y, Seki S, et al. Value of diffusion-weighted MR imaging using various parameters for assessment and characterization of solitary pulmonary nodules. Eur J Radiol, 2015,84(3):509-515.
[4] Deng Y, Li XC, Lei YX, et al. Use of diffusion-weighted magnetic resonance imaging to distinguish between lung cancer and focal inflammatory lesions: A comparison of intravoxel incoherent motion derived parameters and apparent diffusion coefficient. Acta Radiol, 2016,57(11):1310-1317.
[5] Yuan M, Zhang YD, Zhu C, et al. Comparison of intravoxel incoherent motion diffusion-weighted MR imaging with dynamic contrast-enhanced MRI for differentiating lung cancer from benign solitary pulmonary lesions. J Magn Reson Imaging, 2016,43(3):669-679.
[6] Wang LL, Lin J, Liu K, et al. Intravoxel incoherent motion diffusion-weighted MR imaging in differentiation of lung cancer from obstructive lung consolidation: Comparison and correlation with pharmacokinetic analysis from dynamic contrast-enhanced MR imaging. Eur Radiol, 2014,24(8):1914-1922.
[7] Xiao-Ping Y, Jing H, Fei-Ping L, et al. Intravoxel incoherent motion MRI for predicting early response to induction chemotherapy and chemoradiotherapy in patients with nasopharyngeal carcinoma. J Magn Reson Imaging, 2016,43(5):1179-1190.
[8] 江建芹,崔磊,顾晓雯,等.体素内不相干运动模型扩散加权成像在肿瘤疗效评估中的进展.中国医学影像技术,2017,33(6):949-953.
[9] 陶秀丽,欧阳汉,吴宁,等.扩散加权成像对非小细胞肺癌放疗及同步放化疗疗效的预测价值.中华放射学杂志,2016,50(10):740-745.
[10] Kim SY, Lee SS, Byun JH, et al. Malignant hepatic tumors: Short-term reproducibility of apparent diffusion coefficients with breath-hold and respiratory-triggered diffusion-weighted MR imaging. Radiology, 2010,255(3):815-823.
[11] Kakite S, Dyvorne H, Besa C, et al. Hepatocellular carcinoma: Short-term reproducibility of apparent diffusion coefficient and intravoxel incoherent motion parameters at 3.0T. J Magn Reson Imaging, 2015,41(1):149-156.
[12] Andreou A, Koh DM, Collins DJ, et al. Measurement reproducibility of perfusion fraction and pseudodiffusion coefficient derived by intravoxel incoherent motion diffusion-weighted MR imaging in normal liver and metastases. Eur Radiol, 2013,23(2):428-434.
[13] Koh DM, Collins DJ, Orton MR. Intravoxel incoherent motion in body diffusion-weighted MRI: Reality and challenges. AJR Am J Roentgenol, 2011,196(6):1351-1361.
[14] Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med, 2012,366(10):883-892.
[15] 季娟,崔磊,张晨滢,等.规范化呼吸训练在多层螺旋CT胸部检查中的临床应用价值.实用放射学杂志,2015,31(8):1186-1189.
