中等强度游泳运动对海马突触可塑性的调节
2018-04-20马春莲丁海超梅志强
马春莲,丁海超,梅志强,柳 华,杨 翼
中等强度游泳运动对海马突触可塑性的调节
马春莲1,丁海超2,梅志强2,柳 华3,杨 翼3
1.武汉体育学院 体育科技学院, 湖北 武汉 430205; 2.武汉体育学院 研究生院, 湖北 武汉 430079; 3.武汉体育学院 健康科学学院, 湖北 武汉 430079
目的:探索中等强度游泳运动对海马突触可塑性影响的时效性及延续性特点。方法:雄性SD大鼠48只,随机分为对照组(CG)、3天运动组(3D)、7天运动组(7D)、15天运动组(15D)、5周运动组(5W)、5周运动后延迟1周组(P5W),利用免疫荧光、电镜、Western blot技术分别对各组大鼠海马组织进行细胞增殖、突触可塑性、突触结构蛋白表达的检测。结果:CG、3D、7D、15D、5W、P5W组大鼠海马齿状回颗粒细胞下层细胞增殖率(%)分别为31.70±1.57、40.19±2.40、36.74±4.06、51.70±5.93、52.90±6.10、51.97±1.47,15D、5W、P5W组大鼠细胞增殖率均显著性高于对照组(<0.05);5W、P5W组突触数目、PSD厚度显著性高于CG组(<0.05,<0.001),5W、P5W组的突触间隙宽度显著性小于CG组(<0.05,<0.001),15D组PSD厚度显著性高于CG组(<0.05);海马结构蛋白MAP2的表达5W组、P5W组显著性高于CG组(<0.05,<0.001),15D、5W、P5W组SYP的表达显著性高于CG组(<0.05)。结论:中等强度游泳运动诱导的海马可塑性变化具有运动时间依赖性;运动诱导的突触可塑性变化在停止运动后还具有延续性。
运动;海马;突触可塑性
突触在内外环境改变的情况下通过修饰其组织结构提高机能称为突触可塑性[12]。海马的突触可塑性是海马依赖性学习、记忆、认知能力提高的生物学基础。海马内部组织的病变与帕金森、阿尔茨海默氏症、癫痫、抑郁等神经、精神疾病的发病有关[4,26],而海马的突触可塑性为以上疾病的预防和治疗提供了新思路。运动作为一种强烈的机体刺激,广泛地参与了海马突触可塑性的调节。有研究证明,运动参与调节了海马神经干细胞的分化[38],新生神经细胞的存活和成熟[21]。中等强度运动还可以增加树突棘的活性、蘑菇状棘的密度以及促进树突棘的生长,调节其与现存神经通路的整合[40]。此外,运动也参与了突触结构蛋白表达的调节[3],诱发突触长时程增强(long-term potentiation, LTP),逆转老年大鼠增龄性LTP的下降[34,35],从而维持突触的信息传递效率。
大量研究资料显示,体育运动可对海马突触可塑性产生有益作用[2]。但是,文献中关于运动与海马突触可塑性时效关系的研究尚未见报道。本实验研究中,我们以不同运动时长的中等强度游泳运动对大鼠进行干预,通过免疫荧光、电镜和western blot技术,试图从海马细胞增殖、突触可塑性等方面,探索运动对海马突触可塑性的影响,以及中等强度游泳运动调节海马突触可塑性的时效关系。在老龄化社会背景下,为更好地利用体育运动这一种低成本、非药物手段提高认知能力、预防和治疗某些神经、精神疾病提供理论参考。
1 材料与方法
1.1 实验动物分组及运动方案
2月龄SD大鼠48只,适应性喂养1周后随机分为对照组(CG)、3天运动组(3 D)、7天运动组(7 D)、15天运动组(15 D)、5周运动组(5 W)、5周运动后延迟1周组(P5 W),每组8只。CG组常规饲养不运动,运动组参照张钧等中等强度运动方案[5],进行无负重游泳运动。各运动组在正式运动干预前一天进行适应性游泳15 min。3D、7D、15D组分别进行3、7、15天的游泳运动(1次/天,40分钟/次)。5 W及P5 W组均进行5周的游泳运动(5天/周,1次/天,40 min/次),P5 W在运动方案结束后,进行1周常规饲养后取材进行各种测试。
1.2 BrdU腹腔注射
BrdU为胸腺嘧啶的衍生物,可标记脱氧胸腺嘧啶核苷来标记正在分裂的细胞,是细胞增殖的常用标记物[36]。将BrdU溶解于0.9%的生理盐水,配制成20 mg/ml浓度的溶液,避光于4℃冰箱暂时储存。注射计划在大鼠取材前3天开始,按照50 mg/kg体重的标准[29],进行腹腔注射,每天1次,连续注射3天[25]。
1.3 海马取材
大鼠断头,从枕骨大孔开颅取脑组织置于冰上,从大脑皮质后缘前方2 mm处,将大脑皮质向纵深切入1 mm,掀开大脑皮质暴露出海马并分离。将分离出的海马根据需要分别浸泡于4%多聚甲醛溶液或戊二醛电镜液中进行固定,以便制备石蜡切片和用于电镜检测。用于Western blot检测的海马置于EP管存放于-80℃冰箱。
1.4 免疫荧光检测
将4%多聚甲醛固定后的海马制成石蜡切片,将切片用二甲苯脱蜡,梯度酒精复水,置于EDTA缓冲液微波中火至沸修复2次。自然冷却切片,PBS清洗(5 min×3次),3%双氧水消除内源性过氧化物酶活性,室温孵育10 min。用PBS清洗(5 min×3次),5% BSA封闭30 min。加入50 μl BrdU抗体(鼠抗,1:100稀释)覆盖组织,4℃过夜。PBS清洗(5 min×3次),加70 μl CY3标记的山羊抗鼠二抗(1:50稀释)覆盖组织,4℃孵育50 min。PBS清洗(5 min×3次),加70 μl DAPI染液覆盖组织,室温避光孵育5 min。PBS清洗(5 min×3次),滴加适量的荧光淬灭剂覆盖组织,甘油缓冲液封片,荧光显微镜下观察并拍照。用Image Pro Plus 6.0图像分析系统将荧光图片进行细胞计数、保存,计算细胞增殖率。
1.5 透射电镜检测
海马经戊二醛电镜液固定2 h后,将其CA1区切成1 mm3大的小块,重新放入新的电镜液中固定。用环氧树脂对固定后的海马组织渗透、包埋,之后进行超薄切片。用乙酸双氧铀和柠檬酸铅双重染色。透射电镜下依次从3 000到 10 000倍逐渐放大并观察海马组织、拍照保存。用Adobe Photoshop CS6 打开5 000倍的海马电镜图片,计数相同视野下突触个数并记录,为后期的统计分析做准备。用Image Pro Plus 6.0图像分析系统打开10 000倍的海马电镜图片,测量每张图片上每个突触的突触活性区的长度、突触间隙宽度、突触后致密物厚度。
1.6 Western blot实验
将海马组织剪碎与20倍于组织体积的裂解液充分混合,进行5 min的匀浆和超声,4℃离心机12 000 rpm离心 10 min,取上清并置于-80 ℃保存。BCA法测试总蛋白,计算样本总蛋白的浓度,将上清与上样缓冲液按比例混匀,100℃煮10 min,使蛋白变性。制备8 %和12 %的分离胶,分别用以检测微管相关蛋白2(Microtubule associated protein 2, MAP2)和突触囊泡蛋白(Synaptophysin, SYP),去离子水封胶,待分离胶凝固后倒掉去离子水加入浓缩胶,插入梳齿。将制备好的胶加入蛋白样品和蛋白Marker各40 μg,先恒压80 V电泳至溴酚蓝在浓缩胶与分离胶交界处,后恒压120 V至溴酚蓝到凝胶底部。将电泳后的胶转到NC膜上(MAP2转膜150 min,SYP转膜90 min)。转膜后,以5%的脱脂奶粉溶液,室温摇床上封闭1h,TBST缓冲液清洗(10 min×3次)。5% BSA稀释过的一抗溶液孵育(Abcam公司的Anti-MAP2 1:1 000,Anti-SYP 1:1 000,CST公司的Anti-GAPDH 1:3 000),摇床摇动4℃过夜。一抗孵育后,PBS洗膜(15 min×3次),HRP标记的二抗溶液孵育2 h(CST公司Anti-rabbit IgG HRP 按1:20 000比例用5%脱脂奶粉稀释)。二抗孵育后,TBST缓冲液清洗(10 min×3次),ECL工作液显影曝光,采集图片。应用Image J.exe图像处理系统读取计算各条带OD值。
1.7 统计学分析

2 实验结果
2.1 运动诱发齿状回颗粒下层细胞的增殖

图1 各组大鼠海马齿状回免疫荧光染色(200倍,*P<0.05 vs CG组)
Figure 1 Immunofluorescence Staining of Dentate Gyrus in Each Group
图1所示,蓝色颗粒为4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)标记的海马颗粒细胞核,红色为BrdU标记的新生神经细胞。各组海马齿状回颗粒细胞下层都出现了被BrdU标记为红色的新生细胞。对照组BrdU标记的新生细胞较少,而且细胞排列疏松,运动组阳性颗粒数目多,细胞排列紧密,尤其是5W、P5W组。统计发现,CG、3D、7D、15D、5W、P5W组大鼠海马齿状回颗粒细胞下层细胞增殖率(%)分别为31.70±1.57、40.19±2.40、36.74±4.06、51.70±5.93、52.90±6.10、51.97±1.47。15D、5W、P5W组大鼠的细胞增殖率均显著性高于CG组(<0.05),3组之间没有统计学差异。3D、7D组细胞增殖率均高于CG组,但没有统计学差异(>0.05)。3D组细胞增殖率比7D组高,相比CG组出现一个急剧增加的波动,但没有统计学差异(表1)。

表1 各组大鼠海马齿状回细胞增殖率
(*<0.05 vs CG组)
2.2 运动诱发海马突触产生可塑性
电镜观察发现,在5 000倍视野下CG组海马CA1区域有空泡出现,线粒体数目较少,突触分布稀疏,而运动组线粒体分布较多,突触排列密集(图2)。CG、5W、P5W组每个视野突触数目分别为4.67±0.24个、4.89±0.45个、3.22±0.28个,5W、P5W组显著性高于CG组(<0.05,表2)。相比CG组,3D、7D、15D组海马CA1区突触数目略有增加,分别为3.44±0.34个、4.00±0.33个、4.33±0.33个,突触数目增加呈运动时间依赖趋势,但CG、3D、7D、15D组之间并没有统计学差异(>0.05)。

图2 各组大鼠海马CA1区突触(5 000倍)
Figure 2 Electron Microscope of the Synapses in Hippocampal CA1 Area
注:*<0.05 vs CG 组,#<0.05 vs 3D组,箭头所指为突触。
10 000倍视野下可见CG组突触间隙较宽、PSD厚度较薄,突触囊泡不清晰。运动组突触间隙较窄、PSD增厚,突触囊泡清晰(图3)。对各组的突触活性区长度、突触间隙宽度及PSD厚度进行测量及统计分析(表2)。结果表明,游泳运动没有造成各组之间突触活性区长度的差异(>0.05)。5W、P5W、CG组大鼠的突触间隙分别为20.86±0.61 nm、20.40±0.80 nm、25.16±0.99 nm,5W、P5W组的突触间隙宽度显著性小于CG组,显著性水平分别为<0.05和<0.01。5W、P5W组突触间隙宽度没有统计学差异(>0.05),但P5W组的间隙宽度略低于5W组,显著性低于3D组(<0.05)。CG、3D、7D、15D组的突触间隙宽度分别为25.16±0.99 nm、24.62±1.02 nm、24.10±1.02 nm、23.71±1.45 nm,组间没有统计学差异(>0.05)。各组突触间隙宽度值对比发现,运动对突触间隙宽度的影响同样呈现出运动时间依赖趋势。对PSD厚度的计算发现,15 D组PSD厚度显著性高于CG组(<0.05)。5W组和P5W组的PSD厚度极显著性高于CG组(<0.001),P5W组还显著性高于3 D组(<0.05)。15D、5W、P5W组的PSD厚度之间没有统计学差异。CG、3D、7D组间PSD厚度也没有显著性差异,但同样表现出随运动时间延长依赖性增加趋势(表2)。

图3 各组大鼠海马CA1区代表性突触(10 000倍)
Figure 3 Representative Synapses of Hippocampal CA1 Area
注:*<0.05,**<0.01,***<0.001 vs CG组,#<0.05 vs 3D组

表2 大鼠海马CA1区突触相关指标
*<0.05,**<0.01,***<0.001 vs CG组,#<0.05 vs 3D 组
2.3 运动上调了突触结构相关蛋白的表达
Western blot法检测各组大鼠海马MAP2和SYP的表达(图4)。海马MAP2的表达具有随运动时间延长依赖性增高的趋势。其中,5W组MAP2表达最高,P5W组MAP2的表达略回落,5W组MAP2的表达极显著性高于CG组(<0.01),显著性高于3D组和7D组(<0.05),P5W组MAP2的表达显著性高于CG组(<0.05)。5W组和P5W组之间没有统计学差异。SYP蛋白对运动刺激相对敏感,3D、7D组SYP的表达与CG组相比,没有出现显著性变化,但15D组SYP的表达显著性上调(<0.05)。5W组SYP的表达最高,P5W组略回落,两组SYP蛋白的表达均极显著性地高于对照组(<0.01),显著性地高于3D组(<0.05),5W组SYP的表达还显著性高于7D组(<0.05)。
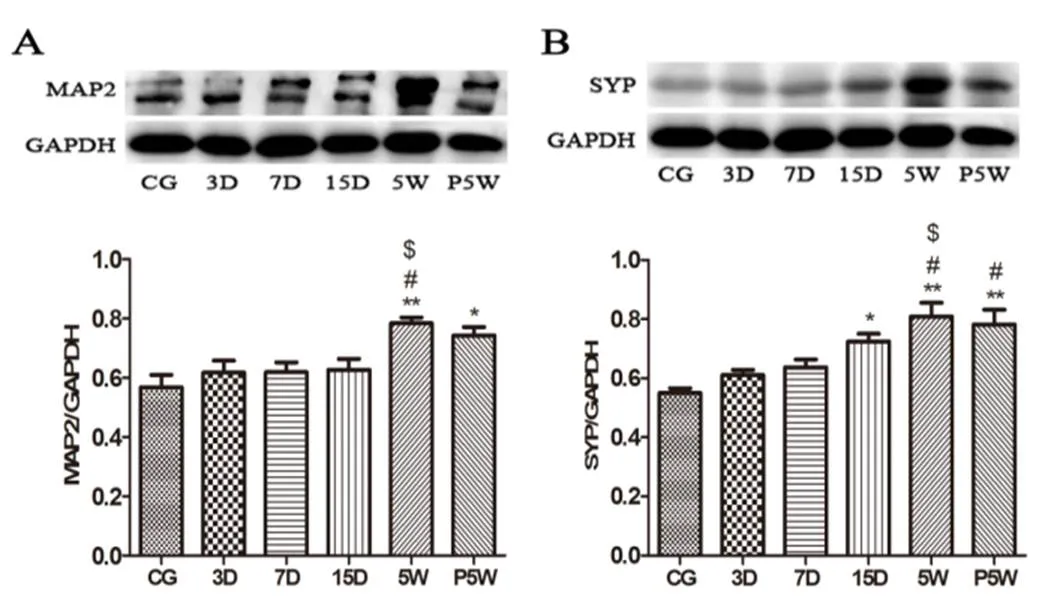
图4 各组大鼠海马MAP2(A)和SYP(B)的蛋白表达
Figure 4 A. The Expression and Bar Graph of Hippocampal MAP2(A) and SYP(B) in Each Group
注:*<0.05,**<0.001 vs CG组;#<0.05 vs 3D组;$<0.05 vs 7D组
3 分析讨论
3.1 运动与海马颗粒下层细胞的增殖
在20世纪60年代,人们发现在啮齿类动物脑内存在神经干细胞,1988年,Eriksson等利用BrdU标记技术首次证实人类海马中存在神经细胞增殖[16]。海马齿状回颗粒下层的神经干细胞终生不断分化神经细胞[20]。新生神经细胞产生后,可以与其它神经元建立突触联系,被募集到既存的神经通路[30],参与海马依赖性的功能调节。主动转轮运动可以显著性地促进海马神经干细胞的分化[38],调节新生神经元的成熟及神经通路的整合[40]。运动强度是调节海马神经增殖的重要因素,乳酸阈上强度运动可以显著性增加海马细胞增殖,而乳酸阈下强度运动可以促进新生神经元的存活和成熟[21]。
本研究结果显示(图1,表1),3天、7天的短期运动虽然能轻微上调海马颗粒下层细胞的增殖率,但与对照组相比没有显著性差异(>0.05)。15天、5周中等强度的游泳运动皆显著性地促进了海马颗粒下层细胞增殖率,5周游泳运动停止1周后细胞增殖率也未下降。海马神经细胞增殖是认知能力增强的基础[38],运动诱导海马神经增殖的同时也伴随着空间认知能力及齿状回LTP的增强[39]。新生神经元相比成熟神经元由于兴奋性比较高,更易于被募集到现有的神经网络[33],建立新的功能性突触,活化神经网络,调节由于神经细胞衰老、病变等导致的功能失调,恢复或提高神经信息传递效率[17]。本实验结果提示,中等强度游泳运动对海马神经细胞增殖的调节具有时间依赖特性,15天及更长时间的中等强度游泳运动诱导海马产生细胞增殖,运动诱导的海马细胞增殖效果具有延续性。运动诱导的新生神经元在功能上可以替代已经衰老或损伤的神经元,从而提高功能性和非功能性突触的比率,活化海马神经传递网络,提高海马依赖性的功能。有趣的是,相比CG组、7D组,3天游泳运动使海马齿状回细胞增殖率出现了急剧增高的波动。房国梁等研究发现,急性有氧运动会使大鼠海马组织PI3K mRNA及其蛋白表达出现急性反应[1]。大鼠进行一次1h急性有氧运动,运动后12hPI3K p110 mRNA含量达到最高,24hPI3K p110蛋白含量达到最高,48hPI3K mRNA及其蛋白表达量均下降至对照组水平。本研究中3D组海马齿状回细胞增殖率表现出急剧增加的波动,应该是短期运动诱发海马齿状回细胞增殖率先增高后降低的急性反应过程。但是,短期运动诱发的急性反应并没有使3D组海马齿状回细胞增殖率出现显著性增高。
3.2 运动对突触数量和结构可塑性的影响
突触是神经元之间发生功能联系的结构基础。在记忆形成过程中,某些突触被诱导产生活性依赖的突触可塑性是信息储存的前提条件,也是学习、记忆等认知活动产生的分子生物学基础[32]。在中枢神经系统中,突触数量的多少直接影响中枢神经系统信息传递的效率。本研究结果显示(图2,表2),对照组海马CA1区突触数量较少,排列稀疏,运动使大鼠海马CA1区突触数量增加。5周中等强度的游泳运动可以使突触密度显著性增加(<0.05)。5周运动诱导的突触增加效应在运动停止1周后仍然具有延续性。3天、7天、15天等中等强度的游泳运动诱使海马CA1区突触数量逐渐增加,但相比对照组突触数量并未发生显著性变化。研究结果提示,运动诱导突触显著性增加需要一定的时间阈值才可以发生,少于15天的短期运动是不容易使突触数量发生显著性增加的。
突触活性区是突触前神经末梢突触囊泡释放的位置[10]。突触活性区长度是神经递质释放效率和递质受体数量多少的重要影响因素,其复杂的分子结构介导着突触传递的速度、精度和可塑性[23]。本研究结果显示(图3,表2),短到3天长到5周的中等强度游泳运动皆未使突触活性区长度产生变化,表现出突触活性区的长度对运动刺激反应的惰性。
大脑中的信息整合由突触的数量及突触快速反应的动力学所决定[31,9],后者取决于突触间隙内神经递质的浓度[7]。窄的突触间隙可以提升间隙内神经递质的浓度,易于使突触受体电流达到最大值,从而增强突触受体的激活[27],提高信息传递效率。有研究显示,14天丰富环境使中动脉阻塞模型大鼠海马突触间隙显著性变窄[37]。本研究中,3天、7天、15天中等强度的游泳运动使突触间隙宽度表现出运动时间依赖性降低的趋势,15天的游泳运动使突触间隙宽度产生了量变,这种量变还并未达到质变的阈值(图3,表2)。突触传递效率和突触间隙宽度有密切的相关性,当突触宽度分布在12~20 nm之间时,突触传递效率达到最高值[27]。本研究中,5W及P5W组突触间隙宽度分别为20.86±0.61 nm、20.40±0.80 nm,已经非常接近最优突触间隙范围。根据本研究突触间隙宽度值随运动时间延长而降低的趋势推理,进行5周以上中等强度的运动应该可以使突触达到最佳突触间隙,从而进一步提高突触信息传递效率和认知能力。
突触后致密物(postsynaptic density,PSD)是位于神经元突触后膜特异化的细胞骨架蛋白,参与管理和浓缩化学性突触的神经递质受体,调节突触效能,是突触可塑性的重要影响因素[8]。PSD-95是目前研究最广泛的一种兴奋性突触PSD支架蛋白,环境、行为、药物等因素会影响PSD的厚度,从而影响突触传递效率。有研究结果显示,7天的自由转轮运动可以使海马PSD-95蛋白表达发生显著性上调[19]。但本实验中,7天中等强度的游泳运动并未使PSD产生显著性地增加(>0.05)。产生这种结果差异的原因或许由于PSD-95只是PSD的一种组成部分,7天运动导致的PSD-95显著性变化并不能使总PSD产生质的改变。此外,不同的检测方法和造模方式也是产生结果差异可能的原因。文献资料显示,高强度跑台运动使PSD-95的表达出现抑制,而4周中等强度跑台运动使PSD-95表达出现显著性增加[3]。以上研究结果与本研究中5周中等强度游泳运动使PSD厚度极显著性增加(<0.001)的结果一致,并且本研究发现,运动诱导的PSD厚度增加的效应具有延续性。
3.3 运动与突触结构相关蛋白的表达
树突结构的微小改变可以很大程度地改变总的树突蛋白受体的输入和输出,在神经元活性方面甚至比树突棘密度还重要[11,18]。MAP2存在于神经元胞体及树突,其表达增加是树突生长的标志[13]。神经发生过程中,MAP2可以同时与微管及F-微丝相互作用,这种能力对于突触发芽至关重要[14]。此外,MAP2参与了树突的延长及树突棘的修饰过程,是突触结构动态变化的重要参数[28]。突触囊泡是运输神经递质到突触间隙以及通过与质膜融合使神经元间信号扩散的细胞器[6]。SYP是位于轴突末梢中突触囊泡上的一种囊泡吸附蛋白[22],是最先被发现的突触蛋白之一,广泛表达于哺乳动物大脑的突触,参与调节突触囊泡的停靠、融合和内吞以及突触的丢失和可塑性[6,24]。本研究中(图4),MAP2及SYP蛋白的表达都表现出随运动时间延长依赖性增高的趋势。5周中等强度的游泳运动使MAP2、SYP高度表达(<0.01),运动停止1周后MAP2、SYP的表达略有回落,该结果与Bressloff等学者的研究一致[8]。Derksen等学者研究发现,3天跑台运动能使MAP2蛋白表达显著性增加,在复杂运动技能学习的第1、3、5天就使SYP增加[15]。本研究结果显示,SYP相比MAP2对运动更加敏感,15天中等强度的游泳运动显著性地上调SYP的表达(<0.05),而3天、7天的短期运动并未达到如上述文献所述的效应(图4)。
4 结论
中等强度游泳运动诱导的海马突触可塑性变化具有随运动时间延长而增加的依赖性。
运动诱导的突触可塑性变化在停止运动后还具有延续性。
[1] 房国梁,李鹏飞,于涛,等.急性有氧运动对大鼠海马组织PI3K/ Akt/GSK3β信号通路的影响[J].北京体育大学学报,2016,39(4): 55-59.
[2] 马春莲,杨翼.运动影响脑可塑性及其分子机制研究进展[J].中国运动医学杂志,2015,34(8): 821-826.
[3] 任鹤菲,陈立军,于利人,等.不同强度运动负荷对大鼠认知情绪变化及NMDA受体、PSD-9和KIF-17mRNA和蛋白表达的影响[J].中国康复医学杂志,2016, 31(7):746-751.
[4] 王莉智,和荣丽,杨桂姣,等.自主跑轮运动对阿尔茨海默病模型小鼠学习记忆能力和海马内炎性细胞因子表达的影响[J].中国运动医学杂志,2017,36(4):328-332.
[5] 张钧, 陈晓莺,许豪文. 运动对心肌细胞中凋亡调控基因表达的影响[J].体育科学,2005,25(8):79-82.
[6] ADAMS D J, ARTHUR C P, STOWELL M H. Architecture of the synaptophysin/synaptobrevincomplex: structural evidence for an entropic clustering function at the synapse [J]. Sci Rep, 2015, 5(9): 1-9.
[7] BERGLES D E, DZUBAY J A, JAHR C E. Glutamate transporter currents in bergmann glial cells follow the time course of extrasynaptic glutamate [J]. Proc Natl Acad Sci U S A, 1997, 94 (26): 14821-14825.
[8] BRESSLOFF P C, EARNSHAW B A. A dynamic corral model of receptor trafficking at a synapse [J]. Biophys J, 2009, 96(5): 1786-1802.
[9] CHADDERTON P, MARGRIE T W, HAUSSER M. Integration of quanta in cerebellar granule cells during sensory processing [J]. Nature, 2004, 428(6985): 856-860.
[10] CHEN J, MIZUSHIGE T, NISHIMUNE H. Active zone density is conserved during synaptic growth but impaired in aged mice [J]. J Comp Neurol, 2012, 520(2): 434-452.
[11] CHEN J L, NEDIVI E. Neuronal structural remodeling: is it all about access? [J]. Curr Opin Neurobiol, 2010, 20(5): 557-562.
[12] COSTA R P, BEATRIZ E P, MIZUSAKI P,Functional consequences of pre- and postsynaptic expression of synaptic plasticity [J]. Philos Trans R Soc Lond B Biol Sci, 2017, 372(1715): 1-10.
[13] CZIKK M J, TOTTEN S, HAMMOND R,Microtubule-associated protein 2 and synaptophysin in the preterm and near- term ovine fetal brain and the effect of internittent umbilical cord occlusion [J]. Reprod Sci, 2015, 22(3): 367-376.
[14] DEHMELT L, HALPAIN S. The MAP2/Tau family of microtub-ule-associated proteins [J]. Genome Biol, 2005, 6(1): 204.
[15] DERKSEN M J, WARD N L, HARTLE K D,MAP2 and synaptophysin protein expression following motor learning suggests dynamic regulation and distinct alterations coinciding with synaptogenesis [J]. Neurobiol Learn Mem, 2007, 87(3): 404-415.
[16] ERIKSSON P S, PERFILIEVA E, BJORK-ERIKSSON T,. Neurogenesis in the adult human hippocampus [J]. Nat Med. 1998, 4(11): 1313-1317.
[17] HANSE E, SETH H, RIEBE I. AMPA-silent synapses in brain development and pathology [J]. Nat Rev Neurosci, 2013, 14(12): 839-850.
[18] HARMS K J, DUNAEVSKY A. Dendritic spine plasticity: looki-ng beyond development [J]. Brain Res, 2007, 1184(12): 65-71.
[19] HU S, YING Z, GOMEZ-PINILLA F,. Exercise can increase small heat shock proteins (sHSP) and pre- and post-synaptic prote-ins in the hippocampus [J]. Brain Res, 2009, 1249(7): 191-201.
[20] HUESTON C M, CRYAN J F, NOLAN Y M. Stress and adolescent hippocampal neurogenesis: diet and exercise as cognitive modula-tors [J].Transl Psychiatry, 2017, 7(4): 1-17.
[21] INOUE K, OKAMOTO M, SHIBATO J,Long-term mild, rather than intense, exercise enhances adult hippocampal neurogenesis and greatly changes the transcriptomic profile of the hippocampus [J]. PloS one, 2015, 10(6):e0128720.
[22] ISHIBASHI H. Increased synaptophysin expression through whis-ker stimulation in rat [J]. Cell Mol Neurobiol, 2002, 22(2): 191-195.
[23] KITTEL R J, HECKMANN M. Synaptic vesicle proteins and active zone plasticity [J]. Front Synaptic Neurosci, 2016, 8(4): 1-8.
[24] KWON S E, CHAPMAN E R. Synaptophysin regulates the kineti-cs of synaptic vesicle endocytosis in central neurons [J]. Neuron, 2011, 70(5): 847-854.
[25] LITTLEFIELD A M, SETTI S E, PRIESTER C,Voluntary exercise attenuates LPS-induced reductions in neurogenesis and increases microglia expression of a proneurogenic phenotype in aged mice [J]. J Neuroinflammation, 2015, 12(1): 138-150.
[26] SAMPATH D, SATHYANESAN M, NEWTON S,Cognitive dysfunction in major depression and Alzheimer’s disease is associated with hippocampal–prefrontal cortex dysconnectivity [J]. Neuropsychiatr Dis Treat, 2017, 13(6):1509-1519.
[27] SAVTCHENKO L P, RUSAKOV D A. The optimal height of the synaptic cleft [J]. Proc Natl Acad Sci U S A, 2007, 104(6): 1823-1828.
[28] SHELTON M A, NEWMAN J T, GU H,Loss of microtu-bule-associated protein 2 immunoreactivity linked to dendritic spine loss in schizophrenia [J]. Biol Psychiatry, 2015, 78(6): 374-385.
[29] SNYDER J S, CAMERON H A. Could adult hippocampal neuro-genesis be relevant for human behavior? [J]. Behav Brain Res, 2012, 227(2): 384-390.
[30] SONG J, ZHONG C, BONAGUIDI M A,Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decisi-on [J]. Nature, 2012, 489(7414): 150-154.
[31] STUART G J, HAUSSER M. Dendritic coincidence detection of EPSPs and action potentials [J]. Nat Neurosci, 2001, 4(1): 63-71.
[32] TAKEUCHI T, DUSZKIEWICZ A J, MORRIS RICHARD G M. Restoring synaptic plasticity and memory in mouse models of Alzheimer’s disease by PKR inhibition [J]. Mol Brain, 2017, 10 (12): 57.
[33] TASHIRO A, SANDLER V M, TONI N,NMDA-receptor-mediated, cell-specific integration of new neurons in adult dentate gyrus [J]. Nature, 2006, 442(7105): 929-933.
[34] VAN PRAAG H. Exercise and the brain: something to chew on [J]. Trends Neurosci, 2009, 32(5): 283-290.
[35] VOSS M W, HEO S, PRAKASH R S,. The influence of aerobic fitness on cerebral white matter integrity and cognitive function in older adults: results of a one-year exercise intervention [J]. Hum Brain Mapp, 2013, 34(11): 2972-2985.
[36] WOJTOWICZ J M, KEE N. BrdU assay for neurogenesis in rodents [J]. Nat Protoc, 2006, 1(3): 1399-1405.
[37] XU X, YE L, RUAN Q. Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia in rats [J]. Exp Biol Med, 2009, 234(3): 296-305.
[38] YAU S Y, GIL-MOHAPEL J, CHRISTIE B R,Physical exercise-induced adult neurogenesis: a good strategy to prevent cognitive decline in neurodegenerative diseases? [J]. Biomed Res Int, 2014, 2014(2):1-20.
[39] ZAGAAR M, DAO A, LEVINE A,Regular exercise preven-ts sleep deprivation associated impairment of long-term memory and synaptic plasticity in the CA1area of the hippocampus [J]. Sleep, 2013, 36(5): 751-761.
[40] ZHAO C, TENG E M, SUMMERS R G,. Distinct morpholo-gical stages of dentate granule neuron maturation in the adult mouse hippocampus [J]. J Neurosci, 2006, 26(1): 3-11.
Regulation of Moderate Intensity Swimming Exercise on Hippocampal Synaptic Plasticity
MA Chun-lian1, DING Hai-chao2, MEI Zhi-qiang2, LIU Hua3, YANG Yi3
Wuhan Sports University, Wuhan 430205 China.
Objective: To explore the timeliness and continuity characteristics about the influence of moderate intensity swimming on hippocampal synaptic plasticity. Methods: 48 male SD rats were randomly divided into control group (CG) , 3 days ( 3D ), 7 days ( 7D ), 15 days (15 D ), 5 weeks ( 5 W ) exercise groups and 1 week delayed group after 5 weeks exercise ( P5W ). Immunofluorescence, electron microscopy and Western blot technology were used to detect the cell proliferation, synaptic plasticity and synaptic structure associated protein expression respectively in the hippocampal tissue of different swimming rat groups. Results: The proliferation rate (%) of hippocampal dentate gyrus granular cell were 31.70±1.57, 40.19±2.40, 36.74±4.06, 51.70±5.93, 52.90±6.10, 51.97±1.47 of CG, 3D, 7D, 15D, 5W, P5W group respectively, the proliferation rate of 15D, 5W, P5W groups were significantly higher than that of control group (<0.05). The synapse numbers and PSD thickness of 5W, P5W groups were significantly higher than that in CG group (<0.05 or<0.001), the synaptic cleft width of 5W, P5W groups was significantly lower than that in CG group (<0.05 or<0.001), the PSD thickness of 15D group was significantly higher than that of CG group(<0.05). The expression of hippocampal structural protein MAP2 in 5W, P5W groups was significantly higher than that in CG group(<0.05 or<0.001), and the expression of SYP in 15D, 5W, P5W groups was significantly higher than that in CG group (<0.05). Conclusions: The hippocampal plasticity induced by moderate intensity swimming has time dependent characteristic and the synaptic plasticity induced by exercise has continuity after the cessation of exercise.
1000-677X(2018)03-0034-06
10.16469/j.css.201803004
G804.5
A
2018-01-26;
2018-03-06
国家自然科学基金青年项目(81700280);湖北省自然科学基金(2017CFB361);湖北省高等学校优秀中青年科技创新团队项目(T201523);湖北省人文社会科学项目(16G281)。
马春莲,女,讲师,博士,主要研究方向为运动与认知健康促进,Email:459270899@qq.com;丁海超,女,在读硕士研究生,研究方向为运动康复理论与应用,Email: 8451175 71@qq.com;梅志强,男,在读硕士研究生,研究方向为运动康复理论与应用,Email:474580908@qq.com。
