木薯块根类胡萝卜素积累与主要基因表达谱分析
2018-04-18罗秀芹肖鑫辉陈松笔
罗秀芹, 杨 龙,2, 肖鑫辉, 陈松笔
(1.中国热带农业科学院热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室 海南 儋州 571737; 2.贵州省农业科学院亚热带作物研究所 贵州 兴义 562400)
木薯(ManihotesculentaCrantz)是世界三大薯类(马铃薯、甘薯、木薯)之一, 起源于热带美洲,广泛栽培于热带和部分亚热带地区,是热带湿地低收入农户的主要粮食,全世界约有10亿人用木薯作食品,尤其是在非洲和拉丁美洲.我国于19世纪20年代引入木薯,首先在广东高州一带种植,目前已广泛种植于我国广西、广东、海南、云南、福建和江西等热带、南亚热带地区[1].木薯因其适应性强,耐旱、耐贫瘠等优势而被广泛种植.木薯块根富含淀粉,高达为20%~30%,除作为食粮外,在化工、医药、纺织等方面均有重要作用,是淀粉及其深加工工业和动物饲料的重要来源,也是世界公认的一种很有发展潜力的可再生能源作物,具有使用的广泛性和独特性[2].然而,不同木薯品种块根中也含有少量蛋白质和微量元素,如铁、锌和类胡萝卜素.类胡萝卜素具有多种生物学功能,尤其在保护人类健康方面起着重要的作用.其中类胡萝卜素是合成维生素 A 的前体,具有多种生物学功能,尤其在保护人类健康方面起着重要的作用,能够增强人体免疫力和具有防癌抗癌的功效.人体自身不能合成类胡萝卜素,必须通过外界摄入,但类胡萝卜素在许多植物中含量较低,并且很难用化学方法合成[3].木薯中类胡萝卜素含量较低,其中90%的类胡萝卜素为β-类胡萝卜素[4].
类胡萝卜素是一种烯萜类化合物,所有的类胡萝卜素均通过类异戊二烯化合物或萜类化合物途径合成.其中IPP(异戊烯焦磷酸)是该途径的前体物质,IPP在IPP异构酶作用下生成DMAPP(二甲基丙烯基二磷酸),然后再与3个IPP缩合依次生成GPP(牦牛儿焦磷酸)、FPP(法尼基二磷酸)、GGPP(牦牛儿焦磷酸).2个GGPP在PSY(八氢番茄红素合成酶)作用下形成第1个无色的类胡萝卜素—八氢番茄红素.八氢番茄红素经过连续的脱氢反应,共轭双键延长,直至形成链孢红素、番茄红素.番茄红素是类胡萝卜素进一步合成代谢的分支点:一条途径是在番茄红素β-环化酶(LycB)的作用下产生β-胡萝卜素;另一条途径是在番茄红素β-环化酶(LycB)和番茄红素e-环化酶(LycE)的共同作用下合成α-胡萝卜素[5-7].在α、β类胡萝卜素的C4(C4′)位置引入羟基酮基和(或)C3(C3′)位置引入羟基以及在β环上引入C(5,6)-环氧基后,则形成结构更为复杂的含氧衍生物—叶黄素[8-11].而在另一分支途径中β-类胡萝卜素又经过一系列反应朝着ABA合成途径方向合成ABA (图1).
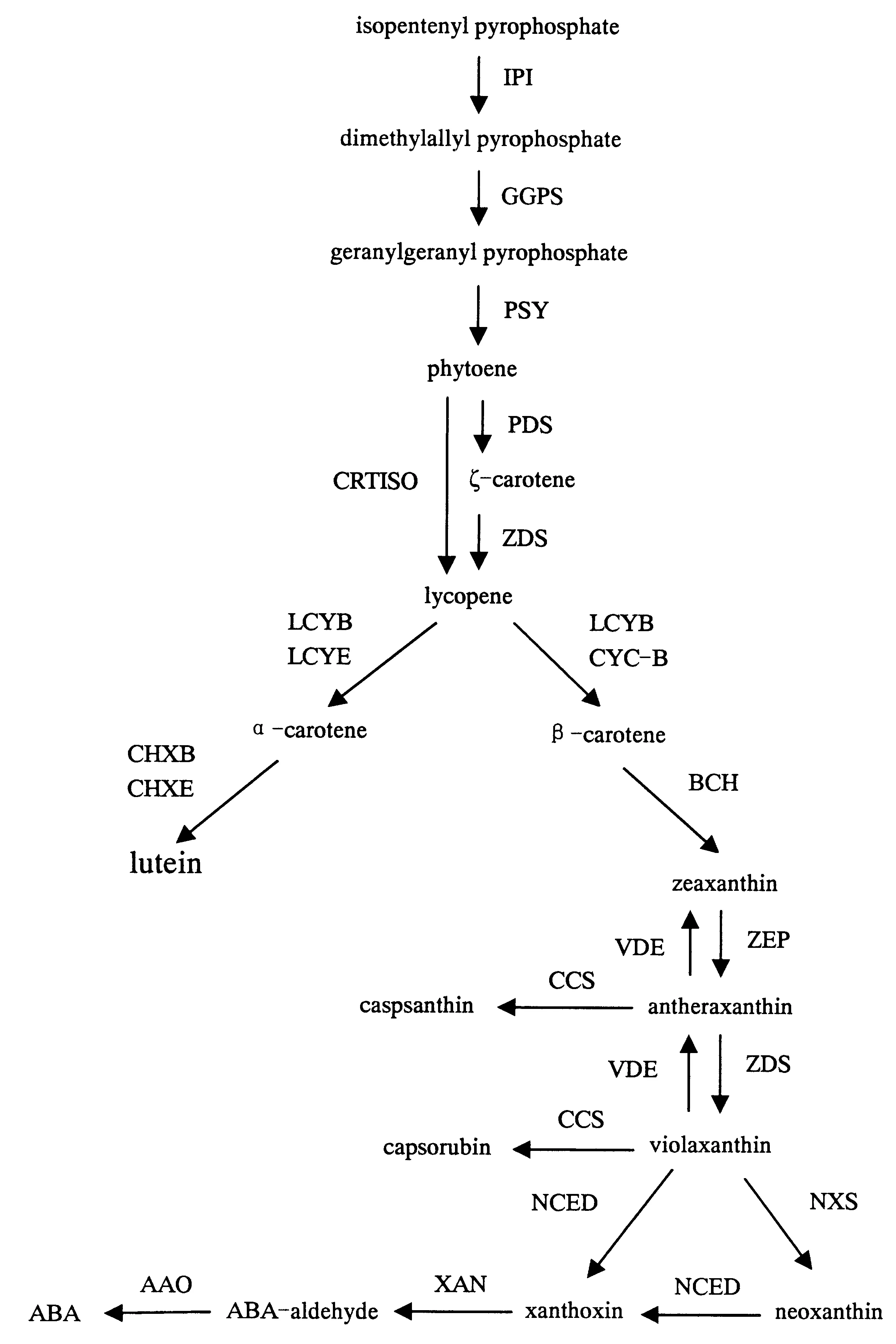
BCH:Carotene β-hydroxylase(胡萝卜素β-环羟化酶);CCS:Capsanthin-capsorubin synthase(辣椒红素—辣椒玉红素合酶);CrtB:Phytoene synthase(八氢番茄红素合酶);CrtI:Phytoene desaturase(八氢番茄红素脱氢酶);CRTISO:Carotenoid isomerase(类胡萝卜素异构酶);DMAPP:Dimethylallyl pyrophosphate(二甲基丙烯焦磷酸);ECH:Carotene ε-hydroxylase(胡萝卜素ε-环羟化酶);GGPP:Geranylgeranyl pyrophosphate(牻牛儿基牻牛儿基焦磷酸);GGPS:GGPP synthase(牻牛儿基牻牛儿基焦磷酸合酶);IPP:Isopentenylpyrophosphate(异戊二烯焦磷酸);IPPI:IPP isomerase(异戊二烯焦磷酸异构酶);LCYB:Lycopene β-cyclase(番茄红素β-环化酶);LYCE: Lycopene β-cyclase(番茄红素ε-环化酶);NCED:Nine-cisepoxy-carotenoid dioxygenase(VP14,9-顺式—环氧类胡萝卜素双氧合酶);PDS:Phytoene desaturase(八氢番茄红素脱氢酶);PSY:Phytoene synthase(八氢番茄红素合酶);VDE:Violaxanthin deepoxidase(堇菜黄质脱环氧化酶);ZDS:ζ-carotene desaturase(ζ-胡萝卜素脱氢酶);ZEP:Zeaxanthin epoxidase(玉米黄质环氧化酶).图1 类胡萝卜素代谢途径Fig.1 The pathway of carotenoids accumulation
类胡萝卜素的合成受多基因调控,其中基因工程技术的在植物中的应用研究甚多,如水稻、油菜、马铃薯、番茄等[12-15],但是在木薯中的研究较少.本研究在分析木薯块根中类胡萝卜素积累与主要基因的变化关系的基础上,拟找到调控木薯块根中类胡萝卜素积累的关键基因,为今后用基因工程的方法提高木薯块根中类胡萝卜素含量提供依据.
1 材料与方法
1.1 材料
供试材料为5个颜色不同的木薯块根SC101(白色),SC5(乳白色),BRA117315(粉红色),SC9(浅黄色)和BRA001554(黄色).5个木薯品种均在中国热带农业科学院热带作物品种资源研究所儋州国家木薯种质圃种植10个月,收获块根后,清水洗净,弃内外皮,切碎,每个品种每份约取1.0 g,各保存3份,液氮速冻后置于-80 ℃保存待用.
1.2 RNA的提取与定量PCR
研钵、研磨棒和勺子用200 ℃烘箱烘4 h,保存的样品用液氮研磨至粉碎,称取约0.1 g粉末参照植物总 RNA 提取试剂盒(天根生物技术公司)提取总RNA;反转录合成cDNA第一链参照反转录试剂盒cDNA第一链试剂盒(北京全式金生物技术有限公司).
通过GWAS测定华南9号(SC9)自然杂交后代群体F1代98份材料得到MeXAN和MeAO基因序列(数据待发表)以及结合基因组网站https://phytozome.jgi.doe.gov/pz/portal.html查找出木薯β-类胡萝卜素积累途径中的关键酶基因序列并合成相应的定量PCR引物,包括合成代谢中的MePSY、MeCRTISO、MePDS、MeZDS和MeLCYB以及分解代谢中的MeBCH、MeVDE、MeNXS、MeXAN和MeAO,内参基因为ACTIN(表1).利用合成的cDNA第一链稀释5倍为模板,用SYBR® Premix Ex TaqTMⅡ(TAKARA公司)进行PCR扩增.PCR反应体系为10 μL:cDNA1.0 μL,上下游引物各0.5 μL SYBR Premix Ex TaqTMⅡ 5.0 μL,milliQ 3.0 μL.PCR反应条件:95 ℃预变性7 min;95 ℃ 5 s,60 ℃ 30 s,40个循环;60 ℃ 30 s,60~95 ℃,20 ℃ 10 s.结果采用2-ΔΔCt计算基因的相对表达量.

表1 木薯类胡萝卜素积累相关基因的定量PCR引物Table 1 The genes′ primer of carotenoids accumulation pathway in cassava for RT-PCR
1.3 β-类胡萝卜素的提取与测定
提取方法参照王琴飞等[16],选用种植10个月的SC101,SC5,BRA117315,SC9和BRA001554木薯块根,用液氮研磨,称取约0.3 g木薯块根粉末于2 mL离心管中,加入400 μL预冷的超纯水,100 μL饱和NaCl溶液和50 μL正己烷,涡混30 s,12 000 r·min-1,4 ℃离心2 min;加入200 μL二氯甲烷,涡混30 s,12 000 r·min-1,4 ℃离心2 min;加入800 μL乙酸乙酯,涡混30 s,12 000 r·min-1,4 ℃离心2 min,取上清过滤待测.β-类胡萝卜素标品的配置:用二氯甲烷/正己烷(8/2)配置成单标母液,再用乙酸乙酯稀释4倍,使用时用乙酸乙酯/二氯甲烷/正己烷(6/4/1)混合液配成不同浓度的混合标准溶液.HPLC的测定条件:波长450 nm,柱温30 ℃,流动相甲醇/叔丁基甲醚(70/30),流速1 mL·min-1,进样量20 μL,运行时间18 min.
1.4 数据分析
β-类胡萝卜素含量与基因表达量之间相关性分析采用SPSS软件中的Pearson方法分析[17].
2 结果与分析
2.1 基因表达谱分析
定量PCR以SC101为对照,结果显示了MePSY、MeCRTISO、MePDS、MeZDS、MeLCYB、MeBCH、MeVDE、MeNXS、MeXAN和MeAO的相对表达情况(图2),其中合成代谢中的MePSY、MePDS和MeLCYB以及分解代谢中的MeBCH、MeVDE和MeNXS随着类胡萝卜素含量的增加,其基因相对表达水平基本呈上升趋势.
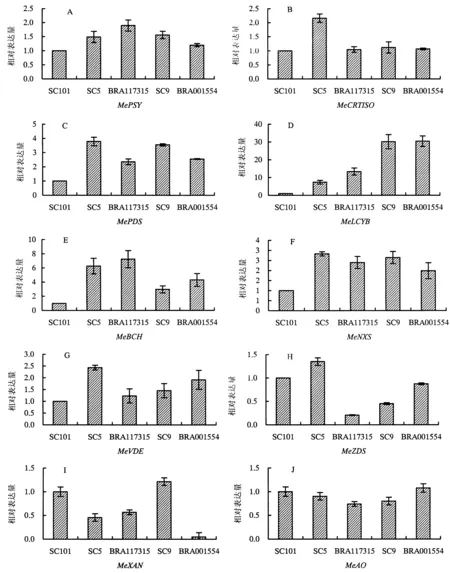
图2 5个不同木薯品种块根中类胡萝卜素积累途径相关基因表达Fig.2 The expression profile of ten genes in carotenoid accumulation pathway in five different cassava storage roots
2.2 β-类胡萝卜素含量分析

图3 5个不同木薯品种块根中β-类胡萝卜素含量Fig.3 The content of carotenoid in five different cassava storage roots
5个木薯品种SC101、SC5、BRA117315、SC9和BRA001554块根类胡萝卜素的测定结果如图3,对应块根颜色如图4.结果表明,随着块根颜色加深其β-类胡萝卜素含量呈上升趋势.其中SC101纯白色木薯块根的β-类胡萝卜素含量最低,SC9和BRA001554深黄木薯块根的β-类胡萝卜素含量都比较高,达到3.0 μg·g-1.
2.3 块根类胡萝卜素含量与基因表达量相关性分析
从表2可以看出,MePSY、MePDS、MeLCYB、MeVDE、MeNXS和MeAO与木薯块根类胡萝卜素含量呈正相关,其中MeLCYB与含量相关性最强,差异极显著.而MeCRITISO、MeZDS、MeCHXB和MeXAN与类胡萝卜素含量呈负相关.

A :SC101;B:SC5;C:BRA117315;D:SC9;E:BRA001554.图4 5个不同木薯品种块根横切面图Fig.4 The cross section of five cassava storage roots
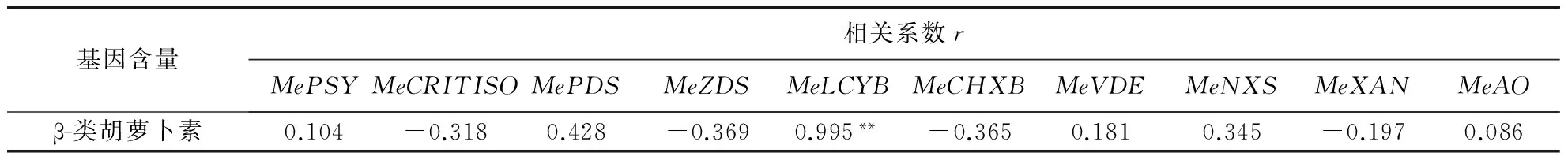
基因含量相关系数rMePSYMeCRITISOMePDSMeZDSMeLCYBMeCHXBMeVDEMeNXSMeXANMeAOβ-类胡萝卜素0.104-0.3180.428-0.3690.995**-0.3650.1810.345-0.1970.086
1)**在0.01水平(双侧)上显著相关.
3 讨论
木薯块根颜色丰富,不同颜色木薯块根之间类胡萝卜素含量不同.本研究结果显示白色木薯块根只含有微量类胡萝卜素;粉红色木薯块根含有少量类胡萝卜素;黄色或深黄色木薯块根含较高的类胡萝卜素.Grassmann et al[18]研究表明,不同根色与其类胡萝卜素组分和含量有着密切的关系,如白色类型只含有微量类胡萝卜素,黄色类型含有叶黄素和玉米黄质等,红色类型主要含有番茄红素和β-胡萝卜素等.本研究结果与胡萝卜和其他作物研究一致[19].通过HPLC和定量PCR结果表明,木薯块根类胡萝卜素含量是通过不同的基因表达调控的,其中类胡萝卜素合成代谢中的MePSY、MePDS和MeLCYB在白色木薯块根中表达量较低,在非白色木薯块根中表达量较高,这3个基因都与类胡萝卜素含量成正相关.而MeLCYB的表达随着块根颜色的加深呈递增的趋势,其中MeLCYB基因表达与相关系数达到0.995,差异达到极显著水平,说明MeLCYB在木薯块根中在类胡萝卜素积累中起着重要的作用.类胡萝卜素分解代谢合成中的MeBCH、MeVDE和MeNXS表达趋势与类胡萝卜素含量成负相关.王慧等人从基因表达水平跟类胡萝卜素含量相关性分析发现胡萝卜根中LCYE基因的表达量与胡萝卜根中类胡萝卜素含量之间达到显著正相关,叶中LCYE表达量与叶黄素、总类胡萝卜素含量之间呈负相关,说明LCYE对根中主要类胡萝卜素的积累起着关键性作用,但作用方式可能存在不同[20].本研究中类胡萝卜素合成与分解代谢基因表达与其含量之间呈非直接正相关与负相关关系,基因调控错综复杂,需要进一步验证其在转录水平,蛋白质水平和代谢水平的调控.
[1] 姬卿,傅国华,闵义.我国木薯种植的发展及未来总产预测与市场需求趋势[J].贵州农业科学,2015,43(3):62-66.
[2] 叶剑秋.我国木薯选育种进展[J].热带农业科学,2009,29(11):115-119.
[3] MORAN N A, JARVIK T. Lateral transfer of genes from fungi underlies carotenoid production in aphids[J]. Science, 2010,328:624-627.
[4] CARVALHO L M, OLIVEIRA A R, GODOY R L, et al. Retention of total carotenoid and β-carotene in yellow sweet cassava (ManihotesculentaCrantz) after domestic cooking[J]. Food Nutr Res, 2012,56:15 788.
[5] CUNNINGHAM F X, GANTT E. Genes and enzymes of carotenoid biosynthetic pathway in plants[J]. Annu Rev Plant Physiol Mol Biol, 1998,49:557-583.
[6] CUNNINGHAM F X, GANTT E. One ring or two? Determination of ring number in carotenoid by lycopene-cyclases[J]. PNAS, 2001,98:2 905-2 910.
[7] ISAACSON T, RONEN G, ZAMIR D, et al. Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of β-carotene and xanthophylls in plants[J]. Plant Cell, 2002,14:333-342.
[8] SANDMANN G. Genetic manipulation of carotenoid biosynthesis: strategies, problems and achievements[J]. Trends Plant Sci, 2001,6(1):14-17.
[9] BRITTON G, LIAAEN-JENSEN S, PFANDER H. Overview of carotenoid biosynthesis. In carotenoids: Biosynthesis and Metabolism. Basel: Brikhauer[M]. 1998,3:13-147.
[10] GRUNEWALD K, HAGEN C. β-carotene is the intermediate export form the chloroplast during accumulation of secondary carotenoids inHaematococcuspluvialis[J]. J Applied Phycol, 2001,13:89-93.
[11] HIRSCHBERG J. Carotenoid biosynthesis in flowering plants[J]. Current Opinion in Plant Biology, 2001,4(3):210-218.
[12] BURKHARDT P K, BEYER P, WUNN J, et al. Transgenic rice (Oryzasativa) endosperm expressing daffodil (Narcissuspseudonarcissus) phytoene synthase accumulates phytoene, a key intermediate of provitamin A biosynthesis[J]. Plant J, 1997,11(5):1 071-1 078.
[13] SHEWMAKER C K, SHEEHY J A, DALEY M, et al. Seed-specific overexpression of phytoene synthase: increase in carotenoids and other metabolic effects[J]. Plant J, 1999,20(4):401-412.
[14] DUCREUX L J, MORRIS W L, HEDLEY P E, et al. Metabolic engineering of high carotenoid potato tubers containing enhanced levels of beta-carotene and lutein[J]. Journal of Experimental Botany, 2005,56,409:81-89.
[15] DHARMAPURI S, ROSATI C, PALLARA P, et al. Metabolic engineering of xanthophyll content in tomato fruits[J]. Febs Letters, 2002,519(13):30-34.
[16] 王琴飞,张如莲,徐丽,等.HPLC测定西番莲中叶黄素和β-胡萝卜素[J].热带作物学报,2016,37(3):609-614.
[17] LI F, VALLABHANENI R, YU J, et al. The maize phytoene synthase gene family: Overlapping roles for carotenogenesis in endosperm, photomorphogenesis, and the thermal stress tolerance[J]. Plant Physiology, 2008,147:1 334-1 346.
[18] GRASSMANN J, SCHNITZLER W H, HABEGGER R. Evaluation of different coloured carrot cultivars on antioxidative capacity based on their carotenoid and phenolic contents[J]. International Journal of Food Science and Nutrition, 2007,58:603-611.
[19] BRITTON G. Carotenoids in chloroplasts pigment-protein complexes[C]∥SUNDQVIST C, RYBERG M. Pigment-protein complexes in plastids: Synthesis and assembly. San Diego: Academic Press, 1993,447-483.
[20] 王慧,欧承刚,庄飞云,等.胡萝卜中类胡萝卜素积累与主要合成基因转录水平相关性分析[J].园艺学报,2014 ,41(12):2 513-2 520.
