洪泽湖湿地重金属含量与N2O释放特征及关系
2018-04-18王圣燕徐勇峰韩建刚李萍萍
王圣燕, 陈 圆, 徐勇峰, 韩建刚, 李萍萍
(1.南京林业大学生物与环境学院,江苏 南京 210037;2.江苏洪泽湖湿地生态系统国家定位观测研究站,江苏 南京 210037;3.南京林业大学江苏省南方现代林业协同创新中心,江苏 南京 210037)
N2O是最主要的温室气体之一,土壤是其最重要的来源,土壤的重金属含量对N2O释放产生重要影响[1-3].Liu et al[4]发现土壤重金属污染可能减少N2O的释放量.Chen et al[5]认为废水中低浓度的Zn(≤10 μg·L-1)促进土壤N2O排放,高浓度的Zn(40~80 μg·L-1)抑制N2O排放,增加Cu的浓度可能使N2O的释放速率下降[6].通过对土壤添加锌盐的反硝化试验发现,土壤Zn浓度增加抑制N2O的释放,导致土壤N2O排放通量增加[7].由此可见,土壤的重金属种类、含量对N2O释放产生显著影响,但目前相关研究的结论并不一致.
湿地是全球最重要的生态系统之一,其环境功能的评估是目前的研究热点.Ma et al[8]综合分析了中国6个浅层淡水湖泊(太湖、巢湖、南四湖、洞庭湖、鄱阳湖和洪泽湖)表层沉积物中重金属(Cu、Zn、Pb、Cd、Hg、Cr、As和 Ni)的生态风险,认为洞庭湖表层沉积物重金属污染的生态风险最高,其次是太湖,巢湖、南四湖、鄱阳湖和洪泽湖的生态风险较低.长江流域溶解的N2O(除金沙江和黑水河不饱和外)是大气N2O的源,每年长江流域的N2O释放量约为4.6 Gg[9];巢湖流域丰乐河与杭埠河沉积物—水界面的N2O平均释放通量分别为(0.39±0.44)、(0.15±0.16) μg·m-2·h-1,贡献水体中约89%和45%的溶存N2O,为大气N2O的潜在释放源[10].然而,目前有关湿地重金属含量与N2O释放之间关系的研究还很不充分.
作为我国第四大淡水湖泊,洪泽湖发挥着极其重要的水利、生态作用.然而,长期以来其生态环境也受到人为活动的强烈影响.特别是淮河入湖形成的河湖交汇区区域,泥沙易淤积,植被更迭、发育快,土地利用强度高,周边围垦养殖有禁无止,重金属污染增势高[11].一方面,Han et al[12]发现Cd、Hg对洪泽湖湿地典型的新兴植物芦苇和荻草的种子萌发和幼苗生长产生毒性作用,表层沉积物的Cd平均含量达3.2 mg·kg-1,为中度污染(全球最高背景值为0.5 mg·kg-1[13]),生态风险较高[14].李玉斌等[15]认为洪泽湖As、Cr处于无污染状态,Hg、Pb、Cu、Zn为轻度污染,Cd污染严重.蒋豫等[16]认为Cd、As、Pb存在污染,其余重金属均为清洁状态.另一方面, Lu et al[17]研究表明升温显著提高N2O的排放速率和累积排放量,而淹水可能抑制土壤N2O的排放,并且对富含有机质的土壤的抑制作用更为明显.以往围绕湿地重金属含量和N2O释放的研究较多,而探讨重金属含量与沉积物N2O释放关系的研究尚未见报道.
因此,本研究以洪泽湖河湖交汇区5种不同土地利用/覆被(芦苇地,杨树林,柳树林,水稻田,养殖塘)下土壤为对象,通过测定8种常见重金属(As、Cd、Cr、Cu、Hg、Mn、Pb、Zn)的含量与N2O的潜在释放速率,分析二者的关系并探究土地利用改变对二者关系的影响 ,以期为湿地保护与合理利用提供科学依据.
1 材料与方法
1.1 区域概况
洪泽湖(N33°06′—33°40′,E118°10′—118°52′)地处北亚热带与南暖温带的过渡地带.水域面积1 576.9 km2,最大水深4.4 m,平均水深1.7 m,蓄水量2.79 Gm3[18].该区气候为季风气候,年平均气温为14.8 ℃,年平均水温为15.6 ℃;年降水量为926.7 mm,地表径流年际变化剧烈,年内分布极不均匀,6月梅雨季节常有洪涝灾害发生[11].湿地动植物资源丰富,有水生高等植物36科61属81种,其中芦苇属和香蒲属的物种较多[19].洪泽湖吞吐淮河,入湖河口周边形成一系列面积不等的滩涂.根据泥沙淤积特征可以分成湖面滩、边滩和速成滩3种,分别占河口湿地总面积的50%、40%和10%[20].近年来,人为活动对滩涂利用的强度与面积与日俱增.洪泽湖水系情况及5个采样点之间位置关系如图1.
1.2 沉积物样品采集与前处理
2016年8月在采样区内选择芦苇(Phragmitesaustralis)自然覆被区域,杨树(PopulusalbaL.)和柳树(Salixbabylonica)人工林、水稻田(基肥施用复合肥45 t·km-2,第一次追肥施用尿素30 t·km-2)、养殖塘(水深1.5~2.0 m,人工养殖鱼和蟹),按“S”形多点法采集0~20 cm沉积物样品,每个点采土样5~10 kg,经四分法处理后装入自封袋,运回实验室.在通风、阴凉处自然风干后,用干净的木锤打碎,去除杂质,一半过2 mm筛,另一半用玛瑙研钵研磨,过100目筛,保存在干净的自封袋中备用.沉积物的基础理化性质如表1所示.
1.3 沉积物中8种重金属含量测定
称0.5 g风干土样(过100目筛)经HCl-HNO3-HF-HClO4湿法消解后,采用电感耦合等离子体质谱仪测Cu、Zn、Pb、Cd、Cr含量;采用北京吉天AFS-9130双道原子荧光分光光度计测As和Hg含量.
1.4 沉积物N2O潜在释放速率测定
1.4.1气体培养气体培养参照崔洪磊等方法[21],称30 g风干土样过2 mm筛,置于100 mL塑料培养管中;加9 mL蒸馏水,用透气膜封口,30 ℃恒温预培养,培养期为3 d.预培养结束后,向培养管中加4.5 mL蒸馏水,控制土样含水量约为45%,30 ℃恒温培养,培养期为12 h.
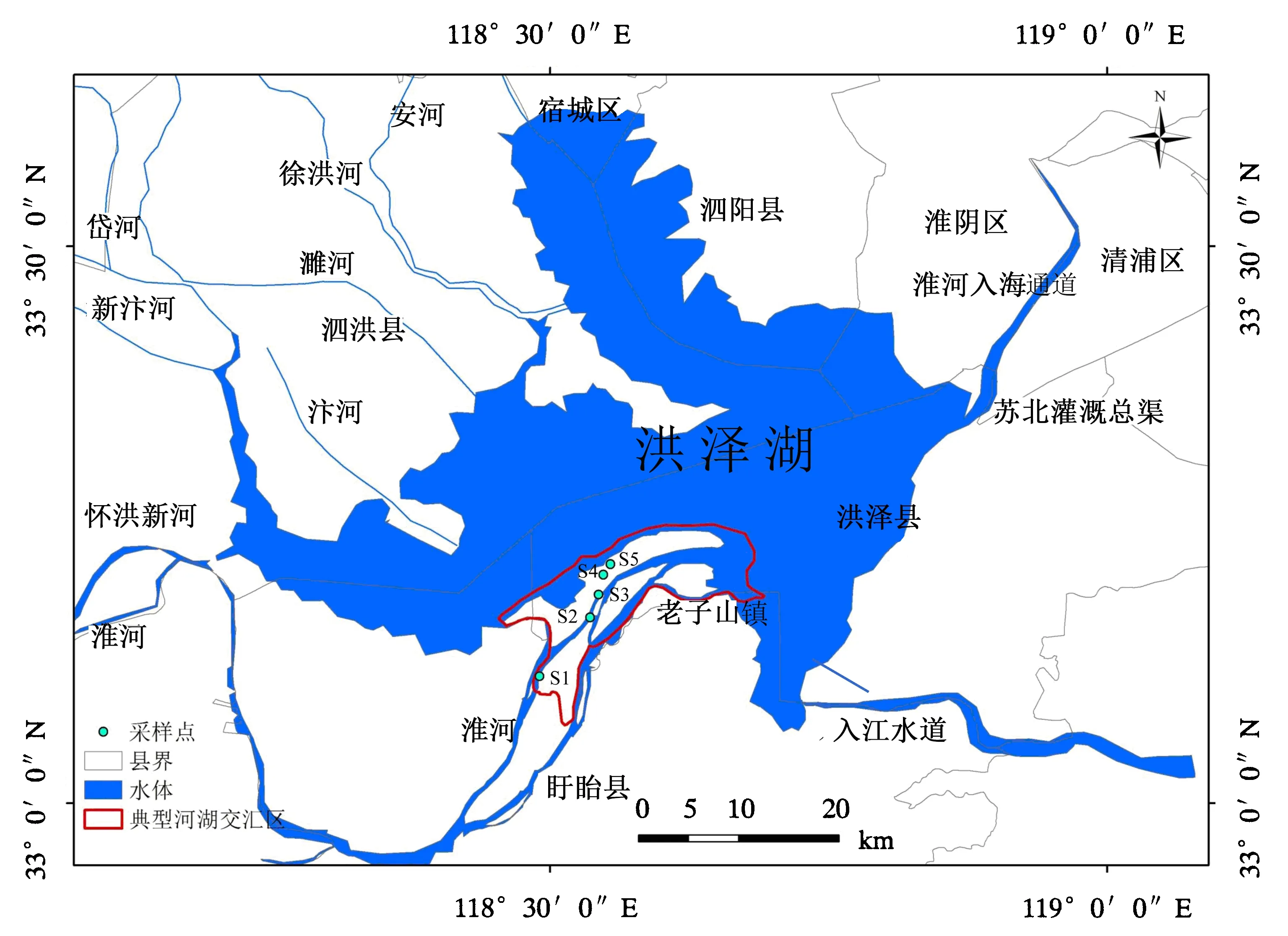
S1:养殖塘;S2:水稻田;S3:芦苇地;S4:杨树林;S5:柳树林.图1 洪泽湖水系情况及5个采样点的位置关系Fig.1 Water system of Hung-tse Lake and the distribution of 5 sampling points
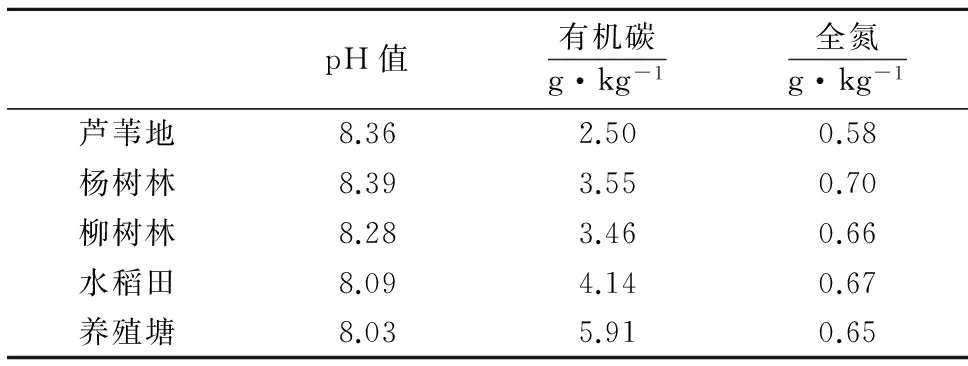
pH值有机碳g·kg-1全氮g·kg-1芦苇地8.362.500.58杨树林8.393.550.70柳树林8.283.460.66水稻田8.094.140.67养殖塘8.035.910.65
1.4.2气体采集采集气体前,去除透气封口膜,用橡胶塞塞住塑料管,密闭30 min后用注射器抽取管内顶空气体20 mL.用安捷伦科技有限公司生产的7890A型气相色谱仪测定气体的通量.将收集的20 mL气体匀速缓慢推入样品进入口.标准气由中国计量科学研究院提供的595669#N2O(平衡气为N2,其中N2O浓度为326×10-9,CO2浓度为712×10-6).
1.5 沉积物中N2O潜在释放速率的计算
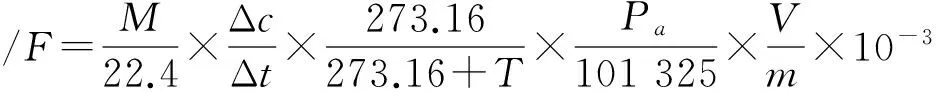
式中:F为培养管中气体的潜在释放速率(mg·kg-1·h-1);M为气体摩尔质量,N2O的M为44 g·mol-1;22.4为气体常数(L·mol-1);Δc为气体体积分数差,10-6;Δt为时间间隔(h);T为培养温度(℃);273.16为标准状况下温度(K);Pa为实验室大气压,101 600 Pa;101 325为标准大气压(Pa);V为培养管顶空体积(L);m为土柱中沉淀物质量(kg);10-3为单位换算系数[21].
1.6 统计分析方法
采用单因素方差分析比较5种土地利用/覆被下N2O潜在释放速率和8种重金属含量的差异(SPSS 20.0软件),处理间差异显著性采用字母法进行标记,相同小写字母表示无显著差异(P<0.05).
2 结果与分析
2.1 5种土地利用/覆被下8种重金属含量差异
由图2可得,柳树林土壤的As含量[(46.5±2.7) mg·kg-1]显著高于芦苇地、杨树林,与水稻田、养殖塘差异不显著.柳树林、水稻田的Cd含量较高,分别为(0.3±0.1)和(0.3±0.0) mg·kg-1,与芦苇地、杨树林、养殖塘的Cd含量有显著差异.水稻田的Cr含量最高[(72.4±6.1) mg·kg-1],其他4种土地利用/覆被方式下土壤的Cr含量无显著差异.水稻田的Cu含量[(37.7±1.4) mg·kg-1]和Pb含量[(24.8±0.5) mg·kg-1]最高,显著高于其他4种土地利用/覆被方式.芦苇地的Hg含量最高[(0.01±0.00) mg·kg-1],与其他4种土地利用/覆被方式下土壤的Hg含量有显著差异.5种土地利用/覆被方式下土壤的Mn含量差异不显著.水稻田的Zn含量最高[(115.3±6.2) mg·kg-1],与其他4种土地利用/覆被方式下土壤的Zn含量有显著差异.
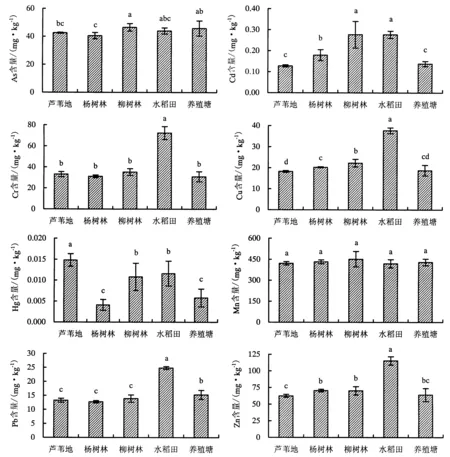
图2 5种土地利用/覆被下沉积物中8种重金属含量的差异性Fig.2 Comparison on heavy metal contents in soils/sediments under 5 land use/cover types
2.2 5种土地利用/覆被下N2O潜在释放速率的特征
由图3可得,除养殖塘外4种土地利用/覆被均促进N2O的释放,即为大气中N2O源.水稻田土壤的N2O潜在释放速率最大[(5.83±1.82) mg·kg-1·h-1],显著高于其他4种土地利用/覆被,是它们的50~70倍;芦苇地、杨树林、柳树林和养殖塘这4种土地利用/覆被之间无显著差异,养殖塘呈现吸收N2O状态[(-0.13±0.03) mg·kg-1·h-1],为大气中N2O的汇.
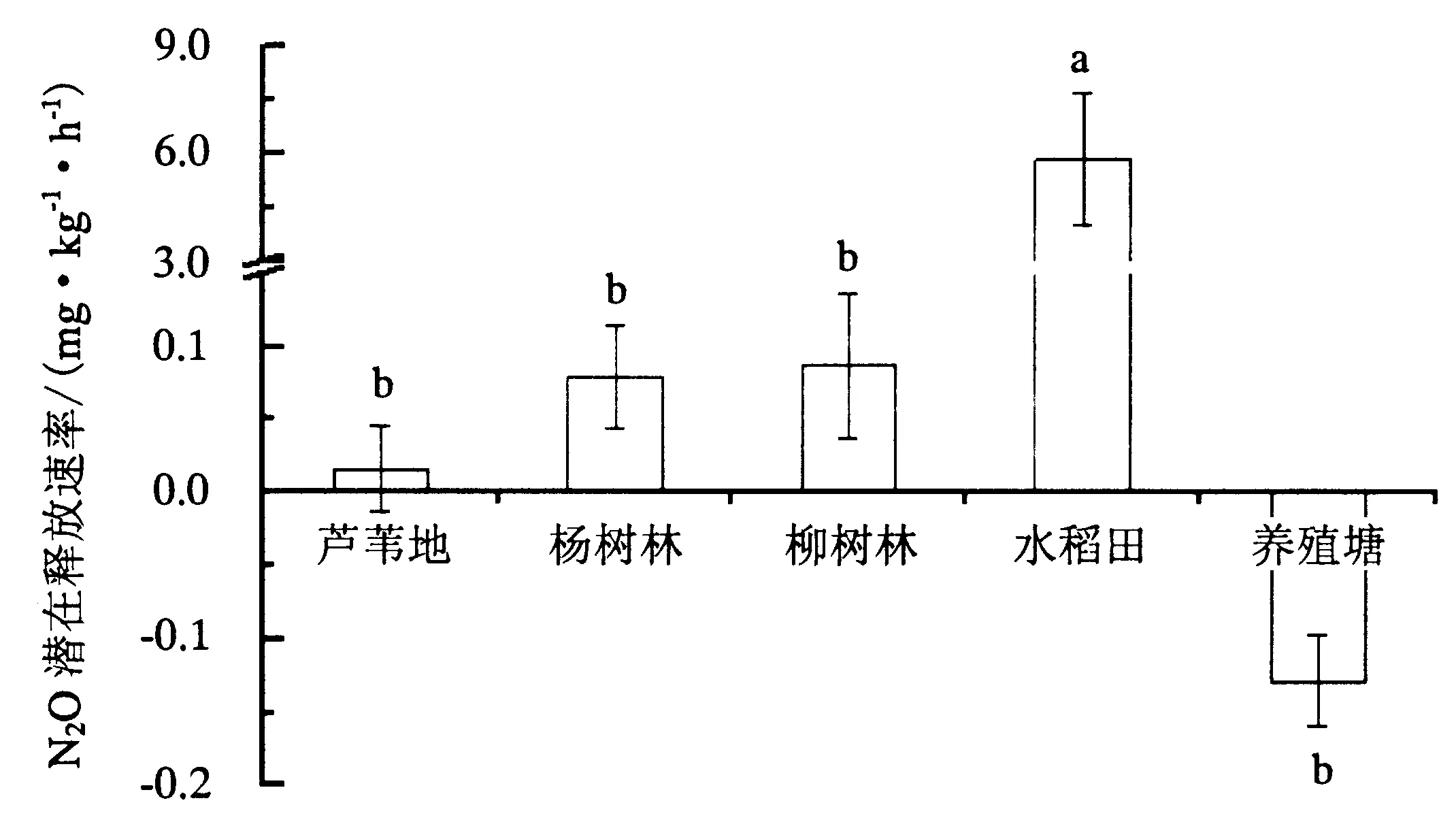
图3 5种土地利用/覆被下沉积物N2O潜在释放速率的差异性Fig.3 N2O emission rate in soils/sediments under 5 land use/cover types
2.3 5种土地利用/覆被类型下8种重金属与N2O潜在释放速率的关系
芦苇地土壤的Cd、Cu含量与N2O潜在释放速率极显著正相关(P<0.01),As、Mn、Zn与N2O潜在释放速率显著正相关(P<0.05)(表2).水稻田土壤的Mn与N2O潜在释放速率显著负相关(P<0.05).
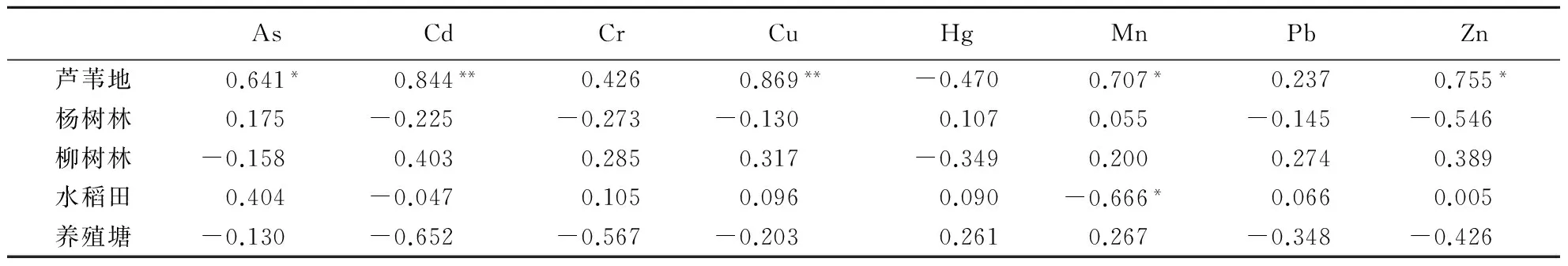
表2 土壤中8种重金属含量与N2O潜在释放速率的相关性1)Table 2 Correlation between heavy metal contents and N2O emission rates in soils/sediments
1)*:P<0.05;**:P<0.01;重金属含量和N2O潜在释放速率为6次测量取平均值.
3 讨论与结论
3.1 5种土地利用/覆被下8种重金属含量的差异
测定的水稻田的Cd、Cr、Cu、Pb、Zn含量明显高于其他4种土地利用/覆被,柳树林的As、Cd、Mn含量较高,芦苇地的Hg含量较高,但除了As其他七种重金属均未超过土壤环境质量重金属评价三级标准[22],这与前人的研究结果存在一定差异.90年代后期,洪泽湖发生过多起水污染事故,尤其是2000—2004每年都发生较大甚至特大污染事故,污染物浓度高,范围大[23],引起沉积物中重金属含量波动,其中Hg和Cd的上升幅度较大,平均含量为分别为0.21和2.36 mg·kg-1,超过土壤环境质量重金属评价三级标准[24].洪泽湖Zn、Cd和Mn均为自然来源,相对稳定;As和Cr受人类活动影响较大,其中As主要来源于金属冶炼、煤炭燃烧、含As肥料和农药以及农业生产使用污水灌溉[25],Cr元素主要来源于农药、灌水及养殖业;Pb、Cu和Hg既来源于流域母质,又受到人类活动影响[26].可见,一方面由于不同覆被类型的生物量差异导致土壤对重金属的吸收不同,另一方面,随着洪泽湖土地利用/覆被方式从芦苇地向杨树林、柳树林、水稻田和养殖塘转变,化肥和农药的投入量增大,也使土壤的重金属含量产生差异.
3.2 5种土地利用/覆被下N2O潜在释放速率的差异

3.3 5种土地利用/覆被方式下8种重金属与N2O潜在释放速率的关系
赵迪[1]认为在一定范围内N2O的释放速率随着Cu(0~50 mg·kg-1)、Pb(0~300 mg·kg-1)、Zn(0~20 mg·kg-1)、Cd(0~1 mg·kg-1)质量浓度的增加而增加.以往研究表明,自然覆被下重金属主要通过直接影响反硝化细菌的生命活动来影响反硝化作用,抑制好氧反硝化菌活性的顺次为Cd>Cu>Ni>Zn[1,39].微量金属元素(Cd、Cu、Cr、Zn)的增加对反硝化过程表现出明显的抑制作用,促进N2O在沉积物中的积累[40].本试验5种地类土壤的Zn含量都超过20 mg·kg-1却仍促进N2O的释放,可能是由于湿地土壤中较高的有机质降低了重金属的有效性[41],使得反硝化细菌保持较高的活性[1],促进了湿地土壤N2O的释放.因此,结合土壤中Cd、Cu、As、Mn、Zn的含量特征,可以认为,低浓度的Cd、Cu、Mn、Zn与高浓度的As可能刺激芦苇地N2O的释放,而人为对湿地土地利用的改变使土壤重金属含量与N2O释放之间关系的不确定性增加.
[1] 赵迪.重金属胁迫对潮滩沉积物反硝化作用影响机制的初步研究[D].上海:华东师范大学,2013.
[2] 张玉,胡春胜,张佳宝,等.农田土壤主要温室气体(CO2, CH4, N2O)的源/汇强度及其温室效应研究进展[J].中国生态农业学报,2011,19(4):966-975.
[3] ALMEIDA C M R, MUCHA A P, DA SILVA M N, et al. Salt marsh plants as key mediators on the level of cadmium impact on microbial denitrification[J]. Environmental Science and Pollution Research, 2014,21(17):10 270-10 278.
[4] LIU Y, LIU Y Z, ZHOU H M, et al. Abundance, composition and activity of denitrifier communities in metal polluted paddy soils[J]. Scientific Reports, 2016,6:19 086.
[5] CHEN G C, TAM N F, YE Y. Does zinc in livestock wastewater reduce nitrous oxide (N2O) emissions from mangrove soils?[J]. Water Research, 2014,65:402-413.
[6] WU G, ZHAI X, JIANG C, et al. Denitrifying kinetics and nitrous oxide emission under different copper concentrations[J]. Water Science and Technology, 2014,69(4):746-754.
[7] DE BROUWERE K, HERTIGERS S, SMOLDERS E. Zinc toxicity on N2O reduction declines with time in laboratory spiked soils and is undetectable in field contaminated soils[J]. Soil Biology and Biochemistry, 2007,39(12):3 167-3 176.
[8] MA Z W, CHEN K, YUAN Z W, et al. Ecological risk assessment of heavy metals in surface sediments of six major Chinese freshwater lakes[J]. Journal of Environmental Quality, 2013,42(2):341-350.
[9] 赵玉川.长江流域及长江口溶解甲烷和氧化亚氮的分布与释放通量[D].青岛:中国海洋大学,2011.
[10] 杨丽标,王芳,晏维金.巢湖流域河流沉积物N2O释放对水体溶存N2O贡献研究[J].农业环境科学学报,2013,32(4):771-777.
[11] 楚恩国.洪泽湖流域水文特征分析[J].水科学与工程技术,2008(3):22-25.
[12] HAN P, WU G, WU Y Q, et al. Effect of heavy metal stress on emerging plants community constructions in wetland[J]. Water Science and Technology, 2010,62(10):2 459-2 466.
[13] 周德山,张晴,宋向明,等.洪泽湖表层沉积物中重金属的分布特征及潜在生态危害[J].淮海工学院学报,2012,21(2):39-43.
[14] 余辉,张文斌,余建平.洪泽湖表层沉积物重金属分布特征及其风险评价[J].环境科学,2011,32(2):437-444.
[15] 李玉斌,冯流,刘征涛,等.中国主要淡水湖泊沉积物中重金属生态风险研究[J].环境科学与技术,2012,35(2):200-205.
[16] 蒋豫,刘新,高俊峰,等.江苏省浅水湖泊表层沉积物中重金属污染特征及其风险评价[J].长江流域资源与环境,2015,24(7):1 157-1 162.
[17] LU Y, XU H W. Effects of soil temperature, flooding, and organic matter addition on N2O emissions from a soil of Hongze Lake wetland, China[J]. The Scientific World Journal, 2014:272684.
[18] 王苏民,窦鸿身.中国湖泊志[M].北京:科学出版社,1998:261-297.
[19] 叶正伟,朱国传,张云.洪泽湖湿地多样性特征分析[J].淮阴师范学院学报(自然科学版),2004,3(4):334-339.
[20]付为国,吴翼,李萍萍,等.洪泽湖入湖河口滩涂植被分异特征[J].湿地科学,2015,13(5):569-576.
[21] 崔洪磊,徐莎,印杰,等.植被收割对滨海湿地沉积物中CO2和N2O释放的影响[J].环境科学研究,2015,28(8):1 200-1 208.
[22] 夏家淇.土壤环境质量标准详解[M].北京:中国环境科学出版社,1996.
[23] 尹景伟,刘春山.洪泽湖1991—2005年发生的水污染情况分析及对策探讨[J].江苏水利,2009(8):30-31.
[24] 何华春,许叶华,杨競红,等.洪泽湖流域沉积物重金属元素的环境记录分析[J].第四纪研究,2007,27(5):766-774.
[25] 张宪军,蓝先洪,赵广涛,等.苏北浅滩表层沉积物中重金属元素Cd, As, Hg, Se分布及污染评价[J].海洋地质动态,2007,23(2):9-13.
[26] 张文斌,余辉.洪泽湖沉积物中营养盐和重金属的垂向分布特征研究[J].环境科学,2012,33(2):399-406.
[27] 刘赢男,焉志远,付晓玲,等.湿地生态系统土地利用/覆被变化(LUCC)环境效应研究进展[J].黑龙江科学,2013,4(7):18-22.
[28] SUN H Y, ZHANG C B, SONG C C, et al. The effects of plant diversity on nitrous oxide emissions in hydroponic microcosms[J]. Atmospheric Environment, 2013,77:544-547.
[29] HERGOUALC′H K, VERCHOT L V. Greenhouse gas emission factors for land use and land-use change in Southeast Asian peatlands[J]. Mitigation and Adaptation Strategies for Global Change, 2014,19(6):789-807.
[30] 刘惠,赵平.土地利用/覆被变化对土壤温室气体排放通量影响[J].山地学报,2009,27(5):600-604.
[31] 徐勇峰,陈子鹏,吴翼,等.环洪泽湖区域农业面源污染特征及控制对策[J].南京林业大学学报(自然科学版),2016,40(2):1-8.
[32] 杨继松,于君宝,刘景双,等.三江平原湿地岛状林CH4和N2O排放通量的特征[J].生态环境,2004,13(4):476-479.
[33] 刘慧峰,伍星,李雅,等.土地利用变化对土壤温室气体排放通量影响研究进展[J].生态学杂志,2014,33(7):1 960-1 968.
[34] HADI A, INUBUSHI K, PURNOMO E, et al. Effect of land-use changes on nitrous oxide (N2O) emission from tropical peatlands[J]. Chemosphere-Global Change Science, 2000,2(3):347-358.
[35] JIANG C S, WANG Y S, HAO Q J, et al. Effect of land-use change on CH4and N2O emissions from freshwater marsh in Northeast China[J]. Atmospheric Environment, 2009,43(21):3 305-3 309.
[36] VON AMOLD K, WESLIEN P, NILSSON M, et al. Fluxes of CO2, CH4and N2O from drained coniferous forests on organic soils[J]. Forest Ecology and Management, 2005,210(1-3):239-254.
[37] SMITH K A, BALL T, CONEN F, et al. Exchange of greenhouse gases between soil and atmosphere: interactions of soil physical factors and biological processes[J]. European Journal of Soil Science, 2003,54(4):779-791.
[38] MELILLO J M, STEUDLER P A, FEIGL B J, et al. Nitrous oxide emissions from forests and pastures of various ages in the Brazilian Amazon[J]. Journal of Geophysical Research: Atmospheres, 2001,106(D24):34 179-34 188.
[39] GUI M Y, CHEN Q, MA T, et al. Effects of heavy metals on aerobic denitrification by strainPseudomonasstutzeriPCN-1[J]. Applied Microbiology and Biotechnology, 2017,101(4):1 717-1 727.
[41] KIRKHAM M B. Cadmium in plants on polluted soils: effects of soil factors, hyperaccumulation, and amendments[J]. Geoderma, 2006,137(1):19-32.
