干旱胁迫下美国薄荷幼苗形态与生理特性研究
2018-04-18孙海博任瑞芬郭芳尹大芳杨秀云
孙海博,任瑞芬,郭芳,尹大芳,杨秀云
(山西农业大学 林学院,山西 太谷 030801)
目前我国建设园林城市过程中,“有形有色有味”植物选择的比重正不断加大[1]。在当前各地争创园林城市的背景下,具有独特性质的芳香植物得到了更广泛的应用[2]。在芳香植物类群中,因唇形科植物气味独特,所以其应用广泛。其中,美国薄荷(Monardadidyma)为常见的唇形科植物,其形态淡雅、容易种植。但是目前关于美国薄荷园林中应用方面的研究较少[3~5]。
植物对水分胁迫的抗性与植物本身有密切的关联[6]。而对多半植物来说,幼苗生长发育时最易受胁迫影响,所以把植物幼苗期的形态变化及生理变化作为植物耐旱性评价的因素[7]。本研究采用称重控水的方法对美国薄荷幼苗进行处理,从生长指标、叶片相对含水量、光合色素及不同部位脯氨酸、可溶性蛋白、丙二醛含量及抗氧化酶活性等方面,探讨美国薄荷对不同强度干旱胁迫的形态与生理响应,以期对芳香植物的应用提供一些根据。
1 材料与方法
1.1 材料
选择1 a生的美国薄荷幼苗作为试验材料,选择细沙与园土比例为1∶2配置沙壤土作为栽培基质。
1.2 方法
1.2.1 试验方法
试验选取生长状态良好且长势一致的美国薄荷植株,采用称重控水干旱法进行试验。设4个水分梯度进行试验,土壤相对含水量(土壤含水量占田间持水量的百分数)为75%~85%(CK)、60%~65%(轻度胁迫)、40%~50%(中度胁迫)和25%~35%(重度胁迫)[8]。每个处理样本容量为30盆。试验在山西农业大学林学院苗圃温室进行,保证试验条件基本一致。按土壤含水量每日减少7%~10%的脱水速率,于2016年8月8日进行干旱处理,在适宜的土壤水分情况下,首先对需要进行重度胁迫处理的植株自然干旱,之后每隔5 d依次对中度、轻度进行自然干旱。于8月23日,用土壤水分测定仪(WKT-M3)对CK、轻度、中度和重度胁迫进行土壤水量的测定,经过计算,各处理下的土壤相对含水量的平均数值为:82%、64%、46%和30%。结果显示不同处理于8月23日同时达到设定的水分梯度。设定8月23日为第0天,并在处理后的第0、7、14、21天进行指标检测,共4次[8]。试验期间,每天17: 00 用电子秤测试重量来计算植物消耗的水分,并补充相应消耗的水分,使试验的土壤含水量在一定合理区间。
形态指标的测定:株高采用直尺测量并记录数据,随机选择3组植株,用直尺(40 cm)测量植株最高处的叶片叶尖至土壤基质表面的距离;根冠比采用烘干测重法计量[9];叶面积的测量采用图像扫描法,将植株叶扫描成图后导入CAD(2016),利用其描图像功能对叶的图像进行描绘,得出植株叶面积;叶片相对含水量的测定参照李合生[9]的方法进行。
生理指标的测定:超氧化物歧化酶活性测定采用氮蓝四唑光还原法[9]、可溶性蛋白含量测定采用考马斯亮蓝染色法[10]、叶绿素含量测定采用丙酮浸提法[10]、丙二醛含量测定采用硫代巴比妥酸比色法[10]、脯氨酸含量测定采用茚三酮显色法[11]。
1.2.2 数据分析
运用WPS 2014进行数据计算;应用SPSS 17.0分析差异显著性分析和相关性;用平均数±标准误差表示各单因素方差分析,然后做多重比较(LSD法),设定显著水平0.05。
2 结果与分析
2.1 干旱胁迫对美国薄荷形态指标的影响
随着处理的进行,各处理下的株高均有增长。但相同时间下,干旱水平越深,株高越低(表1)。在试验进行7 d后,中度、重度胁迫与CK间差异均显著(P<0.05)。轻度胁迫比CK减少了4.46%、中度胁迫比CK减少了6.53%、重度胁迫比CK减少16.28%;试验进行14 d时,在干旱水平提高的情况下,植高显著降低;试验进行21 d,与同期对照,轻度、中度和重度胁迫下植株高度分别下降了13.08%、23.54%、33.44%。随着胁迫时间的增加,各处理梯度下植株的叶面积均呈增加趋势(表1)。美国薄荷在胁迫21 d之后,轻度胁迫下叶面积比同期CK下降了7.15%、中度胁迫比CK下降了56.3%、重度胁迫比CK下降了64.8%。
在轻度、中度和重度干旱胁迫下,美国薄荷的根冠比增加(表1)。在处理14 d前,重度处理下根冠比比CK组高56.24%,达到最高。在试验进行的14 d至21 d,重度干旱下的根冠比低于中度干旱,植株比同期CK增加49.85%。
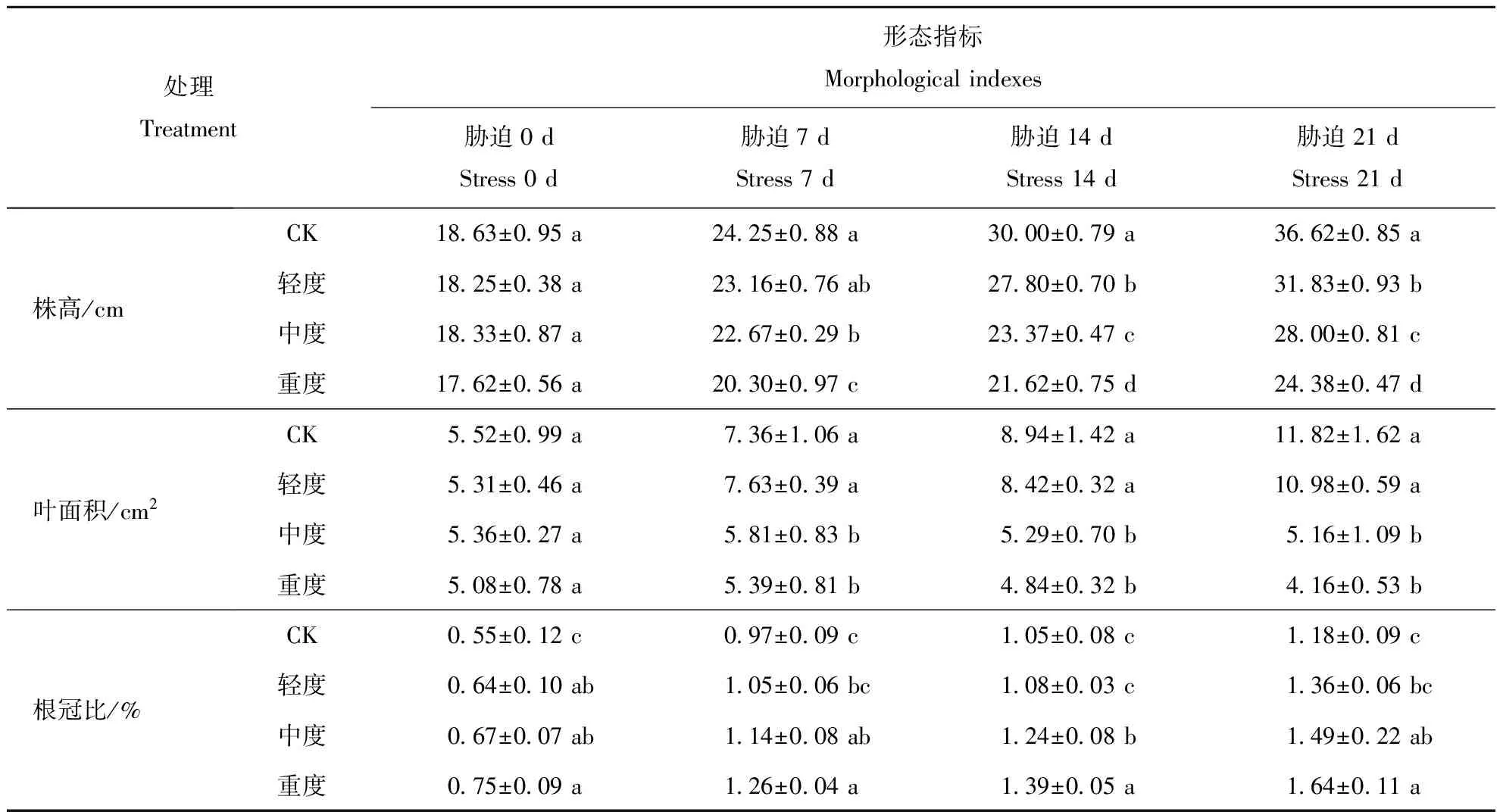
表1 不同干旱处理下美国薄荷的形态指标Table 1 The morphological indexes of Monarda didyma under different treatments of drought stress
注:表中数据为平均值±标准差,不同小写字母间差异显著(P<0.05)。下同
Notes:Date in the table as mean±SE, Different small letters indicate significant difference at 0.05 level. The same below
2.2 干旱胁迫对美国薄荷叶片相对含水量的影响
干旱胁迫下植物组织的自由水减少。而叶组织内水量减少最明显,叶的相对含水量可作为植株在干旱胁迫后保持正常代谢的指标。植株幼苗叶的相对含水量在试验期间均随着干旱水平增加而减少,同一处理下随处理进行持续减少(表2)。刚进行胁迫处理时,美国薄荷试验组间差异不显著(P<0.05),在21 d植株在重度胁迫下比CK降低44.4%。在胁迫加重的情况下,植株叶片的相对含水量减少速率增加、变幅增大,表明了叶片与干旱水平是正相关。在试验期,植株部分叶发生焦枯、掉落甚至死亡的情况。

表2 不同干旱处理下美国薄荷叶片相对含水量的变化Table 2 The changes of relative water content of Monarda didyma under different treatments of drought stress
2.3 干旱胁迫对美国薄荷光和色素含量的影响
在试验刚开始时,叶绿素a含量增加,在试验7 d和14 d植株叶绿素a含量呈现“先升后降”的趋势,中度处理下比同期 CK升高了11.0%,重度处理升高了2.85%。在试验进行21 d叶绿素a含量均有减少,其中轻度处理比CK降低了9.06%、中度处理降低16.2%、重度处理降低20.9%(图1-A)。叶绿素b含量为“上升-先升后降-先升后降-下降”(图1-B)。在14 d,植株叶绿素b含量在中度处理下比CK增加20.9%、重度处理增加14.3%,在胁迫21 d,重度处理下减少CK的27.5%。植株中叶绿素含量随处理进行呈“下降-先升后降-先升后降-下降”型(图1-C)。在处理第7天,中度处理下叶绿素含量达到峰值,比CK上升了43.08%,胁迫14 d和21 d,叶绿素的含量为轻度>中度>重度。植株中类胡萝卜素含量随试验进行呈 “上升-上升-先升后降-下降”型(图1-D),14 d中度处理下增加是CK的14.8%,重度胁迫为对照的5.63%,在处理21 d时,重度胁迫下比CK减少30.5%。
2.4 美国薄荷不同部位脯氨酸含量受干旱胁迫的影响
美国薄荷叶片中脯氨酸含量随处理时间的延长和处理水平的加深也随之增加(图2-A)。在试验第14天,重度处理下脯氨酸含量是CK的5.47倍,达到最高。随处理的进行,中度处理的叶片中脯氨酸含量一直增加,处理21 d时,比CK增进了5.50倍。在试验进行14 d,CK处理下植株茎中的脯氨酸含量是重度胁迫的16.7%,试验的后期,重度处理茎的脯氨酸含量与处理时间成负相关(图2-B)。CK植株根中的脯氨酸含量低于各干旱处理下植株根中的脯氨酸含量(图2-C),并在14 d时达到最高,其中,CK组植株根的脯氨酸含量是重度处理的27.8%。试验后期重度处理下脯氨酸含量有所降低,但仍高于CK。

图2 不同干旱胁迫对美国薄荷脯氨酸含量的影响Fig.2 Effect of different drought stress on the proline content of Monarda didyma
2.5 干旱胁迫对美国薄荷不同部位可溶性蛋白含量的影响
试验过程中,植株叶中可溶性蛋白含量为 “上升-上升-先升后降-先升后降”型(图3-A)。14 d时,CK分别为同期中度和重度处理的0.9%、1.3%。在中度干旱下,叶中可溶性蛋白含量到达最高。植株茎中的可溶性蛋白表现为一直升高的趋势,干旱处理21 d时,比CK增加了83.5%(图3-B)。植株根中可溶性蛋白在处理21 d则呈上升趋势,在重度处理下分别比同期CK上升125%(图3-C)。
2.6 干旱胁迫对美国薄荷超氧化物歧化酶活性的影响
在处理初期(0 d和7 d),植株叶片SOD的含量减少,但变化幅度较小,在处理14 d时,随干旱水平的增强而增高,美国薄荷在重度处理下分别较CK增加22.7%。胁迫21 d时,中度干旱SOD活性比CK升高了16.1%,达到最高(图4-A)。美国薄荷茎中SOD的变化趋势为 “上升-下降-上升-先升后降”型(图4-B),处理进行7 d,重度处理是CK的0.73倍,在14 d时,重度处理下较CK增量为42.6%,在21 d时,中度和重度处理较CK升高21.6%、9.16%。美国薄荷在处理21 d时,根中SOD呈现“先升后降”型,中度胁迫下为同期CK的31.37%(图4-C)。
2.7 干旱胁迫对美国薄荷不同部位丙二醛含量的影响
在中度和重度处理下植株叶中的MDA含量先增加后减少,干旱胁迫14 d时,中度处理下植株叶中MDA含量最高,其中CK组植株是中度处理的2.26倍。而干旱胁迫7 d时,CK是重度处理的1.74倍,同时达到最高(图5-A)。说明在重度胁迫下,叶中的丙二醛开始消解。美国薄荷植株茎中MDA含量在轻度干旱处理,随试验的进程而提高,中度和重度处理下则表现出先升后降的趋势(图5-B)。植株则在胁迫7 d和14 d时重度处理达到峰值,胁迫21 d时轻度处理达到峰值。试验中中度和重度干旱下植株根中的MDA含量在14 d到达最高,低于CK的35.9%和45.1%,表现为先增加后减少(图5-C)。

图3 不同干旱胁迫对美国薄荷可溶性蛋白含量的影响Fig.3 Effect of different drought stress on the soluble protein content of Monarda didyma
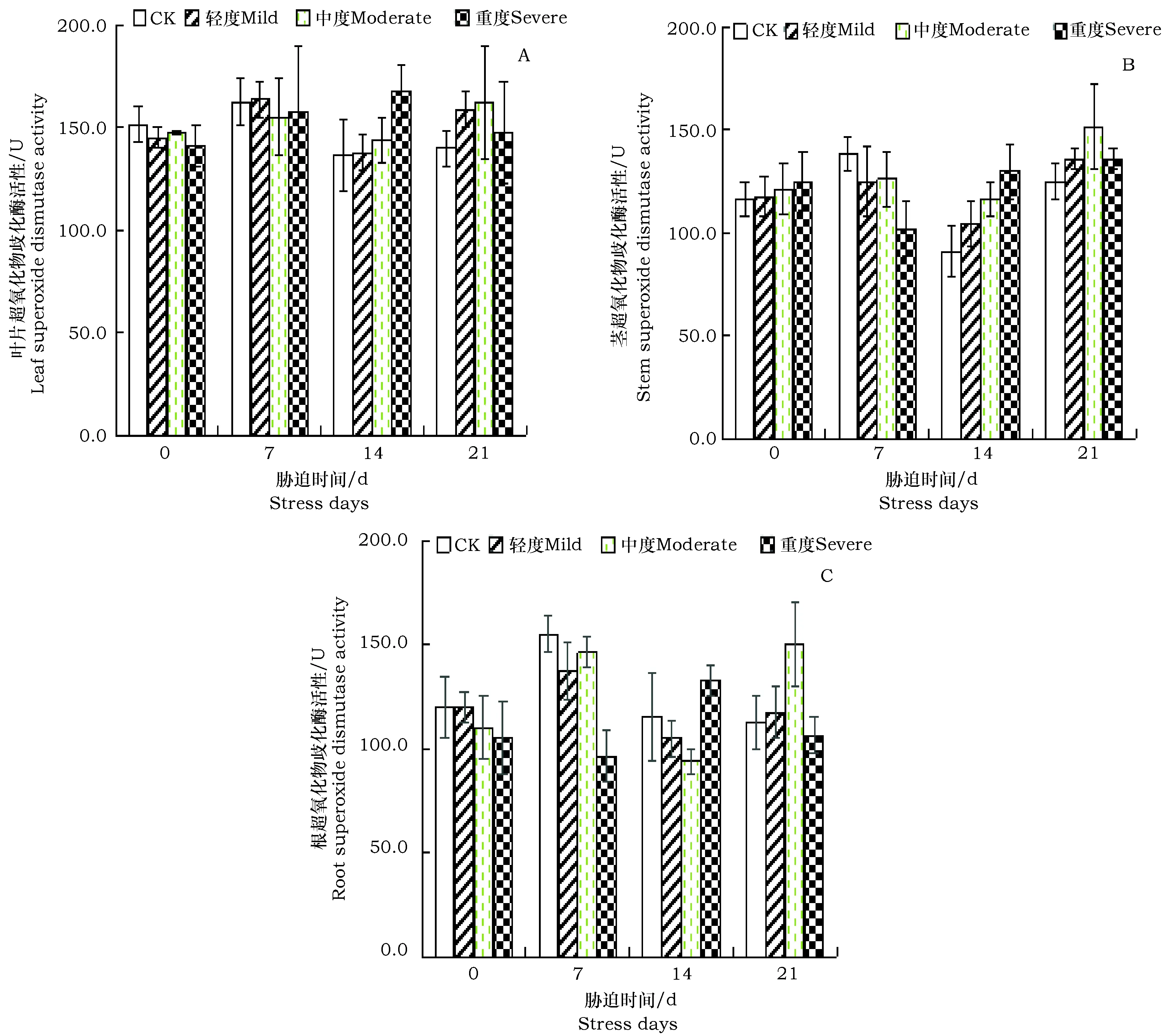
图4 不同干旱胁迫对美国薄荷超氧化物歧化酶活性的影响Fig.4 Effect of different drought stress on the SOD activity of Monarda didyma
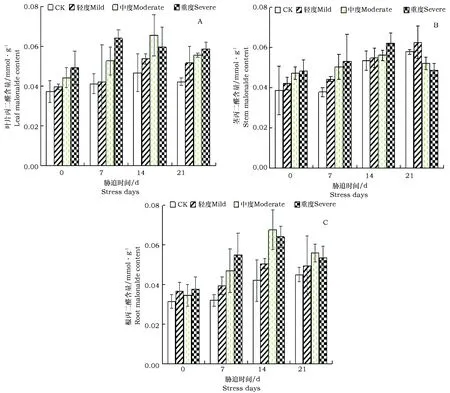
图5 不同干旱胁迫对美国薄荷丙二醛含量的影响Fig.5 Effect of different drought stress on the MDA content of Monarda didyma
3 结论与讨论
3.1 干旱胁迫对美国薄荷形态指标的影响
干旱环境下植株为了最大的维持体内水分,保持存活,植物会改变有关分子、细胞、代谢和生理等方面。在这一系列改变中植株的形态(叶和茎)生长变化最为直观[12,13]。这个观点,俞丽蓉[14]在干旱对沙漠豆的生理影响的试验中也有发现。有些学者在研究逆境下植株根系的分布和生长量时,发现干旱胁迫对根系的状况有一定影响[15]。本次试验结果显示,受到干旱胁迫胁迫植株表现为叶片低垂、枯黄、干枯,生长速率受抑制、叶面积减小。在试验进行7 d时,发现CK叶面积明显高于中度及重度胁迫,直到处理后期。并且随着干旱水平的加大,试验植株的株高增量下降,随着试验的进行株高增量下降趋势增大。这显示了干旱胁迫会对植株的叶和茎造成直接影响,使叶表现为垂落,茎表现长势不良。这与陈宝儿[8]在对薄荷和绞股蓝进行干旱胁迫时,植株的表现一致。而在本次试验的前期,植株在中度和重度干旱处理下根冠比持续增加,根冠比显著增大(P<0.05)。这是由于干旱促进了植株根系对营养物质的吸收,促进了根系的生成和发育,但同时抑制了植株地上部分的生长导致了根冠比的显著增大。
3.2 干旱胁迫对美国薄荷叶片相对含水量的影响
在干旱逆境条件下,植物各营养器官内的水分减少,植株正常生长受到限制。在植物的营养器官中,叶内的水分减少最多,所以常将叶的相对含水量作为植物保水能力的指标。相关试验证实,在逆境下,某些强抗旱性的植物组织内仍然保持一定的含水量,以减弱干旱胁迫带来的损害[16]。本次试验过程中,叶片相对含水量随着干旱水平的加深和干旱天数的延长而减少。并且在胁迫末期,各个处理之间叶片的相对含水量均显著降低(P<0.05),这是因为随着干旱胁迫的加深和时间的延长,导致植株本身生长发育不良,叶长势衰落,甚至发生死亡,使叶内的水分含量减少。
3.3 干旱胁迫对美国薄荷光和色素含量的影响
光合作用是植物体内一系列的化学反应,其中光合色素的种类和含量对植物的生理生态改变以适应干旱逆境有十分重要的作用。在本次试验中,胁迫前期植株的叶绿素a含量上升,中期为先升后降,后期表现为下降。叶绿素b含量的变化与叶绿素a一致。植株总的叶绿素含量在胁迫初期有轻微的下降趋势,之后则先升后降。在试验的前期,类胡萝卜素含量表现为上升,中期时为先增后减,试验后期表现为下降。试验结果证明干旱胁迫处理下,美国薄荷的光合色素含量变化具有多样性,但总体上表现为先升后降。其中光和色素含量先上升可能是因为干旱逆境减少了植株体内的相对含水量,光合色素相对含量升高所致。在研究逆境对大麦的影响中,Stewar发现干旱逆境会抑制大麦叶绿素的产生并且加速其分解[17],并且类胡萝卜素对叶绿素可以起到保护作用[15]。在本次胁迫后期,由于胡萝卜素的减少,从而导致了叶绿素含量的降低,可能是试验后期植株的光和色素含量减少的原因。
3.4 干旱胁迫对美国薄荷不同部位脯氨酸含量的影响
脯氨酸作为植株组织中调节逆境胁迫常见的活性大分子,是植物代谢过程中重要的物质。在干旱胁迫下,脯氨酸可以稳定生物大分子结构,并且因为其水合作用强,可以调节细胞渗透压,减少植株体内的水分流失以应对干旱胁迫[18,19]。在本次试验中,在胁迫14 d时植株叶片中脯氨酸的含量增加显著,同期CK仅为重度胁迫的18.3%。茎中的脯氨酸含量在7 d时达到最高,然后有所降低。在试验进行14 d时,重度干旱下根中的脯氨酸含量是CK的3.60倍到达最高,随后也有所下降。在本次试验中后期,植株茎和根中的脯氨酸含量下降,原因可能是在干旱胁迫下植株受胁迫严重,植株的代谢减弱甚至停止,同时植株根和茎中的脯氨酸发生了降解或者转换成了其他物质。
3.5 干旱胁迫对美国薄荷不同部位可溶性蛋白含量的影响
可溶性蛋白是植物氮代谢的重要产物,其含量变化可反映细胞内蛋白质的合成、变性及降解等多方面的信息。可溶性蛋白质对植物的细胞膜有保护作用,其含量是植物抗旱性的重要指标之一。在对苜蓿叶片形态变化的研究中,康俊梅[20]发现干旱胁迫可以通过促进逆境蛋白合成和不溶性蛋白的转变,进而增加可溶性蛋白的含量[14]。在本次试验中,美国薄荷各营养器官中的可溶性蛋白含量变化不同,叶中变化为“上升-先升后降”型,根中仅在试验前期表现为“先增后减”,茎中含量一直增加。试验出现这种结果可能是因为植株在一定干旱范围内可以产生适量的抗逆蛋白,用来促进可溶性蛋白含量的增加,以减弱干旱胁迫的影响,而随着干旱水平的加深和干旱时间的延长,使植株的蛋白酶活性得到提升,从而降低了可溶性蛋白的含量。
3.6 干旱胁迫对美国薄荷不同部位超氧化物歧化酶活性的影响
SOD作为生物体内参与氧化代谢的酶,是氧化胁迫中的第一保护,在植株抗旱性方面有很大的作用。在本试验中,SOD活性在叶、茎、根中没有出现统一的变化规律,试验初期,叶中SOD活性与胁迫水平成负相关,随着干旱的加深SOD的活性降低;试验中期,SOD活性上升;试验后期,为先上升后降低;茎中变化同叶中。根中的植株SOD活性在胁迫前期呈稳定状态,中期时先降后升,后期时为先升后降。试验过程中,可能是因为植株为了适应干旱胁迫进行生理代谢调节,所以干旱下植株根茎叶中SOD活性有所升高。但是相关试验证明,因为植物的种类不同,其抗旱能力不同,干旱胁迫会降低某些植物的SOD活性[21]。本次试验中可能是因为干旱胁迫时间的延长和程度的加深,导致了美国薄荷SOD活性的下降。
3.7 干旱胁迫对美国薄荷不同部位丙二醛含量的影响
丙二醛含量是作为检测膜脂过氧化程度最适宜的指标[10],其含量越多表示植物的生物膜受损害程度越大。在本次试验中,各梯度下干旱胁迫的初期和中期,植株叶、茎和根中的丙二醛含量随试验进行而升高,这显示了植株营养器官的细胞膜受损害严重,并且在试验过程中受到的伤害不断加大。在试验的后期,中度干旱下植株内的丙二醛含量高于重度干旱。这是因为重度胁迫下的植株受胁迫严重,生理发生紊乱,导致丙二醛降解。在对有关干旱条件下春大豆的生理生化影响的试验中,赵坤[22]证明在干旱逆境先对植株的根系进行信号传导,然后植株自身才进行代谢调节,以减弱干旱胁迫的影响。但是韩德梁[23]在研究干旱胁迫对紫花苜蓿叶的影响中,发现植株叶首先干旱胁迫做出应对。目前对干旱胁迫中植株的信号转导,茎的应对机制相对较少。
综上所述,美国薄荷幼苗形态及生理指标均对干旱胁迫表现出了积极的响应。并且在轻度干旱胁迫下,幼苗可以进行正常生长;中度干旱下,幼苗生长虽然受到影响,但是仍可以进行生长发育,表现出较强的抗旱能力。对美国薄荷的繁殖培育、栽培管理和园林应用等有实际的指导意义。
[1]郝培尧.北京芳香植物资源开发利用初探[J].山东林业科技,2007(4):64-67.
[2]张利琴,朴永吉,沈宁.香草植物及其园林景观应用的研究综述[J].现代园林,2013,10(2):54-58.
[3]李小龙,段树生,张洪,等.4种唇形科植物的香气成分分析[J].河南农业科学,2014,43(7):121-125.
[4]刘军,郝玉兰.美国薄荷的组织培养与植株再生[J].内蒙古科技与经济,2011(21):83-85.
[5]王莉.草原美国薄荷的组织培养及挥发油成分研究[D].成都:四川农业大学,2008.
[6]Sun J K,Zhang W H,Lu Z H,et al.Effects of drought stress on gas exchange characteristics and protective enzyme activities in Elaeagnus and ustifolia and Grewia.Biobal G.Don var.parviflora seedlings[J].Act Ecological Sinica,2009,29(3):1330-1340.
[7]谢志玉,张文辉,刘新成,等.干旱胁迫对文冠果幼苗生长和生理生化特征的影响[J].西北植物学报,2010,30(5):948-954.
[8]陈宝儿.薄荷、绞股蓝高效种植[M].郑州:中原农民出版社,2003:6-12.
[9]李合生.现代植物生理学[M].北京:高等教育出版社,2012:354-356.
[10]潘瑞炽.植物生理学(第六版)[M].北京:高等教育出版社,2008:58-66.
[11]侯福林.植物生理学实验教程[M].北京:科学出版社,2015:32-40.
[12]Ahmed I M,Dai H,Zheng W,et al.Genotypic differences in physiological characteristics in the tolerance to drought and salinity combined stress between Tibetan wild and cultivated barley[J].Plant Physiology and Biochemistry,2013,63(3):49-60.
[13]Kim S G,Bae H H,Jung H J,et al.Physiological and protein profiling response to drought stress in KS141, a Korean maize inbred line[J].Journal of Crop Science and Biotechnology,2014,17(4):273-280.
[14]俞丽蓉.引种观赏植物沙漠豆生长与抗旱生理特性的研究[D].呼和浩特:内蒙古师范大学,2011.
[15]岳勇丽.干旱胁迫下不同品种杨梅苗期生长和生理生化特性[D].杭州:浙江农林大学,2012.
[16]付宝春,薄伟,康红梅,等.干旱胁迫对13种优良鸢尾属植物的生理影响[J].山西农业科学,2013,41(9):924-929.
[17]Stewar CR.Role of carbohydrate in praline accumulation in willed barley leaves[J].Plant Physiology,1978,61(4):775-778.
[18]于善伟.干旱胁迫对草地早熟禾部分器官光合生理及水分代谢指标的影响[D].哈尔滨:东北农业大学,2012.
[19]Hanson A D,Nelsen C E,Everson E H.Evaluation of free proline accumulation as an index of drought resistance using two contrasting barley cultivars[J].Crop Science,1977,17(5):720-726.
[20]Rhodes D,Samaras Y.In cellular and molecular physiology of cell volume regulation[M].Strange,K.Boca Raton:CRC Press,2013:347-361.
[21]郭军战,彭少兵.水分胁迫对树莓、黑莓不同品种生长及膜脂过氧化作用的影响[J].西北林学院学报,2004,19(4):12-15.
[22]赵坤.干旱胁迫条件下春大豆生理生化特性研究[D].哈尔滨:东北农业大学,2010.
[23]韩德梁,王彦荣.紫花苜蓿对干旱胁迫适应性的研究进展[J].草业学报,2005,14(6):7-13.
