谷子干细胞决定基因SiWUS的克隆及功能分析
2018-04-18屈聪玲樊娟贺榆婷杨致荣王兴春
屈聪玲,樊娟,贺榆婷,杨致荣,王兴春,3*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 文理学院,山西 太谷 030801;3.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷 030801)
谷子(SetariaitalicaL.)原产于我国,是禾本科狗尾草属一年生疏丛型草本植物,与玉米、高粱、甘蔗、珍珠粟、糜子和柳枝稷等禾谷类粮食和能源作物近缘。谷子基因组较小,且具有抗旱、耐瘠薄和高光效等突出优势,是极具发展潜力的C4旱生禾谷类模式植物[1~5]。然而,谷子离体再生效率和遗传转化效率均极低,远未达到模式植物拟南芥和水稻的水平,这已经成为制约谷子功能基因研究和转基因作物开发的瓶颈[6]。
日本学者Ben 等[7]率先开展了谷子组织培养的研究,利用四分体到单核小孢子期的花药进行培养,成功地诱导出愈伤组织并再生植株。此后,以谷子幼穗、成熟胚和茎尖等材料作为外植体,进行组织培养也获得了成功[8~10]。在国内,中国农业科学院作物科学研究所的刁现民研究员和中国农业大学的于静娟教授等的实验室以及本团队也开展了谷子组织培养和遗传转化的研究[11, 12]。但截至目前,仍局限于极少数品种,生产上广泛应用的名优谷子晋谷21以及测序品种豫谷1号离体再生仍较困难,限制了其基因功能的研究。
植物离体再生的过程实质上是决定细胞命运的关键基因被激活或关闭的过程,这些基因包括WUSCHEL(WUS)、PLANTGROWTHACTIVITOR37 (PGA37)、LEAFYCOTYLEDON1 (LEC1)和LEC2等[13~15]。其中最重要、功能研究最清楚的是WUS基因。该基因编码一个转录因子,与HAIRY MERISTEM(HAM)家族的4个转录激活子形成一个复合体,而WUS-HAM复合体与CLAVATA(CLV)形成一个反馈调节环决定着茎顶端分生组织干细胞的命运[16, 17]。拟南芥WUS基因能够促进体细胞向胚性细胞的转变,其功能获得性突变体pga6的根外植体能够再生出大量体细胞胚胎,并且这些体细胞胚胎的形成不依赖于外源植物激素[13]。与谷子类似,黄灯笼椒也是一种难以离体再生的植物,遗传转化困难。为解决这一难题,Solís-Ramos 等[18]将拟南芥WUS基因导入黄灯笼椒中,从而大大提高了黄灯笼椒的离体再生效率。类似的,在烟草和咖啡等植物中过量表达WUS基因也可以显著提高离体再生效率,促进体细胞胚胎的发生[19, 20]。2016年,杜邦先锋等公司的研究人员发现玉米WUS2基因和BABYBOOM(BBM)基因对离体再生效率和转化效率影响极大,将其超量表达后可以使转化效率低的玉米品种的转化效率从不到2%提高到51.7%[21]。最近,Mookkan 等[22]成功地利用WUS2和BBM基因建立了玉米自交系B73和大豆栽培种P898012的高效无标记转化系统,该研究将极大地加快玉米和大豆功能基因组研究和转基因品种开发的步伐。
虽然谷子离体再生困难导致其遗传转化效率极低,但谷子SiWUS基因功能尚缺乏深入研究。本文从谷子中克隆了SiWUS基因,并将其转化到拟南芥中,结果表明谷子SiWUS可以促进拟南芥体细胞向胚性细胞的转变,产生大量体细胞胚胎,从而大大提高拟南芥离体再生效率。
1 材料与方法
1.1 材料和试剂
本研究所用的谷子为豫谷1号,拟南芥(Arabidopsisthaliana) 为Columbia 野生型(Col),拟南芥遗传转化采用的农杆菌菌株为GV3101。以上材料均为本实验室保存。pER8载体由中国科学院遗传与发育生物学研究所左建儒研究员馈赠[23]。Murashige and Skoog(MS)培养基购自PhytoTechnology Laboratories公司,货号M519。17-β-雌二醇购自Sigma-Aldrich公司,货号E-8875。KOD-Plus neo高保真DNA聚合酶购自东洋纺(上海)生物科技有限公司,货号KOD-401。
1.2 基因组DNA的提取
谷子基因组DNA提取参照Edwards等的SDS裂解法进行[24],并稍加修改:取50 mg豫谷1号幼嫩叶片加入500 μL DNA提取液(200 mmol·L-1Tris-Cl (pH 7.5),250 mmol·L-1NaCl,25 mmol·L-1EDTA和0.5% SDS),利用高通量组织研磨仪(宁波新芝,型号SCIENTZ-48)充分研磨,加入l00 μL氯仿:异戊醇(24∶1)抽提以去除蛋白,上清液加入等体积异丙醇沉淀DNA。
1.3 WUS基因生物信息学分析
谷子和拟南芥WUS氨基酸序列比对分析利用ClustalW的方法进行;WUS系统进化树的构建利用MEGA7.0软件的邻位相连法进行,所有参数均选择默认值,分析结果拷贝到Photoshop进行编辑。
1.4 谷子SiWUS基因的克隆和pER8-SiWUS诱导表达载体的构建
首先在TAIR网站(http://www.arabidopsis.org)搜索拟南芥AtWUS基因(AT2G17950),获得其蛋白质序列,以此为基础利用Blast在Phytozome网站(https://phytozome.jgi.doe.gov/)进行序列比对,获得谷子SiWUS基因(Seita.3G027800)的信息。根据谷子SiWUS基因组序列设计引物SiWUSF: actctcgagATCACAGCCACACAGCC和SiWUSB:ggactagtATGACTTCTACTTTCACCAG,用于SiWUS基因的克隆。以豫谷1号基因组DNA为模板,利用KOD-Plus neo以及引物SiWUSF和SiWUSB扩增SiWUS基因。PCR产物利用XhoI和SpeI双酶切,连接到同样酶切的pER8载体,构建成谷子SiWUS诱导表达载体pER8-SiWUS。构建的载体经酶切验证和测序,正确的用于拟南芥转基因。
1.5 拟南芥转基因及转基因拟南芥的筛选
拟南芥的遗传转化采用农杆菌介导的花序浸染法[25],并稍加改进:转化了pER8-SiWUS载体的农杆菌培养至OD600值为1.2~1.6左右,离心后利用适量侵染液(5%蔗糖,50 μL·L-1Silwet L-77,2.03 g·L-1MgCl2)重悬;利用1 mL移液器将菌液滴在拟南芥花蕾上,覆盖保鲜膜后黑暗培养12 h,正常培养至收获。收获的拟南芥种子播种在含有20 mg·L-1潮霉素B和50 mg·L-1头孢霉素的MS培养基上,筛选转基因阳性苗。
1.6 SiWUS过量表达拟南芥表型分析
SiWUS拟南芥转基因种子播种在含有0和10 μmol·L-117-β雌二醇的MS培养基(PhytoTechnology LaboratoriesTM, 货号M519,培养基中不含任何植物激素,仅添加20 g·L-1蔗糖和8 g·L-1的琼脂粉,pH 5.8。播种后置于4 ℃春化2 d,然后放在拟南芥培养间培养。培养间温度22 ℃,16 h光照/8 h黑暗。2周后,剪取无诱导剂培养基上培养的转基因拟南芥的叶片和根,置于含有10 μmol·L-117-β-雌二醇的MS培养基(培养基成分同上),继续培养3周,诱导体细胞胚胎。
2 结果与分析
2.1 谷子SiWUS基因的克隆和序列分析
为了获得谷子SiWUS的基因序列,我们以拟南芥AtWUS(AT2G17950)蛋白序列为基础,在Phytozome网站与谷子蛋白序列进行比对分析,共发现19个谷子同源基因。与拟南芥AtWUS类似,这19个谷子WUS都包含1个同源异型盒结构域。其中,Seita.3G027800基因编码的蛋白与拟南芥AtWUS一致性最高,全蛋白一致性为23.69%,同源异型盒结构域一致性为75.76%,因此将该基因命名为SiWUS(图1)。SiWUS基因全长(不包括启动子)2 161 bp,包括3个外显子和2个内含子,编码325个氨基酸残基,比拟南芥AtWUS多了33个氨基酸残基。
2.2 谷子SiWUS的系统进化分析
为了进一步了解谷子SiWUS的遗传进化情况,从Phytozome检索并下载了大豆(Glycinemax)、二倍体棉花(Gossypiumraimondii)、二穗短柄草(Brachypodiumdistachyon)、高粱(Sorghumbicolor)、狗尾草(Setariaviridis)、蒺藜苜蓿(Medicagotruncatula)、可可(Theobromacacao)、柳枝蓟(Panicumvirgatum)、毛果杨(Populustrichocarpa)、葡萄(Vitisvinifera)、水稻OsWUS基因(Oryzasativa)、西红柿(Solanumlycopersicum)和玉米(Zeamays)等13个物种的WUS蛋白序列,与上述拟南芥和谷子的WUS序列一起利用MEGA7.0构建了系统进化树。如图2所示,所有选择植物的WUS蛋白形成两个大的分枝:单子叶植物分枝和双子叶植物分枝。谷子WUS与狗尾草WUS亲缘关系最近,蛋白序列一致性为99.69%,这与目前普遍认为的狗尾草是谷子的近缘野生种这一观点是相符的。这15种植物的WUS基因结构相似,均含有3个外显子和2个内含子(图2)。
2.3 谷子SiWUS基因克隆和诱导表达载体的构建
利用引物SiWUSF和SiWUSB,以豫谷1号基因组DNA为模板进行PCR,扩增谷子SiWUS基因。扩增片段长度1 407 bp,该扩增片段包括SiWUS基因的ORF、78 bp 的5'-UTR、113 bp的3'-UTR以及XhoI和SpeI酶切位点(图3 A)。对该条带进行测序分析表明,该条带序列与参考基因组豫谷1号序列一致。为了避免由于谷子SiWUS基因过量表达而影响植物正常生长发育,导致最终无法获得转基因种子,将SiWUS基因克隆到雌激素诱导表达载体pER8上,构建成pER8-SiWUS载体(图3B)。将该载体转化拟南芥,共获得了14个株系的pER8-SiWUS转基因阳性植株,所有转基因株系呈现类似的表型。无特殊说明,后续试验均采用12号株系进行。

图1 谷子SiWUS与拟南芥AtWUS氨基酸序列比对方框中的氨基酸为同源异型盒结构域Fig.1 Amino acid sequence alignment of Setaria italica SiWUS with Arabidopsis AtWUS The amino acid in the box is the homeobox domain
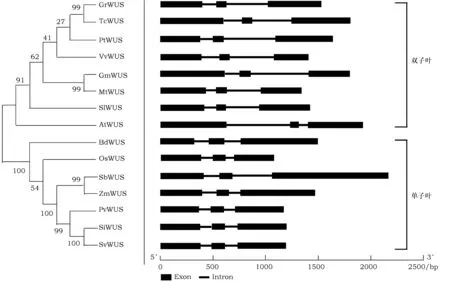
图2 15 种植物WUS蛋白进化树及基因结构图Fig.2 The unrooted phylogenetic tree and gene structure of WUS in 15 plant species
2.4 过量表达谷子SiWUS基因促进了拟南芥体细胞胚胎发生
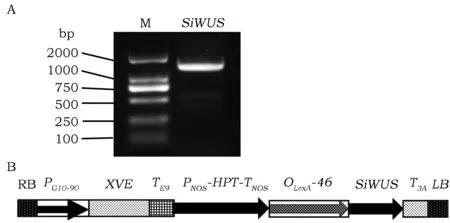
图3 SiWUS基因的PCR扩增和诱导表达载体T-DNAFig.3 PCR amplification of the SiWUS gene and the T-DNA structure of the inducible vector 注:A:SiWUS基因的PCR扩增,M:D2000 DNA 分子量标记(天根生化科技(北京)有限公司,#MD114)。B:SiWUS基因诱导表达载体T-DNA结构示意图。RB:右边界;PG10-90:一个合成的启动子;XVE:一个嵌合的转录激活子,它由细菌抑制子LexA (X)、VP16 (V)的酸性反式激活域和人雌激素受体(E,ER)的调控区组成。TE9:rbcS E9终止子;PNOS: NOS启动子;HPT:潮霉素磷酸转移酶基因;TNOS:NOS终止子;OLexA:LexA操纵子;T3 A:rbcs3A 终止子;LB:左边界。 Note:A:PCR amplification of SiWUS gene. M: D2000 DNA Marker (Tiangen Biotech (Beijing) Co. LTD, #MD114). B:The T-DNA structure of the SiWUS inducible vector. RB: right board; PG10-90: a synthetic promoter; XVE is a chimeric transcription activator which is assembled by fusion of the DNA-binding domain of the bacterial repressor LexA (X), the acidic trans-activating domain of VP16 (V) and the regulatory region of human estrogen receptor (E, ER). TE9:rbcS E9 terminator; PNOS: NOS promoter; HPT: hygromycin phosphotransferase; TNOS: NOS terminator; OLexA: LexA operator; LB: left board.
为了深入了解谷子SiWUS基因在体细胞胚胎发生过程的功能,分别剪取pER8-SiWUS转基因拟南芥的根和叶片,置于含有10 μmol·L-117-β-雌二醇的MS培养基上培养。3周后,谷子SiWUS转基因拟南芥的根部长出大量体细胞胚胎,而未转基因的对照却无体细胞胚胎产生(图4 A)。类似的,SiWUS转基因拟南芥叶片基部也长出大量体细胞胚胎,而未转基因对照叶片已经完全死亡(图4B)。这些结果表明,过量表达谷子SiWUS基因可以促进离体器官的体细胞向胚性细胞转变,并再生出体细胞胚胎。
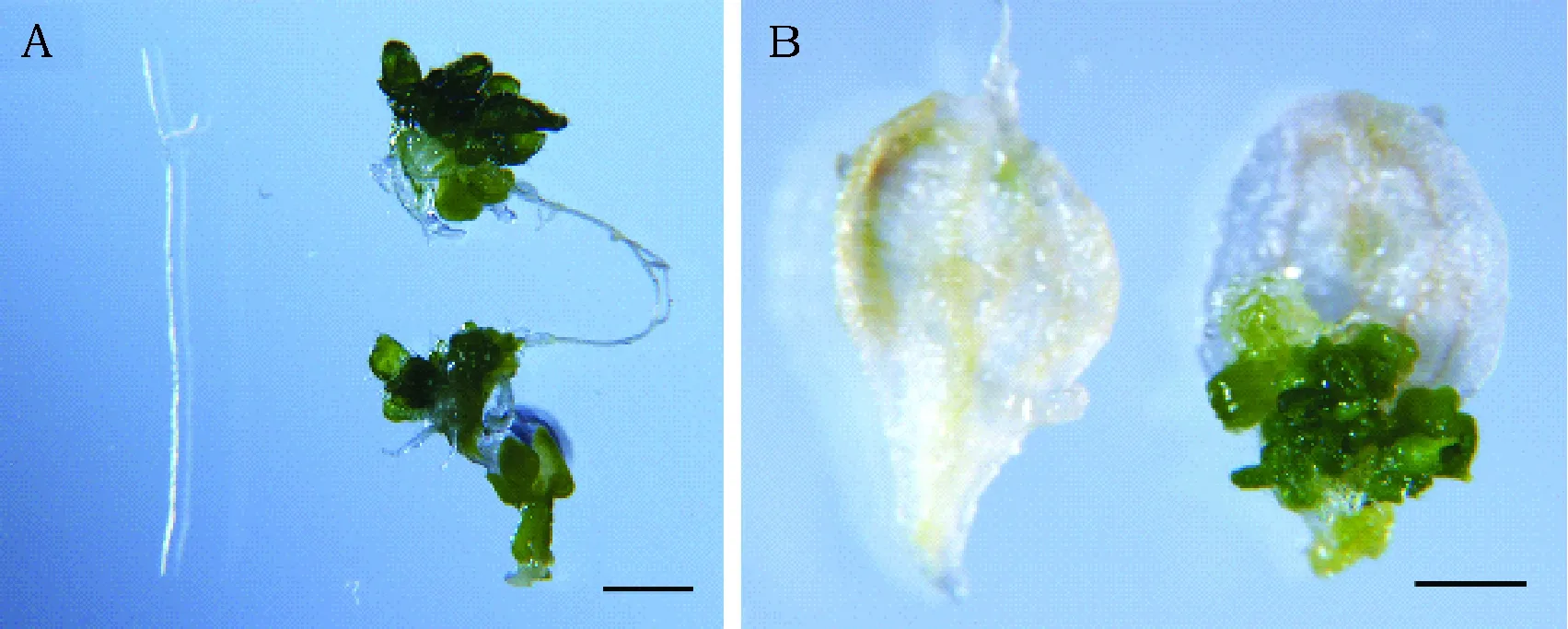
图4 SiWUS转基因拟南芥根和叶的体细胞胚胎Fig.4 Somatic embryos on the roots and leaves of SiWUS transgenic Arabidopsis 注:A:在无(左)和含10 μmol·L-1 17-β雌二醇(右)的MS培养基培养3周的SiWUS转基因拟南芥根外植体。B:在无(左)和含10 μmol·L-1 17-β雌二醇(右)的MS培养基培养3周的SiWUS转基因拟南芥叶外植体。标尺:1 mm。 Note:A:Root explants of SiWUS transgenic Arabidopsis cultured on MS medium without (left) or with 10 μmol·L -1(right) 17-β estradiol for 3 weeks. B: Root explants of SiWUS transgenic Arabidopsis cultured on MS medium without (left) or with 10 μmol·L-1 17-β estradiol (right) for 3 weeks. Bar: 1 mm.
2.5 过量表达谷子SiWUS基因抑制了拟南芥幼苗的发育
在拟南芥中过量表达谷子SiWUS基因可以使离体根和叶片再生出体细胞胚胎,表明SiWUS基因在体细胞向胚性细胞的转变过程中起着重要的作用。然而,这些结果是在离体条件下获得的。为了更深入地了解SiWUS基因在植物生长和发育过程的功能,我们将SiWUS转基因拟南芥种子分别播种在含有0和10 μmol·L-117-β-雌二醇的MS培养基上。在不含雌二醇的培养基上,SiWUS转基因拟南芥生长完全正常,无异常表型(图5 A)。然而,在诱导培养基上SiWUS转基因拟南芥变体生长严重受阻,植株矮小,根部不能伸长(图5B)。一些幼苗根部甚至出现了大量体细胞胚胎(图5C和D)。
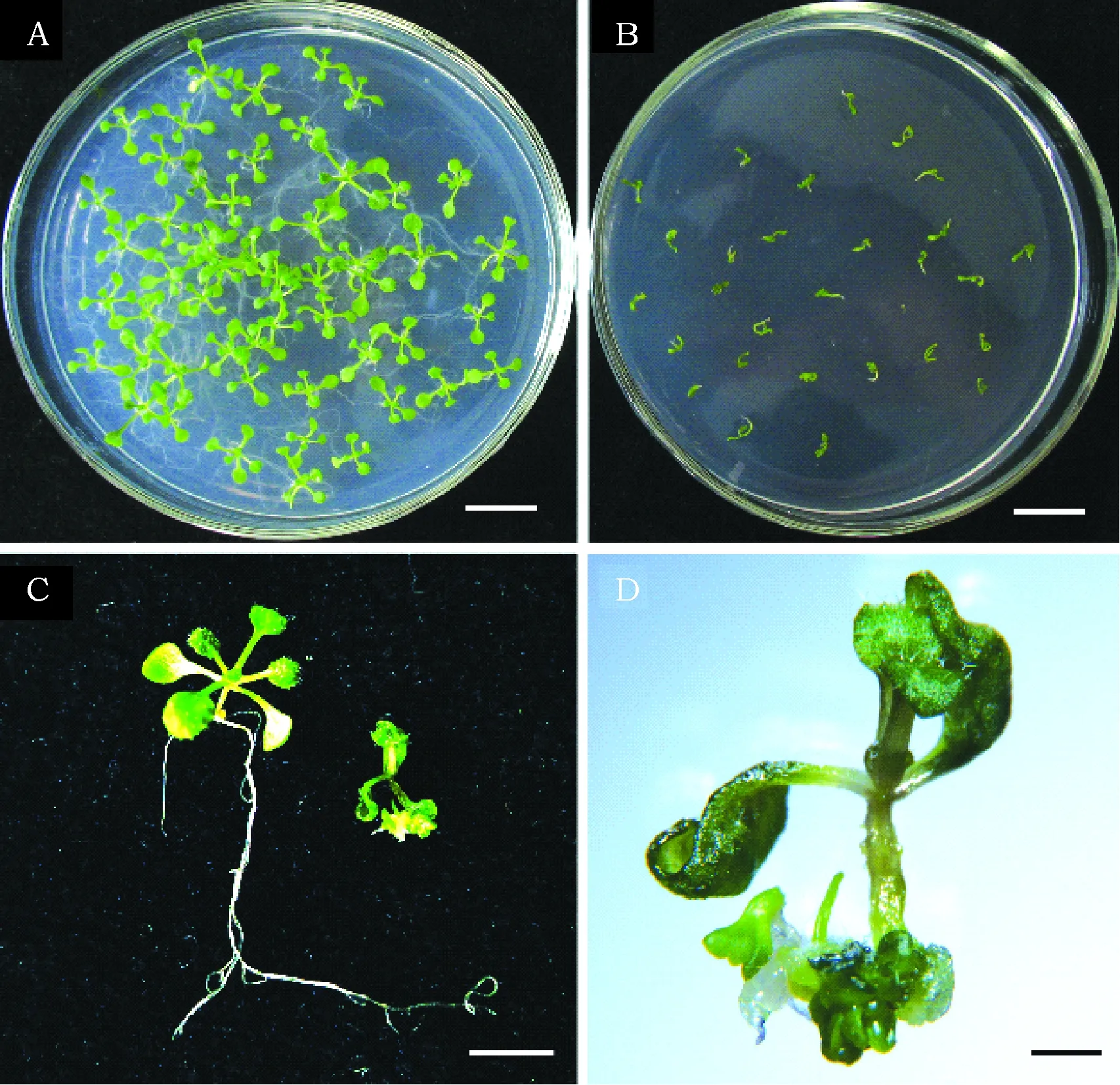
图5 SiWUS转基因拟南芥幼苗Fig.5 Seedlings of SiWUS transgenic Arabidopsis 注:A:在无17-β雌二醇的MS培养基上萌发10 d后的SiWUS转基因拟南芥幼苗。B:含10 μmol·L-117-β雌二醇的MS培养基上萌发10 d后的SiWUS转基因拟南芥幼苗。C:图A和图B中的单株幼苗。D:体视镜拍摄的图C中诱导培养基上培养的幼苗。标尺:A和B 为1 cm,C 为5 mm,D 为1 mm。 Note:A:10 days seedlings of SiWUS transgenic seedlings cultured on MS medium without 17-β estradiol. B:10 days seedlings of SiWUS transgenic seedlings cultured on MS medium with 10 μmol·L-1 17-β estradiol. C: Single seedlings from Panel A and B. D:Seedlings cultured on inducible medium in Panel C taken with a stereomicroscope. Bar: A and B 1 cm, C 5 mm, D 1 mm.
3 讨论与结论
WUS基因在植物离体再生过程起着重要的作用,该基因过量表达可以提高多种植物的离体再生效率和遗传转化效率[13, 18~22]。本文从谷子中克隆了一个SiWUS基因,并深入研究了该基因在植物生长发育和体细胞胚胎发生过程的功能,为SiWUS基因在谷子离体再生和遗传转化中的应用奠定了基础。
从谷子中鉴定了19个WUS基因,与狗尾草中的WUS基因数目相同,但少于拟南芥(25个)、高粱(23个)和玉米(44个)等。系统进化分析表明,15种植物WUS蛋白分成单子叶植物和双子叶植物两大分枝。由于在基因分化过程中,突变积累的数目与进化时间成正比,据此推断植物WUS基因可能出现在单双子叶分化之前。这可能也是导致单子叶谷子SiWUS蛋白与双子叶植物拟南芥AtWUS蛋白一致性较低的原因。
谷子SiWUS与拟南芥AtWUS同源异形盒结构域的一致性较高,为75.76%;但整个蛋白的一致性仅仅为23.69%(图1)。尽管如此,在拟南芥中过量表达谷子SiWUS基因与过量表达拟南芥AtWUS基因表型类似:幼苗生长发育受阻,根不能伸长(图5)[13]。在诱导培养基上萌发10 d的转SiWUS基因拟南芥根部长出体细胞胚胎(图5),而同样处理的转AtWUS基因拟南芥根部未见明显体细胞胚胎形成[13],这可能是由两个转基因拟南芥中WUS基因表达量不同导致的。此外,在拟南芥中过量表达谷子SiWUS基因导致体细胞向
胚性细胞的转变,最终促使离体培养的根和叶片产生体细胞胚胎(图4)。因此,SiWUS基因过量表达有望提高谷子的离体再生效率和遗传转化效率,从根本上解决目前谷子离体再生和遗传转化困难的问题。因此,下一步我们计划将SiWUS基因转到晋谷21和豫谷1号等核心谷子种质资源中,将这些难于再生的谷子品种打造成易于再生和遗传转化的品种。谷子基因组中至少有19个WUS基因,本文仅对SiWUS基因的功能进行了研究,其余18个谷子WUS基因是否也具有类似功能还有待进一步研究。
本研究从谷子中克隆了一个SiWUS基因,并将其在拟南芥中过量表达,通过对幼苗表型分析以及离体根和叶片体细胞胚胎发生情况分析,揭示了该基因在植物生长发育和体细胞胚胎发生过程的功能。过量表达SiWUS基因可促进植物体细胞向胚性细胞的转变,从而产生大量体细胞胚胎。因此,谷子SiWUS基因有望应用于植物遗传转化领域,通过提高离体再生效率,进而提高遗传转化效率。本研究为解决谷子遗传转化困难,提高转化效率,开辟了一条新思路。
附:WUS基因编号
大豆GmWUS(Glyma.01G166800)、二倍体棉花GrWUS(Gorai.008G063200)、二穗短柄草BdWUS基因(Bradi5g25113)、高粱SbWUS基因(Sobic.006G254900)、狗尾草SvWUS基因(Sevir.3G028500)、谷子SiWUS基因(Seita.3G027800)、蒺藜苜蓿MtWUS基因(Medtr5g021930)、可可TcWUS基因(Thecc1EG000215t1)、柳枝蓟PvWUS基因(Pavir.Gb00125)、毛果杨PtWUS(Potri.005G114700)、拟南芥AtWUS基因(AT2G17950)、葡萄VvWUS基因(GSVIVT01018787001)、水稻OsWUS基因(LOC_Os04g56780)、西红柿SlWUS(Solyc02g083950.2)玉米ZmWUS基因(GRMZM2G047448)。
[1]Diao X M, Schnable J, Bennetzen J L, et al. Initiation ofSetariaas a model plant[J]. Frontiers of Agricultural Science and Engineering, 2014,1(1):16-20.
[2]Doust A N, Kellogg E A, Devos K M, et al. Foxtail millet: a sequence-driven grass model system[J]. Plant Physiology, 2009,149(1):137-141.
[3]Li P, Brutnell TP.SetariaviridisandSetariaitalica, model genetic systems for thePanicoidgrasses[J]. Journal of experimental botany, 2011,62(9):3031-3037.
[4]Bennetzen J L, Schmutz J, Wang H, et al. Reference genome sequence of the model plantSetaria[J]. Nature biotechnology, 2012,30(6):555-561.
[5]Zhang G, Liu X, Quan Z, et al. Genome sequence of foxtail millet (Setaria italica) provides insights into grass evolution and biofuel potential[J]. Nature biotechnology, 2012, 30(6): 549.
[6]屈聪玲, 贺榆婷, 王瑞良, 等. 植物转基因技术的过去、现在和未来[J]. 山西农业科学, 2017,45(8):1376-1380,1383.
[7]Ban Y, Kokubu T, Miyaji Y. Production of Haploid Plant by Anther-culture of Setaria italica[J]. Bulletin of the Faculty of Agriculture Kagoshima University, 1971, 21:77-81.
[8]Osuna-Avila P, Nava-Cedillo A, Jofre-Garfias A E, et al. Plant regeneration from shoot apex explants of foxtail millet[J]. Plant Cell Tissue and Organ Culture, 1995, 40(1): 33-35.
[9]Rao A M, Kishor P B, Reddy L A, et al. Callus induction and high frequency plant regeneration in Italian millet (Setariaitalica)[J]. Plant Cell Reports, 1988,7(7):557-559.
[10]Xu ZH, Wang DY, Yang LJ, et al. Somatic embryogenesis and plant regeneration in cultured immature inflorescences ofSetariaitalica[J]. Plant Cell Rep, 1984,3(4):149-150.
[11]刁现民, 王永芳, 李伟, 等. 抗除草剂基因 Bar 转化谷子研究[C]: 全国作物遗传育种学术研讨会, 合肥: 2003:613-618.
[12]Pan Y, Ma X, Liang H, et al. Spatial and temporal activity of the foxtail millet (Setariaitalica) seed-specific promoter pF128[J]. Planta, 2015,241(1):57-67.
[13]Zuo JR, Niu QW, Frugis G, et al. TheWUSCHELgene promotes vegetative-to-embryonic transition inArabidopsis[J]. Plant Journal, 2002,30(3):349-359.
[14]Wang X C, Niu Q W, Teng C, et al. Overexpression ofPGA37/MYB118 andMYB115 promotes vegetative-to-embryonic transition inArabidopsis[J]. Cell Research, 2009,19(2):224-235.
[15]王兴春, 李宏, 王敏. 植物体细胞胚胎发生的调控网络[J]. 生物工程学报, 2010,26(2):141-146.
[16]Mayer K F, Schoof H, Haecker A, et al. Role ofWUSCHELin regulating stem cell fate in theArabidopsisshoot meristem[J]. Cell, 1998,95(6):805-815.
[17]Zhou Y, Liu X, Engstrom E M, et al. Control of plant stem cell function by conserved interacting transcriptional regulators[J]. Nature, 2015,517(7534):377-380.
[18]Solís-Ramos LY, González-Estrada T, Nahuath-Dzib S, et al. Overexpression ofWUSCHELinC.chinensecauses ectopic morphogenesis[J]. Plant Cell Tiss and Organ Culture, 2009,96(3):279-287.
[19]Rashid SZ, Yamaji N, Kyo M. Shoot formation from root tip region: a developmental alteration by WUS in transgenic tobacco[J]. Plant Cell Reports, 2007,26(9):1449-1455.
[20]Arroyo-Herrera A, Ku Gonzalez A, Canche Moo R, et al. Expression of WUSCHEL inCoffeacanephoracauses ectopic morphogenesis and increases somatic embryogenesis[J]. Plant Cell Tiss and Organ Culture, 2008,94(2):171-180.
[21]Lowe K, Wu E, Wang N, et al. Morphogenic regulatorsBABYBOOMandWUSCHELimprove monocot transformation[J]. Plant Cell, 2016,28(9):1998-2015.
[22]Mookkan M, Nelson-Vasilchik K, Hague J, et al. Selectable marker independent transformation of recalcitrant maize inbred B73 and sorghum P898012 mediated by morphogenic regulatorsBABYBOOMandWUSCHEL2[J]. Plant Cell Reports, 2017,36(9):1477-1491.
[23]Zuo J, Niu Q W, Chua N H. An estrogen receptor-based transactivator XVE mediates highly inducible gene expression in transgenic plants[J]. Plant Journal, 2000,24(2):265-273.
[24]Edwards K, Johnstone C, Thompson C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis[J]. Nucleic Acids Research, 1991,19(6):1349.
[25]Clough S J, Bent A F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. Plant Journal, 1998,16(6):735-743.
