快速去除冰冻红细胞甘油的方法改进研究
2018-04-16赵京文
冯 娜,兰 静,彭 鹏,王 锦,刘 娜,张 嫄,赵京文
(陕西省血液中心/西安市中心血站,西安 710061)
冰冻红细胞,是指将悬浮红细胞保存于40%的甘油中用以延长红细胞保存时间,通常在-80℃下可保存10年。在血液供应紧张及稀有血型的血液应用时,可以将冰冻红细胞去除甘油,进而替代悬浮红细胞用于患者,用来缓解临床用血压力。在实际应用中,冰冻红细胞解冰冻去甘油耗费时间较长,同时如何能快速去除甘油并且不损伤红细胞是关键问题。近年来,众多学者将细胞膜运输的数学模型与冰冻红细胞去甘油相结合,使得去甘油的时间极大的缩短[1],并通过优化的实验流程以避免渗透损失。Lusianti等[2]经过微积分计算,确定冰冻红细胞分别与20.4 g/dl盐水孵育8 s,3 g/dl盐水孵育22 s后,可去除冰冻红细胞中绝大部分的甘油[1,3]。
为缩短去除甘油的时间,同时保持红细胞的稳定。我们选择使用三种不同浓度的盐溶液(20.4,3及0.9 g/dl)分别洗涤冰冻红细胞,并优化试验步骤,结果报告如下。
1 材料和方法
1.1研究对象随机选取100人份的悬浮红细胞制备成冰冻红细胞,然后从每人份取10 ml的冰冻红细胞作为检测样本,将制备好的冰冻红细胞分装为1 ml/管,冻存于-80℃保存[4]待检测。
1.2试剂和仪器SysmexKX-21三分类血细胞计数仪(上海希森美康仪器设备有限公司),血浆游离血红蛋白检测试剂盒(北京瑞尔达生物科技有限公司),三酰甘油检测试剂盒(浙江东瓯诊断产品有限公司),大容量细胞计数池。
1.3方法
1.3.1将冰冻红细胞置于37℃水浴中融化1 min。在融化的冰冻红细胞中加入不同浓度的盐溶液,离心后,检测上清液中的游离血红蛋白浓度及甘油含量,用生理盐水重悬红细胞沉淀。解冰冻去甘油后进行血浆游离血红蛋白、白细胞残留量及甘油残留量的检测。
1.3.2实验分组设计:以不同洗涤浓度和离心次数为变量,分成实验组1,2和对照组,研究分组的血样均来源配对同源样品。实验组1分组时每次以5倍体积盐水进行洗涤,最后一遍离心;实验组2在两次加入5倍体积盐水洗液后,进行离心,再加入第三次洗液;对照组为目前使用的常规方法。
具体为:实验组1:在1 ml融化的冰冻红细胞中加入4 ml 20.4 g/dl盐溶液,快速混匀后加入20 ml 3 g/dl盐溶液,快速混匀后加入100 ml 0.9 g/dl盐溶液;3 000 r/min离心5 min,弃上清,最后加入1 ml 0.9 g/dl盐溶液重悬。
实验组2:在1 ml融化的冰冻红细胞中加入4 ml 20.4 g/dl盐溶液,快速混匀后加入20 ml 3 g/dl盐溶液;3 000 r/min离心5 min,弃上清,加入5 ml 0.9 g/dl盐溶液重悬,3 000 r/min离心5 min,弃上清,加入1 ml 0.9 g/dl盐溶液重悬。
对照组:按照《血站技术操作规程(2015版)》的冰冻红细胞解冻去甘油的制备要求,使用全自动红细胞处理仪进行解冰冻去甘油操作,也是目前血站系统冰冻红细胞解冻去甘油采用的常规方法。
1.4统计学分析实验数据采用spss19.0软件分析,采用t检验。组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1两种改良法解冰冻红细胞与常规方法的红细胞质量监测指标比较见表1。红细胞含量、血细胞比容两个指标,红细胞实验组1与对照组比较差异无统计学意义(t值=1.680,P>0.05);而血红蛋白浓度(g/L)为(82±4 vs 96±6),差异有统计学意义(t=2.35,P<0.05);实验组2与对照组比较,红细胞含量、血细胞比容和血红蛋白浓度3个指标,差异均有统计学意义(t值分别为2.851,3.114,2.980,均P<0.05)。实验组1与实验组2比较,红细胞含量、血细胞比容和血红蛋白浓度3个指标实验组1优于实验组2,但两组差异无统计学意义(P>0.05)。
表1
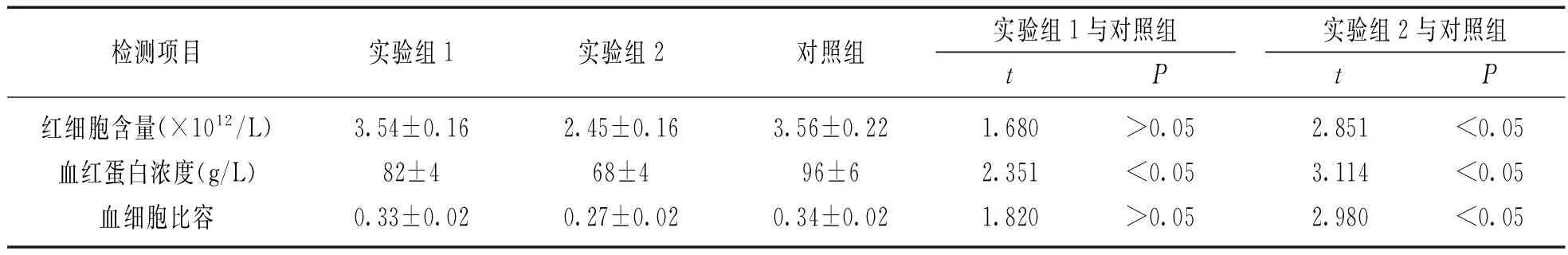
两种改良法解冰冻红细胞与常规方法的红细胞指标(n=100)
2.2两种改良去甘油后的解冰冻红细胞与常规方法的质量检测指标按照《全血与成分血质量要求(2012版)》[5](以下简称“国家标准”)对解冰冻去甘油红细胞进行质量检测,将融化的冰冻红细胞去除甘油后,测量上清液中血浆游离血红蛋白含量、甘油含量及白细胞残留量,结果见表2。实验组1与对照组比较,游离血红蛋白含量、甘油残留量和白细胞残留量3项指标比较,差异均有统计学意义(t值分别为2.633,2.342,2.050,均P<0.05)。实验2组与对照组比较,游离血红蛋白含量、甘油残留量和白细胞残留量3项指标比较,差异均有统计学意义(t值分别为2.532,2.331,2.010,P<0.05)。实验组1和实验组2的质量检测指标均优于对照组,符合国家标准。
表2
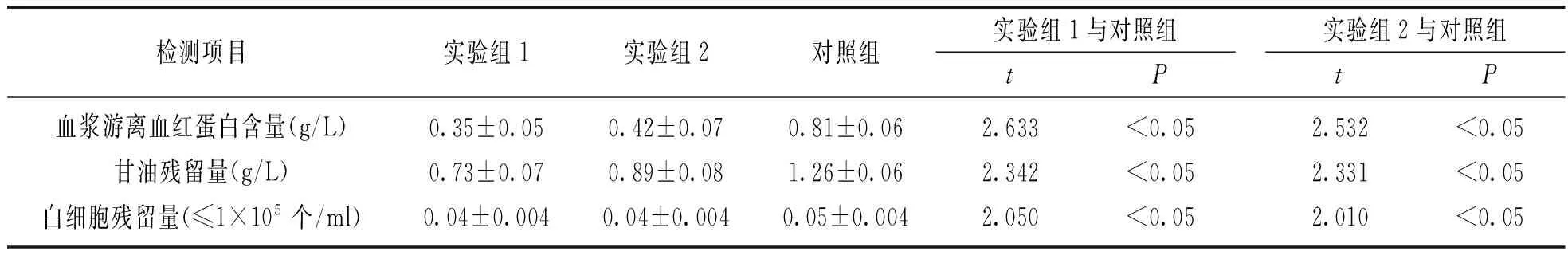
两种改良法去甘油后的解冰冻红细胞与常规方法的质量比较(n=100)
3讨论正常红细胞保存期为28~35天,全血及红细胞类血液成分在保存过程中,红细胞会遭受不同程度的破坏,原因是红细胞膜上的脂蛋白及脂质成分会随着保存时间的延长而减少,细胞内K+降低,Na+,Ca+升高,红细胞变性能力下降,渗透脆性增加,一旦受外界影响,Hb会从细胞内逸出,形成游离血红蛋白(FHb)[6]。冰冻红细胞保存期可达到10年,甘油冻存技术对于延长红细胞的保存期,增强采供血机构的保障应急能力具有重要的使用价值,但是解冰冻去甘油耗费时间较长,而且存在红细胞溶血的问题。去甘油而导致的红细胞溶血主要是因为:①去甘油会产生渗透梯度的改变[7];②红细胞肿胀程度超过最大承受限度。传统的方法已使用近30年,去甘油的原理为缓慢、逐渐改变溶液成分,避免渗透损失的发生[8,9],但紧急情况下整个解冰冻过程耗时较长,有可能无法及时保证血液供应。
为缩短解冰冻的时间,我们设计了快速从冰冻红细胞中去除甘油的两种方法,实验组2相比实验组1减少了洗液体积,更有利于实际操作,但是在红细胞含量、血细胞比容和血红蛋白浓度3个指标实验组1优于实验组2,只是两组没有统计学差异。通过对比试验发现,采用实验组的方法除解冻后成品的血红蛋白浓度低于传统方法的对照组外,其他各项指标均与对照组无差异,部分质量指标优于对照组。我们分析实验组血红蛋白浓度低于传统方法的原因可能为:高浓度盐溶液洗涤去甘油后,使红细胞变形溶血,最佳的去甘油的平衡时间依赖于甘油的渗透性,而检测单个红细胞的甘油渗透性,发现其差异较大,难以选择适合于所有细胞的最佳时间。另外在去甘油期间,混合动力学也会影响预期结果与实验结果的一致性。由于混合溶液时间过短,使溶液未完全混合,可能导致样本中部分的溶液成分有所差异,导致细胞的损伤,造成成品的血红蛋白浓度偏低。因此,在下一步的研究中,需要在考虑这些可变性的条件下,继续优化实验条件。
在本研究中所建立的去甘油的实验方法,可以较快地完成冰冻红细胞去甘油,缩短成品的制备时间,可以提高应急相应速度。在下一步的研究中,除继续优化实验条件、提高血红蛋白等指标外,我们拟进行K+,ATP,2,3-二磷酸甘油酸以及可变形性的测量,对红细胞的质量进行更为全面地评估。同时,我们也会调整溶液成分,在保证各项指标达到国标的前提下,尽量减少洗液的使用量,使该方法适合于日常工作中的使用。
参考文献:
[1]Benson JD,Chicone CC,Critser JK.A general model for the dynamics of cell volume,global stability,and optimal control[J].J Math Biol,2010,63(2):339-359.
[2]Lusianti RE,Benson JD,Acker JP,et al.Rapid removal of glycerol from frozen-thawed red blood cells[J].Biotechnol Prog,2013,29(3):609-620.
[3]Benson JD,Kearsley AJ,Higgins AZ.Mathematical optimization of procedures for cryoprotectant equilibration using a toxicity cost function[J].Cryobiology,2012,64(3):144-151.
[4]中华人民共和国国家卫生和计划生育委员会.血站技术操作规程(2015版)[S].北京:国卫医发(2015)95号附件,2015.
National Health and Family Planning Commission of PRC.The technical procedurements for blood stations(2015 Edition)[J].Beijing:National Medical Treatment(2015)Annex 95,2015.
[5]中华人民共和国国家卫生和计划生育委员会.GB18469-2012全血及成分血质量要求[S].北京:中国标准出版社,2012.
National Health and Family Planning Commission of PRC.GB18469-2012 Quality requirements for whole blood and blood components[J].Beijing:China Standard Press,2012.
[6]马静瑶,郭滔,游离血红蛋白室内质控物的制备及应用[J].现代检验医学杂志,2015,30(4):117-119.
Ma JY,Guo T.Preparation and application of internal quality control substance of free hemoglobin[J].J Mod Lab Med,2015,30(4):117-119.
[7]张成松.冰冻红细胞甘油化与去甘油化的改进[J].菏泽医学专科学校学报,2017,29(2):66-68.
Zhang CS.The glyceride and to glycerol of frozen red blood cells[J].Journal of Heze Medical College,2017,29(2):66-68.
[8]纪宏革,王丽,胡乔,等.甘油对冰冻解冻红细胞质量的影响探讨[J].国际检验医学杂志,2016,37(4):564-565.
Ji HG,Wang L,Hu Q.The effect of glycerol on the quality of frozen and thawed red blood cell[J].Int J Lab Med,2016,37(4):564-565.
[9]王凯,陈新,张网兰,等.应用MAP在4℃条件下保存冰冻解冻去甘油红细胞的质量变化[J].临床输血与检验,2015,17(1):74-75.
Wang K,Chen X,Zhang WL.The quality change of using MAP to save frozen-deglycerolized red blood cells at 4 ℃[J].J Clin Transfus Lab Med,2015,17(1):74-75.
