CD269和CD317在多发性骨髓瘤中的表达及临床意义
2018-04-16刘玉霞胡国瑜袁朝晖李清照沈婵娟
刘玉霞,胡国瑜,袁朝晖,谭 奎,李清照,沈婵娟
(株洲市中心医院血液科,湖南株洲 412007)
多发性骨髓瘤(multiple myeloma,MM)是一种以骨髓中异常浆细胞增生、骨损伤及免疫缺陷为特征的B细胞恶性肿瘤[1,2]。近年研究发现,MM的治疗进展依赖于免疫应答反应,免疫反转抑制可潜在地增强内源性抗骨髓瘤活性。因此,寻找敏感、特异、更有效的免疫检测指标对MM进行准确地预后判断并进行个体化治疗是MM诊治成功的关键。
CD269即B细胞成熟抗原(B-cell maturation antigen,BCMA),为B细胞表面分子,与B细胞活化因子(blymphocytestimulatingfactor,BAFF)结合后可刺激MM细胞的增殖[3]。有研究发现MM细胞BCMA的持续表达表明BCMA可作为调控恶性浆细胞促存活途径的主要受体。国外有学者研制出BCMA抗体,能减弱MM骨病效应,提高患者生活质量,延长生存期,因此可应用于MM的治疗[4]。
CD317即分化抗原簇317(cluster of differentiation 317),又叫骨髓基质细胞抗原2(bone marrow stromal cell antigen 2,BST-2),是终末分化B细胞的特异性表面标志。有研究发现其在多MM细胞中高表达[5],曾作为骨髓瘤免疫疗法的靶向抗原。
国内有关CD269在MM病中的研究报道较多,但对于CD269和CD317在MM中的表达及预后意义,国内文献目前未见相关报道,鉴于BCMA和BST-2同属于B细胞表面分子以及在免疫治疗中成为越来越重要的免疫靶标,本研究通过分析本院63例初诊MM患者CD269和CD317表达率,分析CD269和CD317表达水平与反映MM临床特征疾病进展指标的相关性及预后意义。
1 材料和方法
1.1研究对象选取2015年8月~2017年6月期间血液科就诊的住院MM患者63例(研究组),其中男性40例,女性23例,平均年龄62.39±19.21岁,病例随访至2017年8月,并选择同期缺铁性贫血(IDA)患者35例对照组,其中男性5例,女性30例,平均年龄35.25±8.43岁,其中MM患者诊断符合2013年中国多发性骨髓瘤诊治指南,分期依据ISS分期标准;参与实验的患者,在参与实验之前均签署知情同意书。
1.2主要仪器与试剂美国BD FACSCalibur流式细胞仪,所有单克隆抗体、同型对照、荧光微球和溶血素均购自美国BD公司。
1.3实验方法
1.3.1标本采集:所有病例均严格无菌操作,在患者入院治疗前,抽取骨髓2 ml,肝素抗凝。
1.3.2流式细胞术检测分析:分别吸取所收集的患者骨髓细胞悬液,调整细胞数至(0.5~1.0)×106个/ml,采用四色流式分析方案检测胞膜抗原,每管取100 μl样本加不同组合抗体各20 μl,同时做同型对照管,混匀,避光20 min,溶血后上机检测,采用CellQuest Pro软件获取并分析10 000个细胞,通过CD45/SSC和CD138联合设门并分析该细胞群中各抗原的阳性率和表达强度,膜抗原阳性率>20%为阳性。
1.3.3其他临床指标检测:采用SYSMEX XE-2100血液分析仪检测血红蛋白(Hb)浓度,采用全自动生化仪检测血清β2微球蛋白(β2-MG) 浓度及血清乳酸脱氢酶(LDH)浓度。
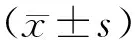
2 结果
2.1MM患者瘤细胞表面CD269和CD317的表达情况MM组和对照组的CD269阳性率分别为(86.6±2.35)% vs (4.33±1.69)%,差异具有统计学意义(t=4.256,P<0.05);CD317阳性率分别为(71.42±0.62)% vs (8.32±3.89)%,差异具有统计学意义(t=3.102,P<0.05)。
2.2CD269和CD317的表达与其他CD抗原表达的关系见表1。45例MM患者CD269和CD317阳性组的CD56阳性率为68.88%(31/45),CD117阳性率为17.77%(8/45),而18例阴性组中CD56阳性率为5.55%(1/18);CD117阳性率为66.66%(12/18); CD56 的表达水平阳性组显著高于阴性组(t=4.032,P<0.05),而CD117的表达水平阳性组显著低于阴性组(t=2.832,P<0.05),CD19,CD20的表达两组间差异无明显统计学意义(P>0.05);Spearman相关性分析显示,MM患者CD269和CD317表达水平与CD56表达水平呈正相关(r=0.392,P<0.05),与CD117表达水平呈负相关(r=-0.210,P<0.05)。
2.3CD269和CD317表达与其他实验室指标的相关性见表2。MM患者CD269和CD317阳性组血清Hb含量显著低于阴性组患者(t=3.012,P<0.05),血清β2-MG水平阳性组低于阴性组(t=2.024,P<0.05),差异均有统计学意义。血清LDH水平在两组之间的差异无统计学意义(P>0.05)。Spearman相关性分析显示,MM患者CD269和CD317表达水平与血清Hb含量呈负相关(r=-0.212,P<0.05),与血清β2- MG水平呈负相关(r=-0.312,P<0.05)。
表1

63例MM患者CD269,CD317阳性组
表2

63例MM患者CD269,CD317阳性组
3讨论多发性骨髓瘤(MM)是骨髓内浆细胞异常增生并伴单克隆性免疫球蛋白增多为特点的一种恶性肿瘤。MM患者临床上主要表现为贫血、肾功能损害、免疫力低下、骨破坏、感染等[6]。目前的治疗手段有化疗、自体骨髓或外周血造血干细胞移植及生物治疗等,但整体疗效并不令人满意。因此对MM的发生发展机制及预后因素的研究对于寻求有效的MM新免疫疗法依然重要。
BCMA(CD269)属于B淋巴细胞刺激因子(BAFF)的受体之一[7],BAFF可调控恶性B细胞的增殖,BAFF及其受体参与了MM的存活、分化与增殖,在MM的病理生理中发挥重要作用。有研究发现[8],BAFF和APRIL基因在MM细胞株和初(难)治、复发MM患者的表达水平均显著增加。可溶性BCMA在骨髓瘤患者中高表达,其表达高低与患者疾病进展及预后具有相关性,因此BAFF-BCMA轴在B细胞肿瘤的细胞生理中可能起着至关重要的作用。
BST-2(CD317)是一种II型跨膜蛋白,早期研究发现CD317可通过调控免疫应答发挥抗病毒、抗炎症作用。近年研究表明[9~12],CD317是一个肿瘤相关抗原,在多发性骨髓瘤、B淋巴瘤、肺癌、子宫内膜癌、慢性B 淋巴细胞白血病等均有表达上调的现象,提示可能参与肿瘤的发生发展过程。尽管CD317在肿瘤生物学领域的作用机制尚不明确,但已有不少该领域的专家如Chiriva-Internati教授等[13]和Carpenter等[14]开展了靶向CD317的抗肿瘤治疗研究。
缺铁性贫血是一种由于体内的贮存铁不足,影响血红蛋白的合成而导致的贫血。缺铁性贫血患者的骨髓中有较为丰富的有核细胞,且巨核细胞形态及数量均属正常状态。可选作为本实验有效的阴性对照。
本研究分析MM细胞表面CD269,CD317的表达水平及与CD56,CD117,CD19,CD20表达的相关性,结果表明:CD269,CD317在MM患者浆细胞表面有较高的阳性表达率,证实CD269和CD317参与了MM的发生发展过程。与CD56表达率呈正相关,与CD117表达率呈负相关,而与CD19,CD20表达率不相关。CD56与骨髓瘤细胞向骨髓基质定位有关。正常浆细胞不表达CD56,骨髓瘤细胞可异常表达。有研究表明CD56锚定作用可以限制骨髓瘤的髓外侵袭,因此与良好预后相关[15]。Pan等[16]研究发现,CD56阴性MM患者更易伴有肾功能不全及髓外浸润,这可能与患者的不良预后相关。CD117是一种肿瘤相关标志物,CD117高表达可能与高肿瘤负荷及高增殖活性有关。本研究中CD269,CD317阳性组CD56表达率显著高于阴性组,CD117表达率显著低于阴性组,初步认为表达CD269,CD317的MM患者肿瘤负荷较小、增殖减低,可能预后较好。
有研究显示[17],血清β2-微球蛋白及LDH在MM疾病发生、发展及预后中发挥着重要作用,其表达水平的高低与MM病情进展存在密切的关联,国外学者[18]研究证实血清β2-微球蛋白是MM分期的重要指标之一,与肿瘤负荷存在一定相关性[19];而LDH是机体内糖酵解中重要代谢酶,恶性肿瘤及血液型疾病患者血清中LDH表达水平将出现明显升高现象[20]。
本研究结果表明:CD269,CD317阳性组Hb含量、血清β2-MG水平低于阴性组,CD269,CD317表达水平与血清Hb含量、β2-MG水平呈负相关,差异均具有统计学意义(P<0.05);与LDH水平无相关性(P>0.05),提示CD269,CD317阳性MM患者预后良好。
综上所述,本实验揭示了CD269,CD317在初诊MM患者中的免疫表型特点及免疫诊断和预后价值,目前国内尚无CD269,CD317在MM免疫诊断和预后意义中的相关报道,还需扩大样本量、延长预后因素的观察时间、积累更多的其他有关MM骨髓细胞形态学、融合基因、细胞遗传学诊断方面以及其他预后因素临床资料进行更深入研究。
参考文献:
[1]Blimark C,Holmberg E,Mellqvist UH,et al.Multiple myeloma and infections:a population-based study on 9 253 multiple myeloma patients[J].Haematology,2015,100(1):107-113.
[2]Pratt G,Goodyear O,Moss P,et al.Immunodeficiency and immunotherapy in multiple myeloma[J].Br J Haematology,2007,138(5):563-579.
[3]Tai YT,Acharya C,An G,et al.APRIL and BCMA promote human multiple myeloma growth and immunosuppression in the bone marrow microenvironment[J].Blood,2016,127(25):3225-3236.
[4]Oden F,Marino SF,Brand J,et al.Potent anti-tumor response by targeting B cell maturation antigen (BCMA) in a mouse model of multiple myeloma[J].Mol Oncol,2015,9(7):1348-1358.
[5]Ohtomo T,Sugamata Y,Ozaki Y,et al.Molecular cloning and characterization of a surface antigen preferentially overexpressed on multiple myeloma cells[J].Biochemical and Biophysical Research Communications,1999,258(3):583-591.
[6]Hobbs CA,Sherman SL,Yi P,et al.Polymorphisms in genes involved in folate metabolism as maternal risk factors for Down syndrome[J].Am J Hum Genet,2000,67(3):623-630.
[7]Lied GA,Berstad A.Functional and clinical aspects of the B-cell-activating factor (BAFF): a narrative review[J].Scand J Immunol,2011,73(1):1-7.
[8]Lemancewicz D,Bolkun L,Jablonska E,et al.Evaluation of TNF superfamily molecules in multiple myeloma patients:correlation with biological and clinical features[J].Leuk Res,2013,37(9):1089-1093.
[9]Swiecki M,Omattage NS,Brett TJ.BST-2/tetherin:structural biology,viral antagonism,and immunobiology of a potent host antiviral factor[J].Molecular Immunology,2013,54(2):132-139.
[10]Sayeed A,Luciani-Torres G,Meng Z,et al.Aberrant regulation of the BST2 (Tetherin) promoter enhances cell proliferation and apoptosis evasion in high grade breast cancer cells[J].PLoS One,2013,8(6):440-441.
[11]Fang KH,Kao HK,Chi LM,et al.Overexpression of BST2 is associated with nodal metastasis and poorer prognosis in oral cavity cancer[J].the Laryngoscope,2014,124(9):E354-E360.
[12]Gong S,Osei ES,Kaplan D,et al.CD317 is over-expressed in B-cell chronic lymphocytic leukemia,but not B-cell acute lymphoblastic leukemia [J].International Journal of Clinical & Experimental Pathology,2015,8(2):1613-1621.
[13]Chiriva-Inernati M,Liu Y,Weidanz JA,et al.Testing recombinant adeno-associated virus-gene loading of dendritic cells for generating potent cytotoxic T lymphocytes against a prototype self-antigen, multiple myeloma HM1.24[J].Blood,2003,102(9):3100-3107.
[14]Carpenter RO,Evbuomwan MO,Pittaluga S,et al.B-cell maturation antigen is a promising target for adoptive T-cell therapy of multiple myeloma[J].Clin Cancer Res,2013,19(8):2048-2060.
[15]Blaheta RA,Beecken WD,Engl T,et al.Human cytomegalovirus infection of tumor cells downregulates NCAM(CD56):a novel mechanism for virus-induced tumor invasiveness[J].Neoplasia,2004,6(4):323-331.
[16]Pan Y,Wang H,Tao Q,et al.Absence of both CD56 and CD117 expression on malignant plsma cells is related with a poor prognosis in patients with newly diagnosed multiple myeloma[J].Leuk Res,2016,40(1):77-82.
[17]段丽娟,李超,杨如玉.多发性骨髓瘤患者血清β2-微球蛋白,TNF-α,CRP及IL-6水平检测[J].中国实验血液学杂志,2015,23(5):1362-1365.
Duan LJ,Li C,Yang RY.Values of detecting the levels of β2-MG,TNF-α,CRP,IL-6 in the patients with multiple myeloma[J].Journal of Experimental Hematology,2015,23 (5):1362-1365.
[18]Bataille R,Annweiler C,Beaucher O,et al.Multiple myeloma international staging system:“staging” or simply “aging” system[J].Clin Lymphoma Myeloma Leuk,2013,13(6):635-637.
[19]秦小琪,徐燕,安刚,等.肾功能对β2-微球蛋白水平作为多发性骨髓瘤国际分期系统预后因素的影响-单中心666例临床分析[J].中华血液学杂志,2015,36(5):393-397.
Qin XQ,Xu Y,An G,et al.The impact of renal function on prognostic value β2-microglobulin of ISS stage system in multiple myeloma patients:a clinical data analysis of 666 patients in a single center[J].Chin J Hematol,2015,36(5):393-397.
[20]何亚利,梁顺容,范佳鑫.多发性骨髓瘤患者和厚朴酚联合三氧化二砷治疗前后血清β2-MG及LDH的变化[J].检验医学,2016,31(6):449-452.
He YL,Liang SR,Fan JX,et al.Changes of serum β2-MG and LDH in combination theraphy of multiple myeloma with honokiol and arsenic trioxide[J].Laboratory Medicine,2016,31(6):449-452.
