压实度对玉米青贮开窖后营养品质及有氧稳定性的影响
2018-04-16王旭哲张凡凡马春晖李菲菲王树林
王旭哲,张凡凡,马春晖,李菲菲,王树林
(石河子大学动物科技学院,石河子 832003)
0 引 言
玉米青贮是畜牧业最重要的饲料来源之一[1],制作青贮的主要目的是通过厌氧条件下的乳酸菌发酵,最大限度地保护饲料作物中的原始营养素。开窖后,青贮饲料的好氧变质便启动,空气渗透是有氧变质的主要原因,造成干物质和养分流失,营养物质损耗,青贮温度的上升以及有害菌的增殖,大量好氧微生物的活动变得活跃,腐败进程开始[2-4]。因此,在青贮饲料生产中快速降低残余空气同时防止空气渗透是控制好氧变质的关键。而增加压实度能降低青贮原料间隙的残余空气,从而提高青贮发酵品质的有效方法[5]。良好的青贮饲料质量的前提是迅速去除饲料中的氧气,使青贮处于压实状态[6]。高压实度青贮其目的是消除空气通道,组织氧气的流动,防止空气渗透。通过控制适当的青贮压实度进而降低有机物的氧化作用,即压实度是影响青贮干物质的保存的关键参数[7]。很多牛奶场均发现压实密度可能成为影响青贮饲料有氧稳定性的主要原因之一[8]。因此,对于提高青贮的品质而言,青贮压实度的控制显得尤为重要。鉴于青贮压实度对于开窖后青贮品质的影响,建立开窖时间,青贮压实度以及开窖后青贮温度与青贮营养、发酵品质间的多元线性回归关系,可在生产实践中针对已知条件(开窖时间、压实度、温度)快速预测开窖后青贮品质。
本研究设置不同压实度的青贮处理,探究压实度对开窖后玉米青贮品质及有氧稳定性的影响,对压实度与青贮品质进行拟合分析,对开窖时间、压实度和发酵温度与营养、发酵品质进行多元线性回归分析,建立回归模型。旨在明确青贮开窖后压实度与营养、发酵品质及有氧稳定性间的关系,通过建立的多元线性回归模型进行青贮品质的预测,为生产实践提供参考。
1 材料与方法
1.1 材料与样地
试验选用新饲玉10号作为青贮原料。试验选定在石河子大学的牧草试验站(44°20′N,88°30′E,海拔 420 m)开展。其生长期:4月10日~7月20日(2015年),共计 101 d,青贮玉米的刈割期定于乳熟末期/蜡熟初期进行,将青贮玉米切碎至1~2 cm。发酵罐采用PVC直筒管材设计,高102 cm,直径19.4 cm,壁厚0.6 cm,容积为30.2 L。全株玉米青贮前原料化学成分见表1。

表1 玉米青贮原料营养成分Table 1 Nutrients composition of corn ensiling material
1.2 试验设计
试验将发酵装料密度设计为5个梯度,分别为350、400、500、600、700 kg/m3,其填装量分别为 10.57、12.08、15.10、18.12、21.14 kg。每个梯度3次重复,此外各处理填装量各做一罐用于模型验证。分别在青贮装罐完成后50 d时开窖,同时检测发酵罐开窖后第0、12、24、36、60、108 h青贮的变化。全程动态监测各处理青贮温度变化。对青贮pH值、干物质(DM)、粗蛋白(CP)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF),水溶性碳水化合物(WSC)、乳酸(LA)、乙酸(AA)、氨态氮(NH3-N)进行分析。对开窖时间、压实度和发酵温度与营养、发酵品质进行多元线性回归分析,并采集不同开窖时间的各处理青贮样品30份进行模型合理性分析。
1.3 测定方法
DM 采用 105 ℃烘干法测定[9];pH 值利用酸度计(PHS-3C,上海雷磁)测定;CP测定采用凯氏定氮法[9];NDF和ADF采用范氏法(Van Soest)[9];WSC测定采用蒽酮比色法测定[10];有机酸(乳酸、乙酸、丙酸、丁酸)用液相色谱法测定[11],氨态氮采用苯酚-次氯酸钠比色法测定[2];有氧稳定性测定在发酵50 d后打开全部实验室青贮发窖罐,罐口用双层纱布包裹,防止果蝇等其他杂质污染和水分散失,空气可自由进入发酵罐中,置于室温条件下保存。将多点式温度记录仪(i500-E3TW,玉环智拓仪器科技有限公司)的多个探头分别放置于发酵罐的几何中心,同时在环境中放置3个探头,用于测定环境温度,温度记录仪测量时间间隔设置为 5 min,每个处理放置 3个温度探头。如果样品温度高于环境温度 2 ℃,说明青贮开始腐败变质,此时记录时间即为有氧稳定时间[2]。
1.4 数据处理
在Excel中作数据的基本处理,用SPSS 20.0对各处理的DM、pH值、CP、NDF、ADF、WSC、NH3-N、乳酸、乙酸、丙酸、丁酸浓度以及氧稳定时间进行方差分析,通过 Duncan法对各处理间的差异进行比较。采用Origin 8.0进行绘图。运用SPSS 20.0进行多元线性回归分析,多元线性回归建立因变量 y(pH值、DM、CP、NDF、ADF、WSC、乳酸、乙酸、NH3-N)与多个自变量x(开窖时间,压实密度,发酵温度)间的多元线性回归模型。
2 结果与分析
2.1 不同压实度下有氧稳定性变化
青贮压实度的增加,使有氧稳定时间延长(图1),处理350~700 kg/m3有氧暴露后稳定的时间分别为15、49、62、100和 73 h。各处理间均存在显著差异(P<0.05),其中600 kg/m3处理组有氧稳定时间最长达到100 h。运用ExpDec 1模型对青贮压实度和有氧稳定性进行拟合发现二者呈现显著非线性关系(P<0.05),其关系式为式(1)。
y =-3 739.145e(-x/87.704)+85.197(R2=0.688)(1)
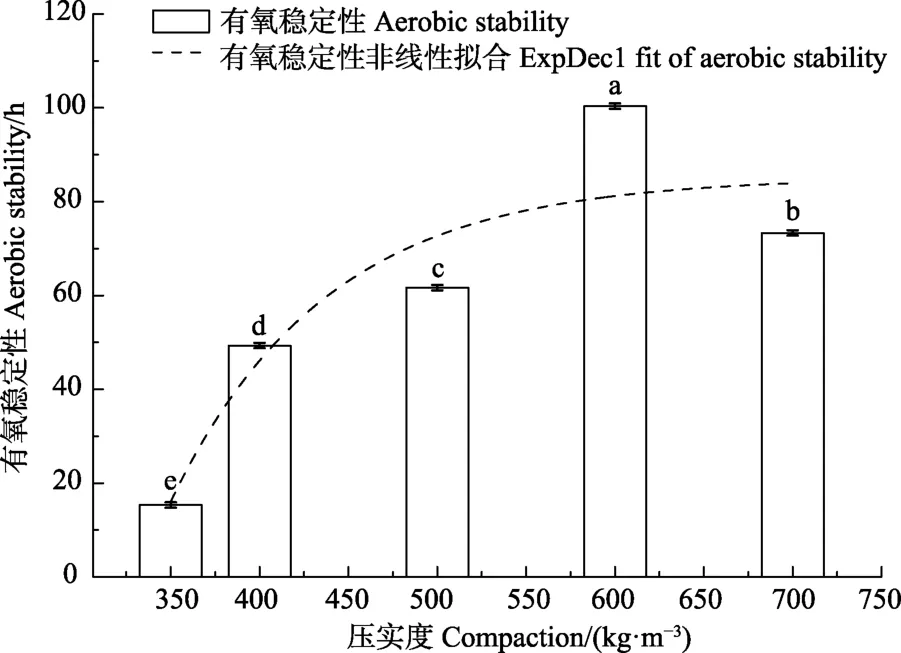
图1 不同压实度玉米青贮的有氧稳定性Fig.1 Aerobic stability of different compaction corn silage
2.2 不同压实度下营养品质动态变化
玉米青贮开窖108 h后各处理DM浓度较开窖0 h下降0.6%~5.5%(除350 kg/m3,压实度为350 kg/m3玉米青贮DM浓度在开窖108 h后较开窖0 h未见显著差异(P>0.05)),结果见表2。开窖期间,350 kg/m3青贮压实度处理其DM浓度始终显著低于500、600和700 kg/m3青贮压实度2.6%~11.9%(P<0.05)。
各青贮压实度处理CP浓度,在开窖108 h后较开窖0 h下降13.7%~17.0%(表2)。开窖后,青贮压实度为350 kg/m3处理的CP浓度,始终显著低于600和700 kg/m3青贮压实度处理 22.8%~37.0%(P<0.05)。开窖 108 h时 600 kg/m3压实度的青贮 CP浓度显著高于其余处理(P<0.05)。
各压实度玉米青贮处理NDF和ADF的浓度在开窖108 h后,分别较开窖0 h增加了6.7%~9.5%和8.3%~16.4%。其中青贮压实度350 kg/m3处理的NDF浓度除开窖 24 h外,其余开窖时间均显著高于 500、600和 700 kg/m3压实度处理1.2%~4.6%(P<0.05)。压实度350 kg/m3的ADF浓度在开窖后始终显著高于500、600和700 kg/m3青贮压实度处理6.2%~14.1%(P<0.05)。
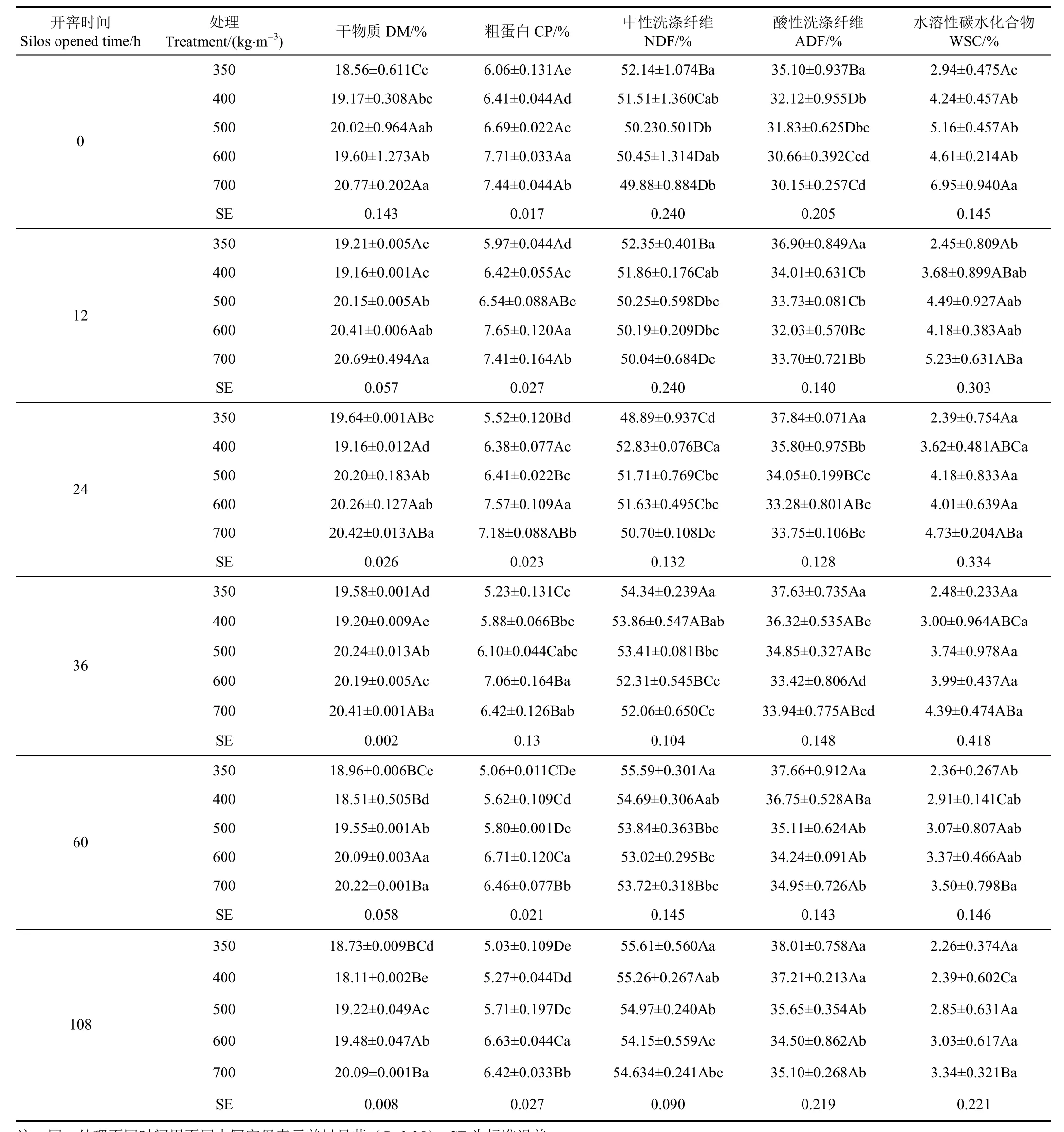
表2 开窖后不同压实度下玉米青贮营养品质变化Table 2 Change of nutritive value of corn silage at different compaction after silos opened
开窖后各玉米青贮处理的WSC浓度逐步降低,开窖108 h后部分压实度处理WSC浓度较开窖0 h下降23%~51%(表2)。玉米青贮压实度为700 kg/m3处理其WSC浓度分别在开窖0 h,12 h和60 h显著比压实度为350 kg/m3的处理高32.7%~66.1%(P<0.05)。其余开窖时间各处理间的WSC浓度差异不显著(P>0.05)。
2.3 不同压实度下发酵品质动态变化
青贮开窖后,各玉米青贮压实度处理pH值在开窖108 h时较开窖0 h时上升了14.0%~96.6 %(图2a)。350 kg/m3压实度处理的玉米青贮其pH在开窖后始终显著高于压实度为500、600和700 kg/m3的处理组3.1%~39.9%(P<0.05)。开窖60 h后青贮压实度350和400 kg/m3的 pH值均超过劣质青贮(腐败)规定值 4.80,而开窖108 h时压实度为600和700 kg/m3的玉米青贮处理pH值差异不显著(P>0.05)。
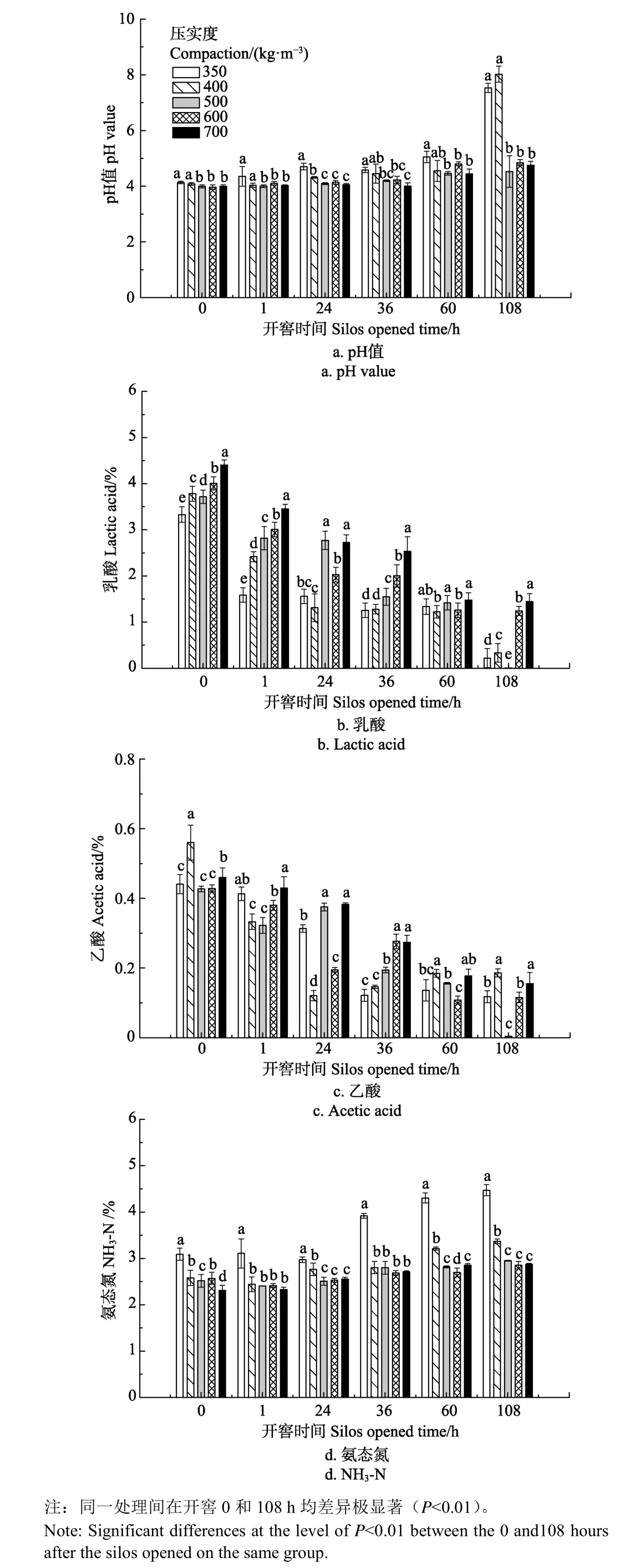
图2 开窖后不同压实度下玉米青贮pH值,乳酸,乙酸,氨态氮变化Fig.2 Change of pH value, lactic acid, acetic acid, NH3-N, of corn silage at different compaction after silos opened
各玉米青贮压实度乳酸和乙酸浓度在青贮开窖108 h后较开窖 0 h分别减少 67.2%~99.8%和 66.3%~98.8%(图2b、2c)。除开窖后24和60 h外,其余时间压实度为600和700 kg/m3处理组的乳酸浓度显著高于350 kg/m3的压实度处理17.0%~84.9%(P<0.05)。青贮压实度350 kg/m3处理的乙酸浓度分别在开窖24、36和108 h显著低于压实度为700 kg/m3的处理0.4%~2.2%(P<0.05)。开窖后各压实度玉米青贮丙酸和丁酸的浓度均低于最低检出限。
各压实度处理组NH3-N浓度在开窖后108 h较开窖0 h时增加了11.1%~44.8 %(图2d)。其中350 kg/m3压实度处理的玉米青贮NH3-N浓度在开窖后显著高于500、600和700 kg/m3的压实度处理14.1%~37.4%(P<0.05)。除开窖0和60 h外其余时间500、600和700 kg/m3的压实度处理间差异不显著(P>0.05)。
2.4 压实度及开窖时间对玉米青贮品质的交互作用
除WSC浓度外,开窖时间对其余指标均产生极显著影响(P<0.01,表3),不同的青贮压实度对所有指标均产生极显著影响(P<0.01),从表3中可知开窖时间与压实度的交互作用对CP、ADF和WSC浓度变化无显著影响(P>0.05),但对其余指标均产生极显著影响(P<0.01)。
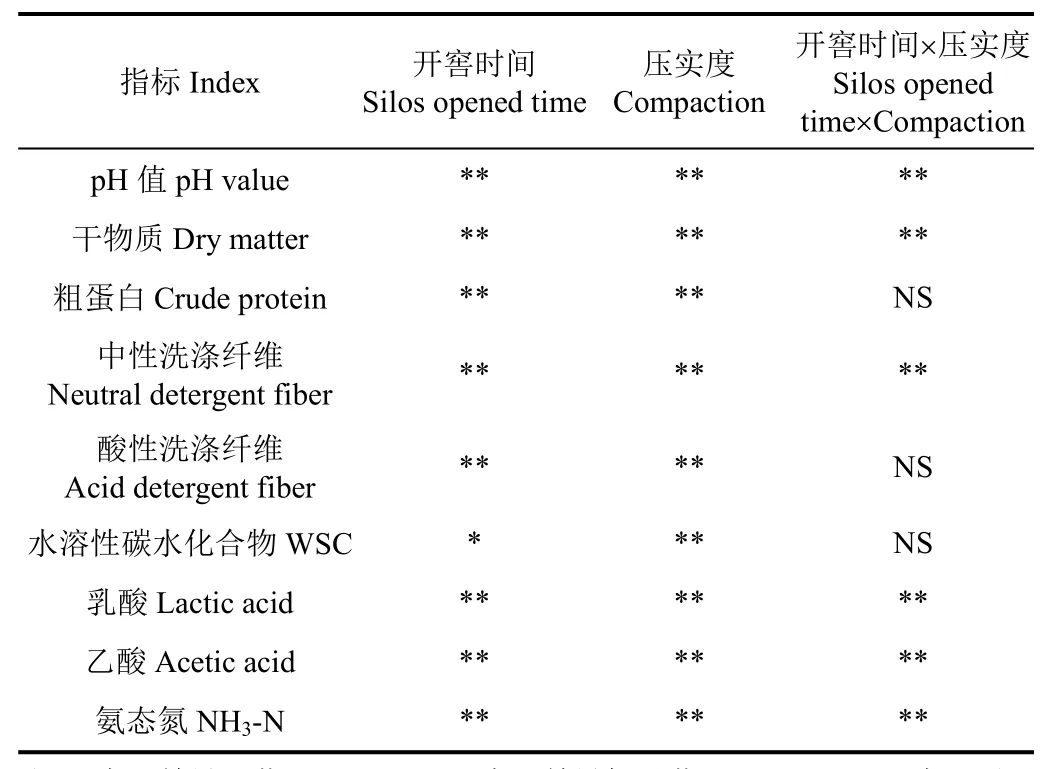
表3 开窖后玉米青贮品质双因素方差分析Table 3 Double factor variance analysis on quality of corn silage after silos opened
2.5 开窖时间、压实度和发酵温度与营养、发酵品质间的多元线性回归分析
将开窖时间(x1)、压实度(x2)和青贮温度(x3)同营养、发酵品质(y)进行多元线性回归分析(表4)。结果表明,除乙酸浓度与开窖时间、压实度和发酵温度间的多元线性回归模型不显著外(P>0.05),其余指标多元线性回归模型显著性极强(P<0.01),并且模型拟合度达到76.8%~92.3%,R2达到0.590~0.853。其中,CP浓度与开窖时间、压实度和发酵温度间的多元线性回归模型拟合度和R2最高,即可用该模型进行92.3%的预测。对确定的模型进行了基于实测数据的有效性分析,结果表明:除乙酸外其余指标多元回归模型计算值与实测值误差在0.281~1.321。其中CP浓度与开窖时间、压实度和发酵温度间的多元线性回归模型误差最小,具有较高实用性。
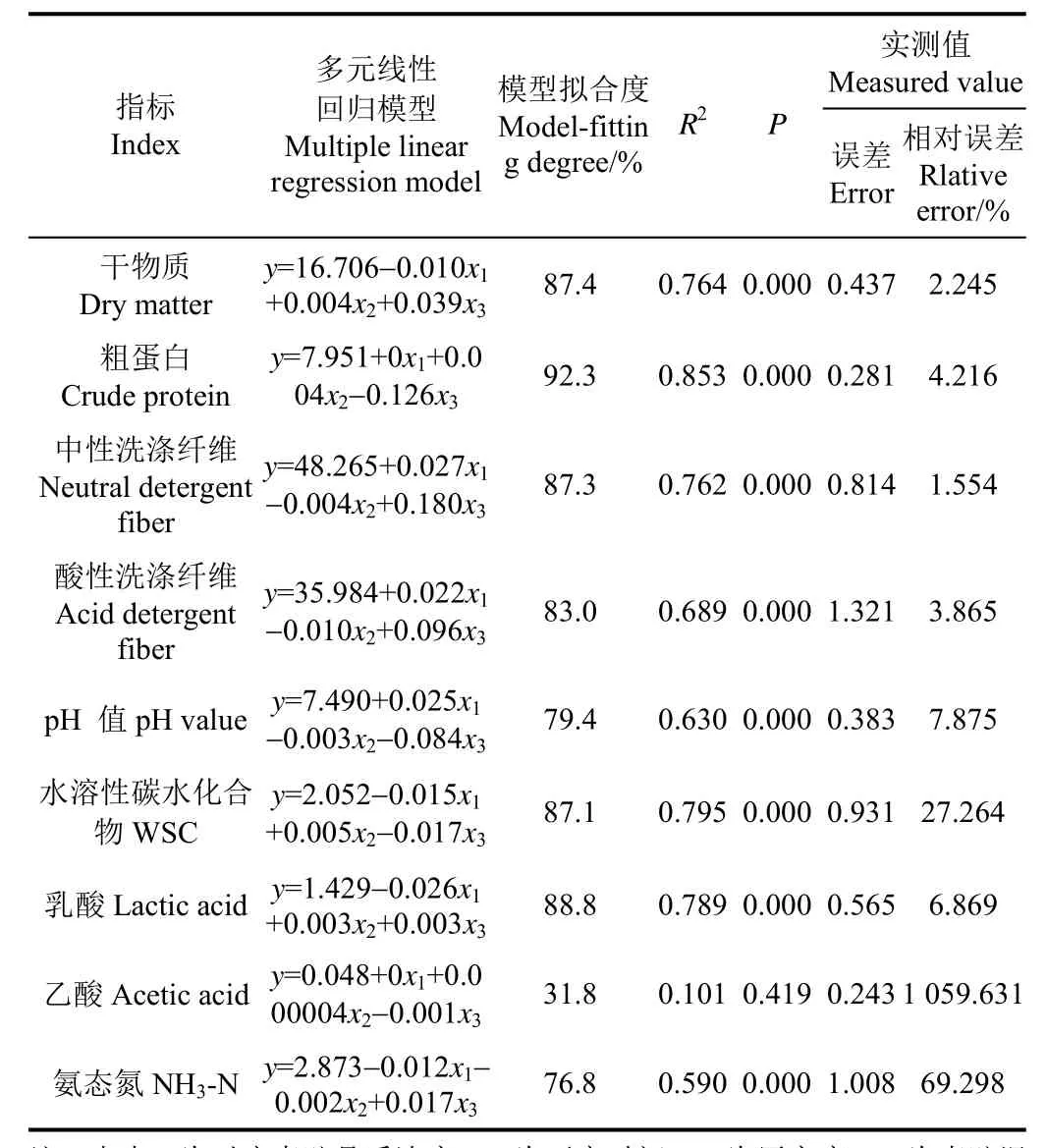
表4 开窖后玉米青贮品质与开窖时间、压实度和发酵温度间的多元线性回归分析Table 4 Multiple linear regression analysis between silage quality and silos opened time, compaction, and silage temperature after silos opened
3 讨 论
3.1 压实度对玉米青贮有氧稳定性的影响
青贮开窖后,好氧微生物的活动性增强,其利用青贮发酵底物产生水、CO2和热量[3],即开窖后青贮温度随开窖时间延长而上升。而高压实度的青贮提供相对稳定的pH值环境,更好的抑制腐败菌的生长[12]。开窖后,高压实度的玉米青贮可有效的阻止氧气的渗入[13],减缓开窖后大量好氧微生物的活动,减缓青贮温度的上升时间,有效提高青贮有氧稳定性。本研究证明所设置的青贮压实度有效提高玉米青贮的有氧稳定性。但压实度600 kg/m3处理其有氧稳定性优于700 kg/m3处理,可能是压实度过高造成青贮发酵液也多引起的[14],汁液中含有大量的碳水化合物被微生物利用,使各类微生物活动性增强。同时,开窖后700 kg/m3压实度下的玉米青贮乳酸浓度始终最高,刺激酵母菌的增殖[15],导致青贮温度较600 kg/m3处理有所提高。
3.2 压实度对玉米营养青贮品质的影响
伴随着青贮的开窖,玉米青贮 DM 逐步减少[16]。本研究中将营养品质与开窖时间、青贮压实度以及开窖后青贮温度进行多元回归分析,证明DM、CP和WSC浓度与上述三者呈显著的多元线性回归关系,该关系可满足87.1~92.3%的预测。开窖时间的延长,增加了青贮中氧气的浓度,提高各类腐败微生物的代谢,青贮温度在一定程度上有所提高。好氧微生物在开窖初期有氧条件下活动性增强,分解蛋白质产生 NH3-N,同时消耗利用大量WSC和乳酸,继而青贮DM浓度损失较高[17]。为降低青贮饲料开窖后的损失,提高青贮饲料压实度可以显著减少有氧的恶化,高压实度创造低孔隙度,从而减少氧气扩散进入青贮饲料[18],腐败微生物的活性降低,营养物质的损失减少。WSC浓度在青贮开窖后减少,归咎于微生物在有氧暴露后的代谢增加造成 DM的损失[19]。压实度的增加利于提高WSC浓度,开窖初期乳酸菌利用WSC产生乳酸、乙酸,维持了pH值的稳定[20],抑制好氧微生物对WSC的分解,因此可减少对WSC的消耗量。但随着有氧暴露时间的延长,氧气不断渗入,好氧微生物逐步占据优势地位,活跃的活动分解大量的WSC[3]。
NDF及ADF在青贮开窖后其浓度逐步增加[17],在开窖初期细胞呼吸作用以及随开窖时间的增加,青贮温度的升高促进酶的水解,可能引起部分WSC的分解,造成不消化成分浓度的相对增加,其中,WSC发酵转化为CO2,这种以气体的形式损失的DM以一定比例增加了纤维的浓度[21]。本研究中发现青贮压实度通过减少消化成分浓度的相对损失量,有利于降低NDF和ADF的浓度。结合开窖时间与开窖后青贮的温度建立的多元回归方程可对87.3%和83.0%的预测进行分析。说明开窖时间、压实度以及开窖后青贮温度对NDF及ADF浓度具有显著影响。
3.3 压实度对玉米青贮发酵品质的影响
青贮发酵过程中,乳酸菌通过将WSC转化为有机酸降低pH值使得青贮得以保存[14]。pH值的快速下降是青贮饲料发酵过程中最重要的因素[22],以避免增加腐败微生物的数量,pH值的下降反映了乳酸的浓度[23]。同样,在开窖后 pH值体现了青贮是否保存较好及其被腐败菌分解的程度。随着开窖时间的延长青贮的pH值会出现缓慢回升[24]。好氧微生物利用乳酸和乙酸的代谢增强,直接导致pH值升高,引发其他好氧微生物的增殖,这与开窖后青贮温度升高有关[25]。青贮温度升高归因于饲料压实不足[26]。本研究表明,压实度的增加可适度提高乳酸、乙酸浓度,降低pH值。较高青贮压实度对乳酸的产生具有积极的影响[27],最终可提高青贮品质[28]。利用青贮开窖时间、压实度以及开窖后青贮温度与乳酸和pH值进行多元回归分析得到88.8%和79.4%的预测,可用于该模型。而本研究中乙酸的多元线性回归模型不显著(P>0.05),可能是由于开窖后乙酸的含量并未随压实度的增加产生明显的变化规律,影响回归模型建立。
NH3-N浓度是评价青贮饲料品质的一个重要指标,通过多元回归分析发现,随着开窖时间的延长和青贮压实度的增加以及青贮温度的增加可显著影响NH3-N浓度变化,呈极显著的多元回归关系(P<0.01),可满足76.8%的预测。一般来说,NH3-N浓度反映了蛋白质和氨基酸的降解程度;动物对其利用价值较低,在青贮饲料中其浓度与青贮饲料的品质呈负相关[29]。青贮开窖后,由于不良微生物的活动,氨基酸被分解成氨、硫化氢和胺类,降解率增大[3],使得NH3-N浓度增加[30]。高压实度青贮减弱氧气渗入,减缓腐败微生物分解青贮中的氨基酸、含氮盐类等物质产生 NH3-N[3]。蛋白分解酶的活性随着pH值的升高而升高,并且,温度的提升也增加了蛋白酶的活性。
4 结 论
通过增加青贮压实度,可改善开窖后青贮营养、发酵品质,提高有氧稳定性。紧实度为600 kg/m3的玉米青贮发酵品质及有氧稳定性最好,建议600 kg/m3为全株玉米最佳青贮紧实度。青贮开窖时间、压实度以及开窖后青贮温度与营养及发酵指标的多元线性回归模型的拟合度在76.8%~92.3%,干物质、粗蛋白、中性洗涤纤维、酸性洗涤纤维、水溶性碳水化合物和乳酸浓度的回归模型预测均达到80%以上,其中CP浓度多元线性回归模型拟合度和R2(0.853)最高,对该模型进行了基于实测数据的有效性分析表明计算值与实测值误差最低(0.281)。建立的多元线性回归模型可进行青贮品质的预测,同时最佳青贮紧实度的确定为生产实践提供参考。
[参考文献]
[1] González P M L, Chiacchiera S M, Rosa C A, et al.Comparative analysis of the mycobiota and mycotoxins contaminating corn trench silos and silo bags[J]. Journal of the Science of Food & Agriculture, 2011, 91(8): 1474-1481.
[2] 贾春旺,原现军,肖慎华,等. 青稞秸秆替代苇状羊茅对全混合日粮青贮早期发酵品质及有氧稳定性的影响[J].草业学报,2016,25(4):179-187.Jia Chunwang, Yuan Xianjun, Xiao Shenhua, et al. Effect of substituting hulless barley straw for tall fescue on early fermentation quality and aerobic stability of mixed-ration silage in Tibet[J]. Acta Prataculturae Sinica, 2016, 25(4): 179-187. (in Chinese with English abstract)
[3] 徐春城. 现代青贮理论与技术[M]. 北京:科学出版社,2013.Xu Chuncheng. Silage Science and Technology[M]. Bcijing:Scicnce Press, 2013. (in Chinese with English abstract)
[4] Shao T, Wang T, Shimojo M, et al. Effect of ensiling density on fermentation quality of guineagrass (Panicum maximum Jacq.) silage during the early stage of ensiling[J]. Asian Australasian Journal of Animal Sciences, 2005, 18(18): 1273-1278.
[5] Graf K, Ulrich A, Idler C, et al. Bacterial community dynamics during ensiling of perennial ryegrass at two compaction levels monitored by terminal restriction fragment length polymorphism[J]. Journal of Applied Microbiology,2016, 120(6): 1479-1491.
[6] Franco R T, Buffière P, Bayard R. Ensiling for biogas production: Critical parameters. A review[J]. Biomass &Bioenergy, 2016, 94: 94-104.
[7] Kleinschmit D H, Schmidt R J, Kung L J. The effects of various antifungal additives on the fermentation and aerobic stability of corn silage[J]. Journal of Dairy Science, 2005,88(6): 2130-2139.
[8] Gallo A, Giuberti G, Bruschi S, et al. Use of principal factor analysis to generate a corn silage fermentative quality index to rank well or poorly preserved forages[J]. Journal of the Science of Food and Agriculture, 2016, 96(5): 1686-1696.
[9] 蒋慧,方雷,周小玲,等. 添加初花期骆驼刺改善苜蓿青贮品质[J]. 农业工程学报,2014,30(17):328-335.Jiang Hui, Fang Lei, Zhou Xiaoling, et al. Improve alfalfa silage quality by adding alhagi sparsifolia shap in initial bloom stage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014,30(17): 328-335. (in Chinese with English abstract)
[10] 张丽英. 饲料分析及饲料质量检测技术[M]. 北京: 中国农业出版社,2002.
[11] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[12] Gerlach K, Büscher W, Südekum K H, et al. Aerobic exposure of grass silages and its impact on dry matter intake and preference by goats[J]. Small Ruminant Research, 2014,117(2-3): 131-141.
[13] Sun Y, Buescher W, Lin J, et al. An improved penetrometer technique for determining bale density[J]. Biosystems Engineering, 2010, 105(2): 273-277.
[14] Zhang Q, Li X, Zhao M, et al. Lactic acid bacteria strains for enhancing the fermentation quality and aerobic stability of Leymus chinensis silage[J]. Grass & Forage Science, 2016,71(3): 472-481.
[15] Taylor C C, Jr L K. The effect of Lactobacillus buchneri 40788 on the fermentation and aerobic stability of high moisture corn in laboratory silos [J]. Journal of Dairy Science,2002, 85(6): 1526-1532.
[16] Queiroz O C M, Arriola K G, Daniel J L P, et al. Effects of 8 chemical and bacterial additives on the quality of corn silage[J]. Journal of Dairy Science, 2013, 96(9): 5836-5843.[17] Tabacco E, Righi F, Quarantelli A, et al. Dry matter and nutritional losses during aerobic deterioration of corn and sorghum silages as influenced by different lactic acid bacteria inocula[J]. Journal of Dairy Science, 2011, 94(3): 1409-1419.
[18] Wambacq E, Vanhoutte I, Audenaert K, et al. Occurrence,prevention and remediation of toxigenic fungi and mycotoxins in silage: A review [J]. Journal of the Science of Food and Agriculture, 2016, 96(7): 2284-2302.
[19] Santos A O, Ávila CL, Pinto J C, et al. Fermentative profile and bacterial diversity of corn silages inoculated with new tropical lactic acid bacteria[J]. Journal of Applied Microbiology, 2016, 120(2): 266-279.
[20] 任海伟,王聪,窦俊伟,等. 玉米秸秆与废弃白菜的混合青贮品质及产沼气能力分析[J]. 农业工程学报,2016,32(12):187-194.Ren Haiwei, Wang Cong, Dou Junwei, et al. Mixed ensiling quality of maize straw with waste cabbage and biogas production potential analysis[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(12): 187-194. (in Chinese with English abstract)
[21] Ávila C L S, Pinto J C, Sugawara M S, et al. Effect of addition of a bacteria isolated from sugarcane silage on the quality of the silage[J]. Acta Scientiarum Animal Sciences,2008, 30(3): 255-261.
[22] 刘晶晶,高丽娟,师建芳,等. 乳酸菌复合系和植物乳杆菌提高柳枝稷青贮效果[J]. 农业工程学报,2015,31(9):295-302.Liu Jingjing, Gao Lijuan, Shi Jianfang, et al. Lactic acid bacteria community and Lactobacillus Plantarum improving silaging effect of switchgrass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(9): 295-302. (in Chinese with English abstract)
[23] Dogi C A, Pellegrino M, Poloni V, et al. Efficacy of corn silage inoculants on the fermentation quality under farm conditions and their influence on Aspergillus parasitucus, A.flavus and A. fumigatus determined by q-PCR[J]. Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment, 2015, 32(2): 229-235.
[24] Shi J. Effects of different bacterial inoculants on the fermentation and aerobic stability of whole-plant corn silage[J]. African Journal of Agricultural Research, 2012,7(2): 164-169.
[25] Canibe N, N.B. Kristensen, Jensen B B, et al. Impact of silage additives on aerobic stability and characteristics of high-moisture maize during exposure to air, and on fermented liquid feed[J]. Journal of Applied Microbiology, 2014, 116(4):747-760.
[26] Yildiz, C, Ozturk, I, Erkmen, Y. Effects of chopping length and compaction values on the feed qualities of sunflower silage[J]. Scientific Research & Essays, 2010, 5(15): 2051-2054.
[27] Zheng Y, Yu C, Cheng Y S, et al. Integrating sugar beet pulp storage, hydrolysis and fermentation for fuel ethanol production[J]. Applied Energy, 2012, 93(5): 168-175.
[28] Zheng Y, Yu C, Cheng Y S, et al. Effects of ensilage on storage and enzymatic degradability of sugar beet pulp[J].Bioresource Technology, 2011, 102(2): 1489-1495.
[29] Hashemzadeh-Cigari F, Khorvash M, Ghorbani G R, et al.Interactive effects of molasses by homofermentative and heterofermentative inoculants on fermentation quality,nitrogen fractionation, nutritive value and aerobic stability of wilted alfalfa (Medicago sativa L) silage[J]. Journal of Animal Physiology & Animal Nutrition, 2013, 98(2): 290-299.
[30] Schmidt R J, Hu W, Mills J A, et al. The development of lactic acid bacteria and Lactobacillus buchneri and their effects on the fermentation of alfalfa silage[J]. Journal of Dairy Science, 2009, 92(10): 5005-5010.
