L-苯丙氨酸调控tyrP启动子强度的研究
2018-04-13赵胜刘永飞廉政刘燕霏通信作者张大伟通信作者
赵胜,刘永飞,廉政,刘燕霏,通信作者,张大伟,通信作者
L-苯丙氨酸调控启动子强度的研究
赵胜1,刘永飞2,廉政2,刘燕霏1,通信作者,张大伟2,通信作者
(1. 天津农学院 动物科学与动物医学学院,天津 300384;2. 中国科学院 天津工业生物技术研究所,天津 300380)
TyrR是大肠埃希氏菌(简称)芳香族氨基酸生物合成和运输途径中的一种全局性调控蛋白,控制着包括在内的8个转录单元的转录。将基因启动子的两个RNAP(RNA聚合酶)结合位点进行定点突变来影响TyrR对的介导活化,并且TyrR与L-苯丙氨酸(L-Phe)结合极大地增强了RNAP对下游结合位点(启动子)的结合亲和力,因此可用L-Phe来调控启动子强度进而调控转录水平。本文以构建L-Phe高产菌株为最终目的,对启动子进行突变并用以构建L-Phe生物传感器,使启动子强度转变为可测量的荧光值,再使用L-Phe调控该传感器,影响启动子强度。最终发现突变后的启动子强度发生不同程度的改变,并且用L-Phe调控后,在一定浓度范围内,随着L-Phe浓度的升高启动子强度也在一定范围内增强。这将有利于筛选出受调控的优质启动子,并为改造代谢路径及高产L-Phe菌株构建有重要意义。
TyrR;;L-Phe;生物传感器;启动子强度
L-Phe属于芳香族氨基酸,是人体内必需的八大氨基酸之一,在日常生活中用途广泛[1]。其生产方法主要有酶法和微生物发酵法,后者因其具有原料廉价易得、环境污染小、产物纯度高等特点在工业生产中广泛运用[2]。现今,微生物发酵法主要是大肠杆菌高产菌株的工业发酵,高产菌株可以通过分子操作获得。在大肠杆菌的代谢途径中,TyrR是一种芳香族氨基酸合成代谢中的全局性调控蛋白质,控制着8个转录单元的转录[3]。的转录也受到TyrR的介导。前期研究中已经证明,TyrR在苯丙氨酸存在下通过刺激开放复合物的形成开始激活转录,并且对+3启动子进行一系列单一突变后,发现这种激活机制依然存在[4]。这一切都足以说明苯丙氨酸可以调控启动子的强度。而启动子强度可以用生物传感器的技术来测试。
生物传感器是一项涵盖着生物、化学、物理、医学等众多领域的高新技术[5]。它由分子识别部分和信号转换部分构成[6],前者能特异性识别信号并传递给后者,后者将信号定量转变为方便识别的信号,以达到对目标物的定性、定量检测。而代谢物生物传感器更是在高产目标化合物菌株的高通量筛选和微生物胞内代谢动态调控研究中应用广泛[7]。pSenly是Lothar Eggeling(Germany)赠予本实验室的用于构建L-Phe生物传感器的一种质粒,该生物传感器能将的表达水平转变为黄色荧光信号[8]。构建L-Phe生物传感器(pSen-tyrP),是将R基因、前200个核苷酸和突变的启动子连接到pSenly中。突变启动子本体表达水平及调控后表达水平将由pSen-tyrP转变为可检测的黄色荧光,这样可以挑选出受调控影响较大的启动子,以进行高产L-Phe菌株的构建。
1 材料与方法
1.1 材料
试剂主要有购自Omega Bio-Tek公司的DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒以及纯化试剂盒,Thermo公司的DNA聚合酶、限制性内切酶、DNA连接酶,Solarbio公司的抗生素、L-PHE二肽,以及实验室已有的DH5α感受态细胞、LB培养基等。
1.2 方法
1.2.1 引物设计
启动子的突变是在+3的基础上,通过+35、-10区以及D盒2三个区域单个突变位点的组合,图1为文献已知的启动子单个基因突变[4]。将突变位点设计在PCR扩增引物上,以扩增出组合突变的启动子。设计的突变启动子引物详见表1。

图1 tyrP+3启动子的突变

表1 设计的突变启动子引物
注:小写字母为突变后的碱基
1.2.2 DNA片段扩增
利用PCR技术对所需要的目的片段进行扩增。进行PCR时采用50 μL体系,见表2,扩增片段见表3。
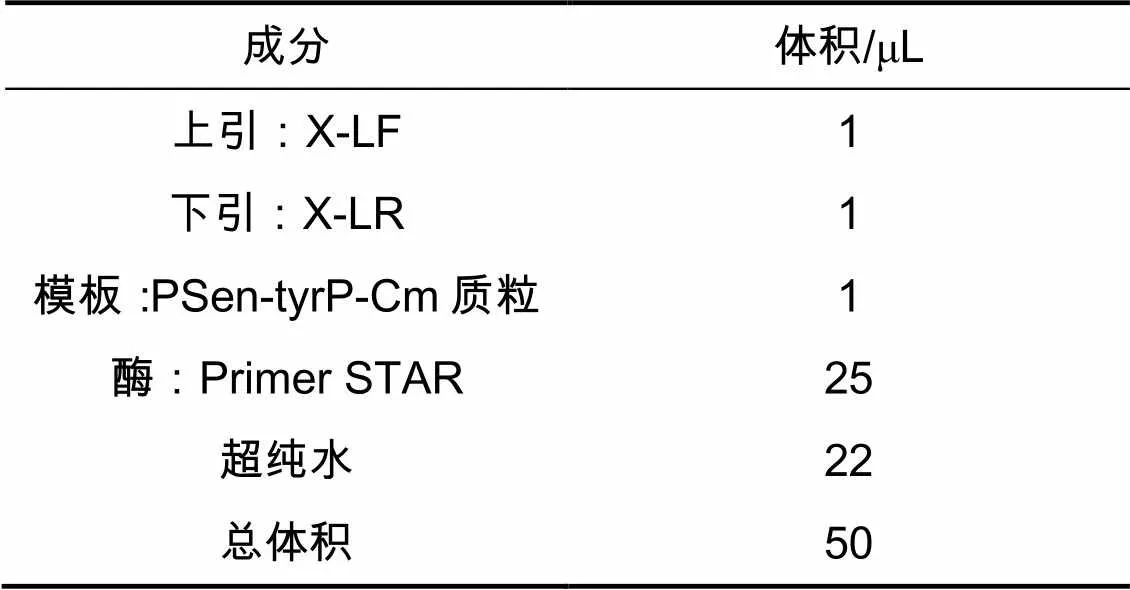
表2 PCR体系构成
注:X代表引物的具体名称
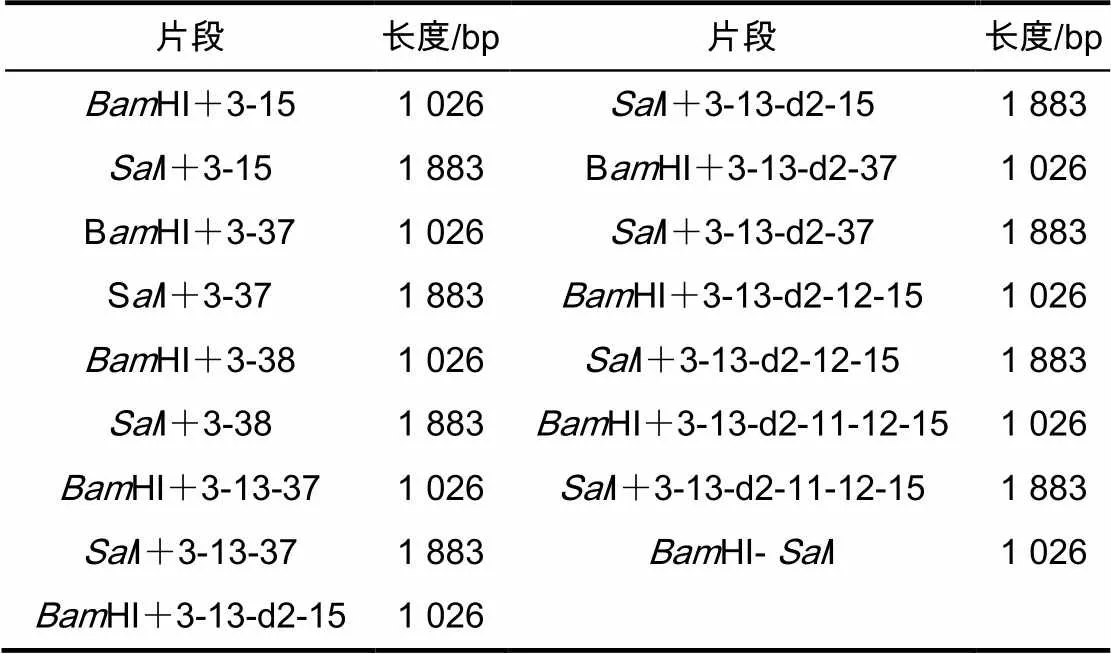
表3 PCR扩增片段及长度
注:一对引物能合成一条片段。例如,pSen-EYFP-HⅠ-LF与PSen-tyrP+3-15-LR扩增出HⅠ+3-15片段;PSen-tyrP+3-15-LF与pSen-EYFP-Ⅰ-LR扩增出Ⅰ+3-15片段;pSen-EYFP -Ⅰ-LF与pSen-EYFP-HⅠ-LR扩增出H-Ⅰ片段,这3个片段就能组装成为PSen-tyrP+3-15质粒
1.2.3 核酸电泳及胶回收
目的片段扩增完成后,将PCR产物进行核酸电泳,来判断是否扩增出目的片段,若有则进行胶回收。按照Gel Extrction Kit(200)试剂盒对电泳的目的片段进行回收。回收片段测完浓度做好标记后-20 ℃保存。
1.2.4 重叠延伸PCR
用重叠延伸PCR(SOE PCR)技术将HⅠ-X与Ⅰ-X进行连接。具体操作参照文献[9-10]。
1.2.5 酶切连接
构建sinsor质粒是用酶切连接的方法将HⅠ-X-Ⅰ与HⅠ-Ⅰ两个大片段连接成环状。将HⅠ-X-Ⅰ与HⅠ-Ⅰ两个大片段进行酶切,酶切后按照cycle-pure Kit(200)试剂盒方法进行纯化。纯化后的酶切连接操作均按照Thermo FD 相关酶的说明书进行。图2为连接后的质粒图谱。
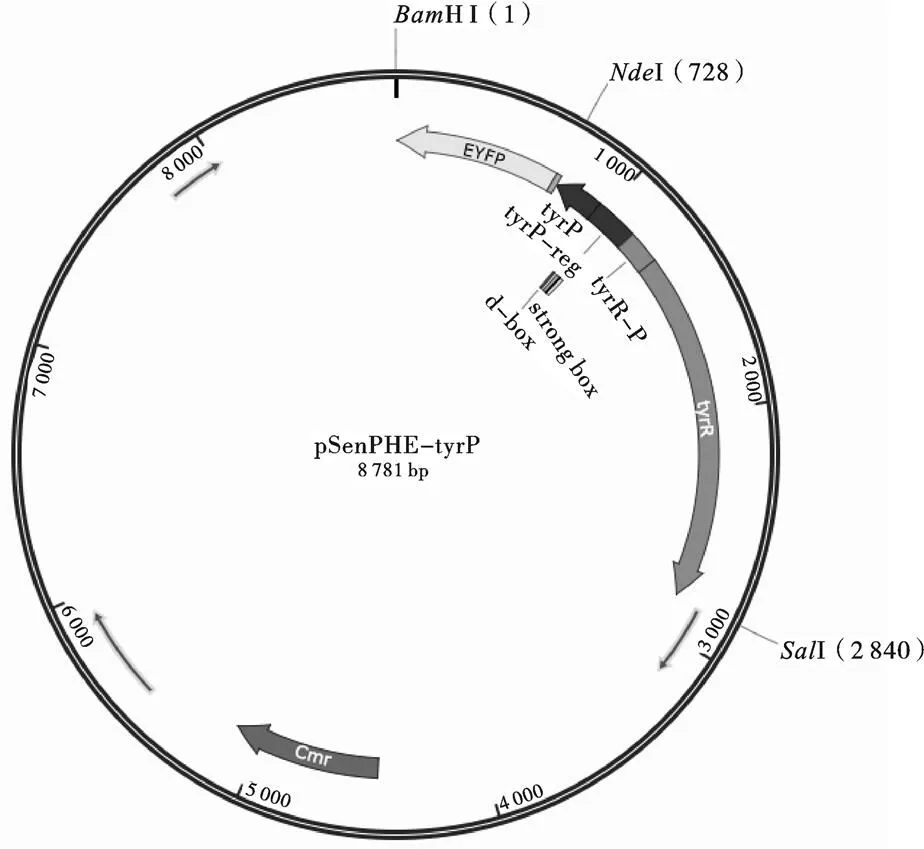
图2 pSenPHE-tyrP质粒图谱图
1.2.6 化学转化及阳性验证
为验证是否连接成功,将连接后的体系用化学转化的方法转入DH5α感受态中进行初步抗性筛选。化学转化方法参照文献[11]。经过初步筛选的菌株可用菌落PCR验证,再次筛选以除去突变的假阳性。PCR完成后进行电泳,若片段长度为2 000~2 100 bp则证明连接阳性。
1.2.7 提取质粒及测序
将阳性验证正确的单菌落接种到5 mL带Cm抗性的液体LB中,在37 ℃摇床上过夜培养,第二天进行提取质粒并保存菌液以留作备用。吸取质粒5 μL,上下验证引物各10 μL,标上名称并且填好测序单后送去测序,测序引物见表4。将验证正确的质粒以及提取该质粒保存的菌液留下,不正确的质粒、菌液弃去。
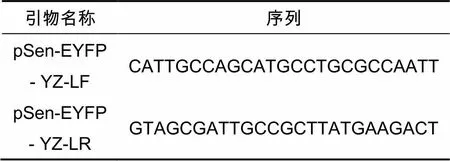
表4 测序引物
1.3 流式细胞仪检测元件起始荧光强度
将质粒对应的菌液在含有Cm抗性的平板上三级划线,过夜培养后挑取单菌落接种到5 mL液体LB培养基中,并放入37 ℃摇床过夜培养;第二天以该菌液接种LB液体培养至菌液光密度(OD)到0.5~0.7,将菌液取出并且放入1.5 mL的EP管5 000 r/min 离心3 min,弃上清。将离心后的沉淀用预冷的1×PBS重悬,之后5 000 r/min 离心3 min以除去残留的LB液体,再加入500 μL预冷的1×PBS重悬沉淀;取1.5 mL EP管加入990 μL预冷的1×PBS,再加入重悬的菌液10 μL,混匀后置于冰盒上检测其荧光值。流式细胞仪检测结果见表5。
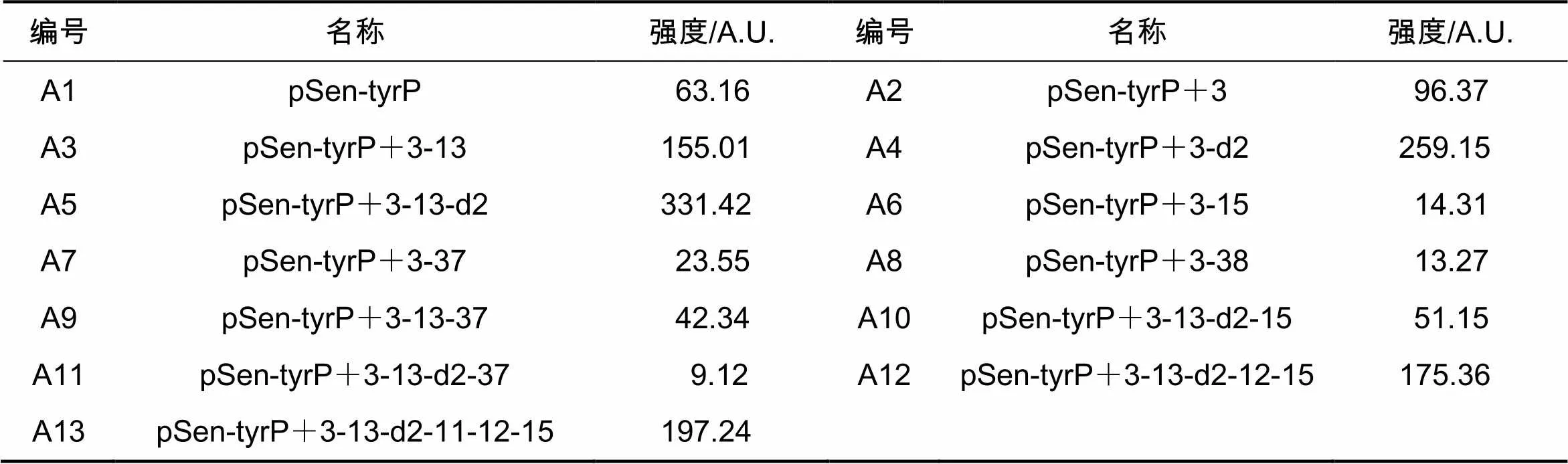
表5 突变质粒菌株初始荧光细胞流式仪检测结果
1.4 L-Phe二肽诱导后荧光强度检测
将菌株接种到5 mL LB培养基中,37 ℃摇床过夜培养,次日将过夜培养的菌液接种到无菌96孔板当中。每个菌株做6个平行,另外接6个孔用于检测OD,每个孔加入M9培养基600 μL,按照1∶50接菌(过夜培养的菌液12 μL),后用封口膜封口,37 ℃震荡培养3~5 h,震荡条件为800 r/min,相对湿度80%。从3 h开始检测OD,当OD达0.5~0.6时添加L-苯丙氨酸二肽。配制浓度为20 μg/μL苯丙氨酸二肽母液,添加苯丙氨酸二肽浓度见表6。加好后继续震荡培养并检测荧光强度。
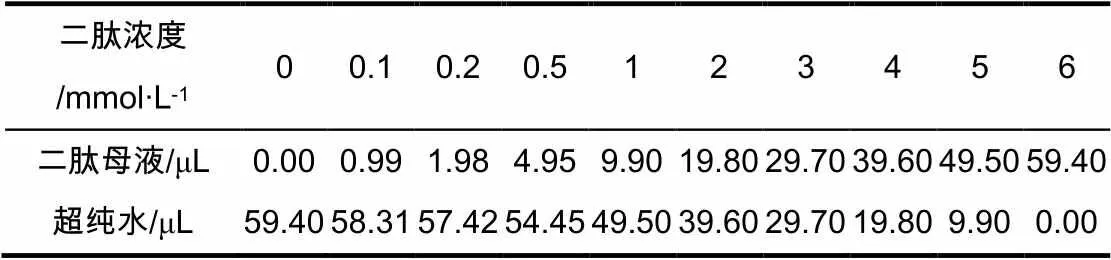
表6 苯丙氨酸二肽浓度配制表
2 结果与分析
突变质粒菌株初始荧光强度流式数据统计结果见图3。经过数据分析后发现,突变-10和-35区的-15、-37、-38位点降低转录水平,对-11、-12、-13位点以及D2区域进行突变则使转录水平增强,这也符合Yang等人的研究[4]。在+3启动子单个突变位点基础上进行的组合突变说明,增强转录的突变位点组合具有一定的叠加效果,而在增强转录的突变位点组合中引入降低转录的突变位点则有明显的抵消效果。
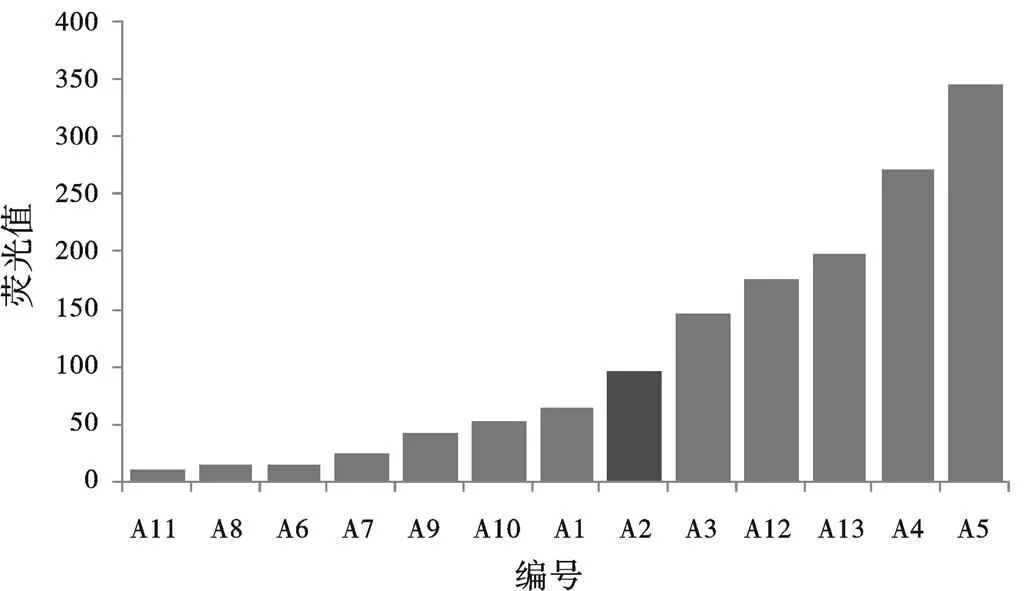
图3 突变质粒菌株初始荧光细胞流式仪统计结果
图4为添加不同浓度后pSenPHE-tyrP的流式细胞仪检测结果,经对比后可以看出,利用二肽诱导后突变的表达水平有明显的变化:-11、-12、-13位点以及D2区域这些增强转录的突变位点不管是单独还是进行组合,它们的增加趋势比未突变大;而降低转录的突变位点-37与增强转录的突变位点进行组合后没有增加趋势。当二肽浓度持续增大时,的表达均有下降的趋势。
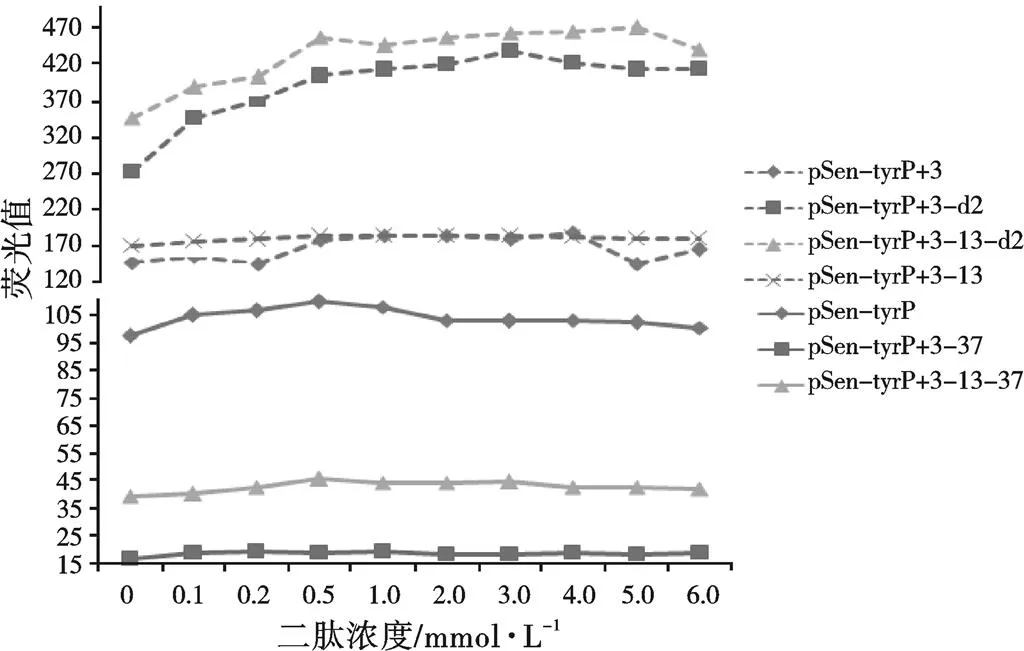
图4 L-Phe二肽诱导突变菌株荧光变化情况
3 讨论
对于pSen-tyrP质粒在未添加Phe-Phe的样品可检测的荧光值,这归因于在启动子控制下YFP的渗漏表达。启动子在L-Phe存在下被TyrR蛋白活化,且细胞外L-Phe浓度显示与细胞内L-Phe水平正相关[8]。基于这个研究,在培养基中人工添加苯丙氨酸二肽,二肽通过转运途径进入胞内后水解为L-Phe,从而改变胞内L-Phe的浓度,最终用于调控的表达。
Yang等人研究了启动子单个位点的突变对表达的影响[4],而本研究在单一突变的基础上进行多个突变位点的组合后发现,启动子强度并不仅仅是单个突变位点强度的加减,某些突变位点的组合会使启动子强度降低;用不同浓度的L-苯丙氨酸二肽进行调控后,启动子强度的提升并不是一直增强,而且到达一定限度后随着二肽浓度的增加,启动子强度反而会下降,对于这个问题,本研究认为是培养液的渗透压过高,导致细菌死亡而造成的。
4 结论
通过突变启动子,并将其与基因、前200个核苷酸连接到用于构建生物传感器的pSenlys质粒中,构建了一批pSen-tyrP质粒。对pSen-tyrP质粒测试发现,启动子的基础活性发生了不同程度的增强或减弱,再对其进行苯丙氨酸调控后发现:在一定浓度范围内,随着L-苯丙氨酸浓度的升高,启动子强度也在一定范围内增强;并且与未突变启动子相比,突变-10区的-11、-12、-13位点以及d2区域后,突变启动子活性的增强趋势较大,突变-37位点后没有增强趋势。这将有利于筛选出优质的突变启动子,为构建L-Phe高产菌株奠定了基础。
[1] 袁佩佩,曹伟佳,王震,等. 大肠杆菌产L-PHE发酵调控及代谢通量分析[J]. 中国生物工程杂志,2015,35(3):25-34.
[2] 周海岩.L-PHE生产菌株的构建、代谢调控和发酵条件优化[D]. 无锡:江南大学,2011.
[3] 商量,范长胜,金瑞良,等. 大肠杆菌基因剔除及其对苯丙氨酸生物合成的影响[J]. 生物化学与生物物理学报,2003,35(8):728-733.
[4] Yang J,Hwang J S,Camakaris H,et al. Mode of action of the TyrR protein:repression and activation of thepromoter of[J]. Molecular Microbiology, 2004,52(1):243-256.
[5] 马莉萍,毛斌,刘斌,等. 生物传感器的应用现状与发展趋势[J]. 传感器与微系统,2009,28(4):1-4.
[6] 孔扬. 浅论生物传感器的发展与国内产业现状[J]. 现代经济信息,2016(20):345.
[7] 周益康,吴亦楠,王天民,等. 代谢物生物传感器:微生物细胞工厂构建中的合成生物学工具[J]. 生物技术通报,2017,33(1):1-11.
[8] Liu Y F,Zhuang Y Y,Ding D Q,et al. Biosensor-based evolution and elucidation of a biosynthetic pathway in[J]. ACS SyntheticBiology,2017,6(5):837-848.
[9] 徐芳,姚泉洪,熊爱生,等. 重叠延伸PCR技术及其在基因工程上的应用[J]. 分子植物育种,2006(5):747-750.
[10] 魏薇,李凡,陈海如. 利用重叠延伸PCR技术扩增长片段DNA[J]. 云南大学学报(自然科学版),2008,30(S1):86-88.
[11] 李明才,何韶衡. 一种高效、快速的大肠杆菌感受态细胞制备及质粒转化方法[J]. 汕头大学医学院学报,2005,18(4):228-230.
责任编辑:张爱婷
Study onpromoter strength regulated by L-Phenylalanine
ZHAO Sheng1, LIU Yong-fei2, LIAN Zheng2, LIU Yan-fei1,Corresponding Author, ZHANG Da-wei2,Corresponding Author
(1. College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China; 2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Science, Tianjin 300380, China)
TyrR is a global regulatory protein in the amino acid biosynthesis and transport pathway of(), which controls the transcription of eight transcriptional units, including. Mutation of TyrR towas induced by site-directed mutagenesis of two RNAP(RNA polymerase)binding sites of thegene promoter, and the combination of TyrR and L-phenylalanine(L-Phe)greatly enhanced RNAP binding affinity on the downstream binding site(promoter), so we can use L-Phe to control the promoter strength and then regulate the transcription level. In order to construct the L-Phe biosensor, thepromoter was transformed into a measurable fluorescence value, and thepromoter was used to construct the L-Phe biosensor. The intensity ofpromoter was controlled by L-Phe, and the intensity ofpromoter was changed. The intensity ofpromoter was changed in different degrees, and after L-Phe regulation,promoter intensity is also increased within a certain range with the concentration of L-Pheincreased. This is of great significance for the metabolic pathway of L-Phe production in E. coli, and it provides a new method for the construction of higher yield L-Phe strain.
TyrR;; L-Phenylalanine; biosensor; promoter intensity
Q815
A
1008-5394(2018)01-0049-05
10.19640/j.cnki.jtau.2018.01.011
2017-04-16
天津市科技支撑计划重点项目(11ZCZDSY08600)
赵胜(1995-),男,本科在读,研究方向:微生物代谢。E-mail:zhaosheng355287@163.com。
刘燕霏(1970-),女,副教授,硕士,研究方向:预防兽医学。E-mail:674383573@qq.com。张大伟(1978-),男,研究员,博士,研究方向:微生物代谢。E-mail:zhang _dw@tib.cas.cn。
