pH对淡水小球藻叶绿素荧光参数及生长的影响
2018-04-13薄香兰刘兴柴英辉窦勇高金伟贾旭颖周文礼
薄香兰,刘兴,柴英辉,窦勇,高金伟,贾旭颖,周文礼
pH对淡水小球藻叶绿素荧光参数及生长的影响
薄香兰,刘兴,柴英辉,窦勇,高金伟,贾旭颖,周文礼通信作者
(天津农学院 水产学院 天津市水产生态及养殖重点实验室,天津 300384)
以小球藻为研究对象,研究不同pH对其叶绿素荧光、叶绿素含量和细胞密度的影响,以期找到小球藻最适生长的pH值,为小球藻的集约化培养提供基础资料。结果表明:不同pH对小球藻的叶绿素荧光、叶绿素含量和细胞密度有显著影响,pH值为9时最大光能转化速率(F/F)、实际光能转化效率()和量子效率均呈下降趋势,pH值为9时潜在活力(F/F)、相对电子转化速率、叶绿素及小球藻密度上升趋势最小,pH为7时叶绿素含量和细胞密度均高于其他实验组,其值分别为1 613.05 μg/L、1.13×107cells/mL,pH9处理组的叶绿素含量和细胞密度最低,其值为883.82 μg/L、6.77×106cells/mL。小球藻最适生长pH值为7,pH为9时会显著抑制小球藻生长。
淡水小球藻;叶绿素荧光;叶绿素含量;细胞密度;pH
小球藻()为绿藻门、绿藻纲、绿球藻目、卵孢藻科、小球藻属的单细胞藻类[1]。直径约3~5 μm,呈球形或椭圆形,具有繁殖快、分布广、营养高等特点[2]。小球藻可以增强动物免疫能力,具有促进生长、抗氧化、抗肿瘤等生理功能[3-5]。目前,小球藻已经广泛应用于动物饲料、食品添加剂、美容产品、食品开发、医药保健等领域[6]。为了开发出其巨大的应用潜力,首先要获得大量的小球藻体。因此探讨小球藻生长过程中环境因子对其产率和光能转化效率的影响至关重要。
pH是藻类生长过程中最重要影响因子之一,它通过改变环境中酸碱度和碳酸盐平衡来影响藻类生长[7]。传统的测定藻类最适pH值是通过测定在不同pH值下培养藻类的细胞密度,这种方法比较耗费时间。叶绿素荧光是一种以光合作用理论为基础,利用体内叶绿素作为天然探针,是鉴定藻类耐逆境能力的良好指标之一,具有快速、准确、简单的特点[8]。藻类体内的叶绿素荧光与光合作用过程中的各种反应密切相关,因此,可以利用叶绿素荧光变化程度来反应来确定小球藻受影响程度[9-10]。本试验利用浮游植物分类荧光仪(PHYTO-PAM WALZ)在对小球藻的一次性培养过程中,通过检测实际光能转化效率()、潜在活力(F/F)、最大光能转化速率(F/F)、相对电子转化速率()、量子效率()、叶绿素()及细胞密度,来研究不同pH值对其光合特性及生长的影响,以期为小球藻的实验室培养及大规模培养生产提供理论依据,并且为叶绿素荧光技术在确定藻类适宜pH值提供参考。
1 材料与方法
1.1 材料
试验用小球藻()来源于天津市水产生态及养殖重点实验室。
1.2 培养与实验条件
小球藻采用 BG-11 培养基在25℃的恒温培养箱中,在500 mL锥形瓶中进行,向200 mL培养基中加入初始密度为1×106cells/mL藻液200 mL,湿度为50% RH,光强为60 μmol/(m2·s),12 h∶12 h的明暗周期培养,试验设置5个pH梯度,分别为5、6、7、8、9,每个梯度设置3个平行,试验每天以盐酸(HCl)、氢氧化钠(NaOH)调控pH,每天定时摇动4次,以防小球藻细胞附壁及下沉。
1.3 试验仪器
浮游植物分类荧光仪(PHYTO-PAM WALZ),超净工作台(SW-CJ-1FD 上海博讯实业有限公司医疗设备工厂),高压蒸汽灭菌锅(HVE-50 HIRAYMA仪器制造公司),生物显微镜(E200 日本Nikon),藻类培养箱(AL-36 美国珀尔瓦西),电子天平(AS2202X2 RADWAG),pH仪(S220-K 梅特勒)。
1.4 培养基
(1)A5溶液:将2.86 g的H3BO3、1.86 g的MnCl2·4H2O、0.22 g的ZnSO4·7H2O、0.39 g的Na2MoO4·2H2O、0.08 g的CuSO4·5H2O、0.05 g的CO(NO3)2·6H2O依次溶于1 L的蒸馏水中。
(2)BG-11培养基,将1.5 g的NaNO3、0.052 g的K2HPO4×3H2O、0.075 g的MgSO4×7H2O、0.036 g的CaCl2×2H2O、0.006 g的柠檬酸、0.006 g的柠檬酸铁胺、0.001 g的EDTA-2Na、0.2 g的Na2CO3、1 mL的A5溶液依次溶于1 L的蒸馏水中。
1.5 测定方法
将处于对数期的小球藻接种到预配好的培养基中,并记录为试验的第0天,在实验的第0、2、4、6、8、10天定时取样,测定叶绿素荧光参数、叶绿素含量和藻密度。
1.5.1 叶绿素荧光参数的测定
利用浮游植物分类荧光仪(PHYTO-PAM WALZ)对叶绿素荧光各个参数进行测定,打开Phyto Win软件,先放置1 cm样品(每次体积应统一)在比色皿中暗适应15 min,启动仪器测定初始荧光产量(F),饱和脉冲后(4 000 µmol/(m2·s))测定最大荧光产量(F),以此计算出最大光能转化效率(F/F),打开预先设定好的光化学强度(3 000 µmol/(m2·s)),进行1 min的照射(仪器指示灯变绿为光化光结束),待荧光值稳定后,测定出光化学后初始荧光(F)和最大荧光(F')。Settings窗口中设置为Meas. Freq.为32,切换到Channeles窗口,点击,测出叶绿素的含量。测定的叶绿素荧光参数有F、F、F'、F'、F,并根据荧光仪提供的公式,计算出F/F、F/F、、、等荧光参数,具体公式如下:
(5)光合电子传递速率:=×DAR×0.5×0.84(μmol·e·m-2·s-1)
1.5.2 藻密度测定
小球藻密度测定通过血球计数板计数获得。
1.6 数据处理
采用SPSS 19.0进行单因素方差分析和多重比较,利用EXCEL 2007进行绘图。
2 结果与分析
2.1 pH对小球藻叶绿素荧光活性的影响
2.1.1 pH对小球藻F/F的影响
F/F代表光反应中心PS Ⅱ的最大量子产量,即最大光能转化效率。pH对小球藻的F/F影响如图1所示,所有处理组的F/F在第0天维持在1.6±0.01,随着时间增长,pH 6、pH 7处理组F/F有上升趋势,其他处理组均呈下降趋势,pH 9处理组下降速率最快,培养结束时pH 7处理组F/F最高。而pH 6处理组维持在pH 7处理组的97.18%,pH 5和pH8维持在pH 7处理组的77.46%~85.91%,pH 9处理组只有pH 7处理组的59.15%。
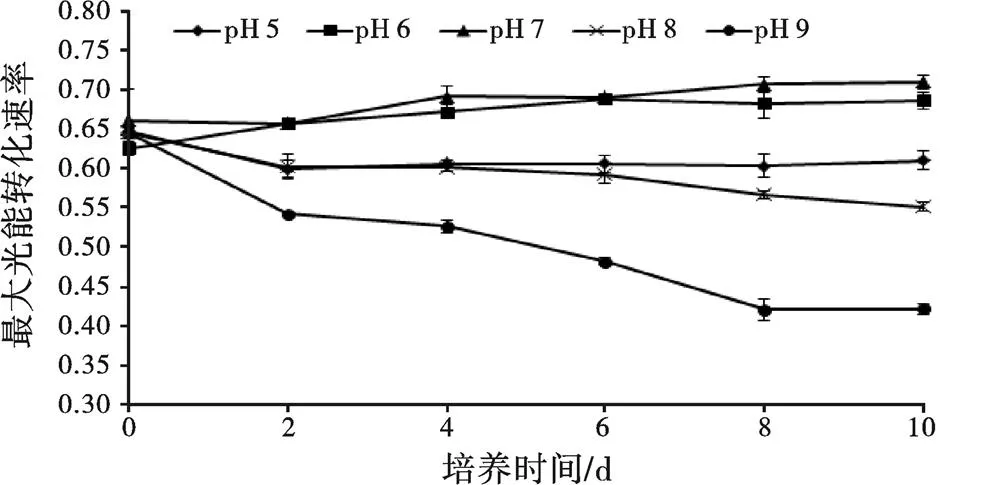
图1 不同pH对小球藻Fv/Fm的影响
2.1.2 pH对小球藻F/F的影响
F/F代表PS Ⅱ的潜在活力,pH对小球藻F/F的影响如图2所示,各组的F/F均呈增加趋势,在第10天pH 7处理组达到了最高值,同时pH 5、pH 6和 pH 8处理组维持在pH 7处理组最高值的88.89%~96.48%,pH 9维持在最高值的70.27%。
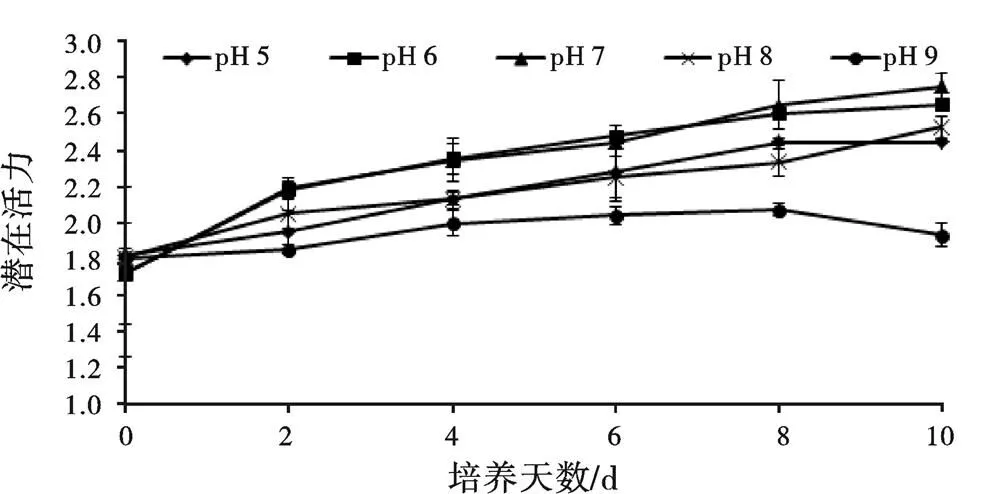
图2 不同pH对小球藻Fv/F0的影响
2.1.3 pH对小球藻的影响
是指PSⅡ的实际光能转化效率,pH对小球藻影响如图3所示,除pH 9处理组外,其他各处理组随着时间增加呈上升趋势,pH 7处理组上升较其他组快,pH 5处理组上升趋势较慢,pH 9处理组呈下降趋势,到试验第10天pH 9处理组的维持在pH 7处理组的71.74%。
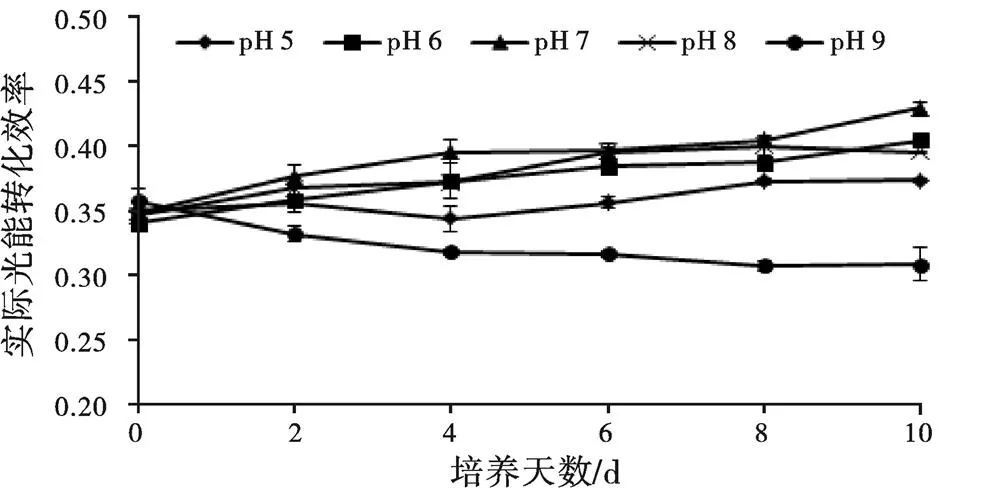
图3 不同pH对小球藻ΦPSⅡ的影响
2.1.4 pH对小球藻的影响
是指PSⅡ的量子效率,pH对小球藻影响见图4,如图所示,pH 6和 pH 7处理组的随时间增加而增加,以pH 7处理组增长速率最快,pH 5和 pH 8处理组的yield维持在0.59~0.62,pH 9处理组呈下降趋势。
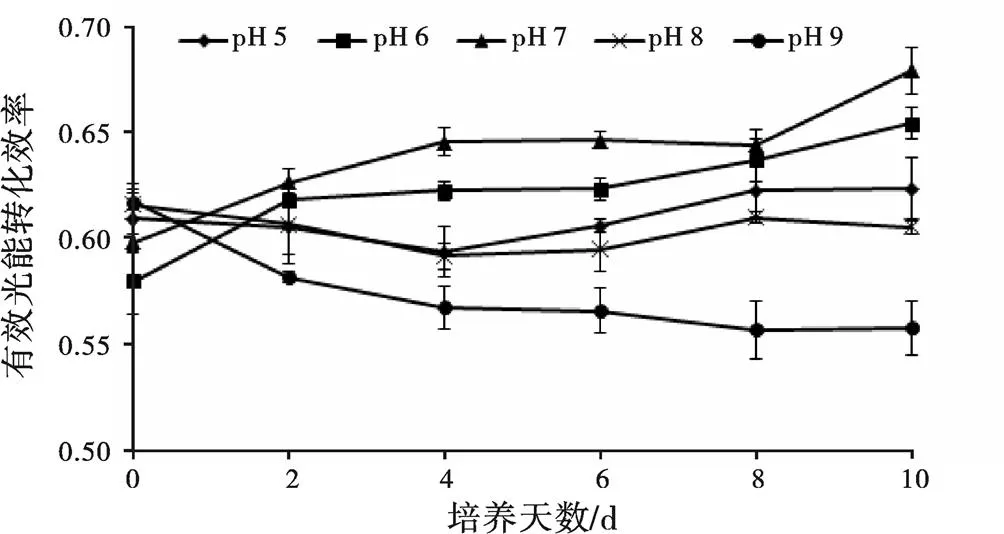
图4 不同pH对小球藻Yield的影响
2.1.5 pH对小球藻的影响
表示光反应中心PSⅡ光合电子的传递速率。pH对小球藻影响如图5所示,整个试验过程中,pH 9处理组没有变化,其他各处理组均有上升趋势。
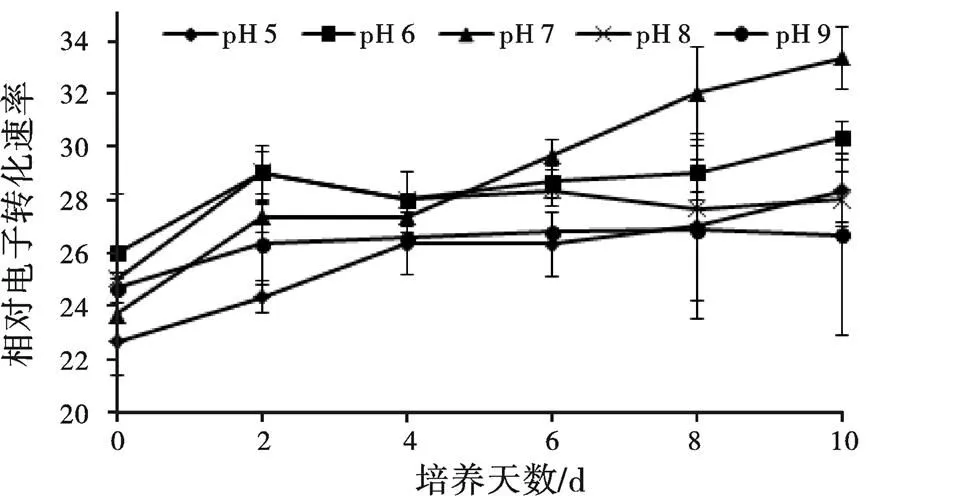
图5 不同pH对小球藻ETR的影响
2.2 pH对小球藻叶绿素含量的影响
pH对小球藻叶绿素含量的影响如图6所示,叶绿素含量均呈增加趋势,在试验第10天,pH 7处理组叶绿素值最高,达到1 613.05 μg/L,为初始密度的2.01倍,pH 6处理组叶绿素含量至培养结束时为初始时的2.19倍,pH 8 和pH 5处理组次之,至培养结束时分别为初始时的1.57倍和1.53倍,pH 9处理组增加最慢,培养结束时为初始时的1.22倍。

图6 不同pH对小球藻CHL的影响
2.3 pH对小球藻细胞密度的影响
pH对小球藻细胞密度的影响如图7所示,随着培养时间的增加,藻细胞密度均呈上升趋势,从培养的第2天开始,pH 6和pH 7处理组的藻细胞密度均显著高于其他组(<0.05),随着培养继续进行,pH 6和pH 7处理组的藻细胞密度始终显著高于pH 9处理组(<0.05),同时,pH 9处理组与其他组之间藻细胞密度差增大,在培养结束时,pH 7处理组藻细胞密度最高,为1.13×107cells/mL,是初始密度的2.76倍,pH 9处理组的藻细胞密度最低,仅有pH 7处理组的61.27%。
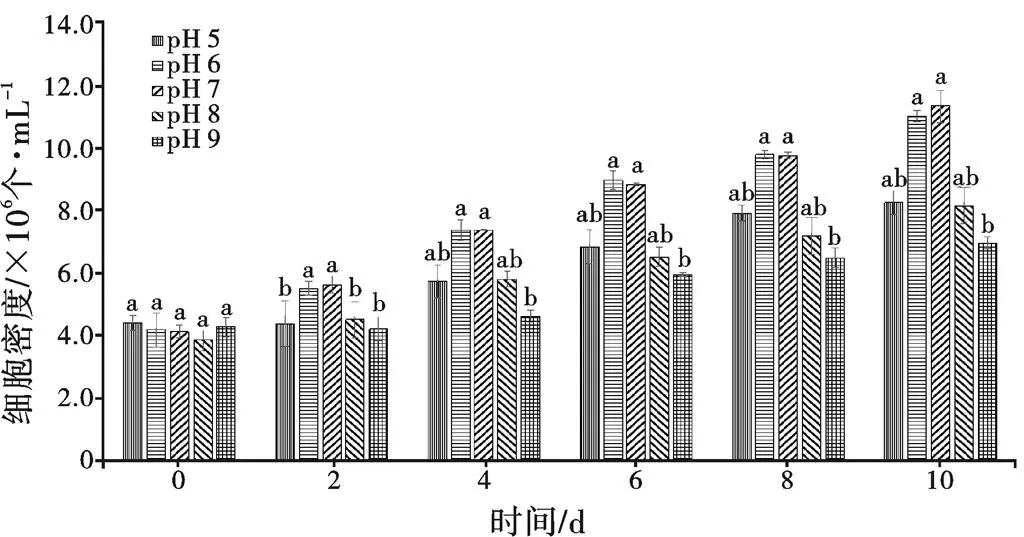
图7 不同pH对小球藻细胞密度的影响
3 讨论
3.1 pH对小球藻叶绿素荧光的影响
3.1.1 pH对小球藻F/F和F/F的影响
小球藻的光合作用会受到环境因素的影响,研究发现pH过高和过低对小球藻叶绿素荧光值均有显著影响,pH通过改变环境中酸碱度和碳酸盐平衡来影响小球藻生长[11]。F/F代表光反应中心PSⅡ的最大光能转化效率,在非胁迫条件下不会受到生长环境影响,其变化较小,当受到胁迫环境影响时,该参数会明显降低,F/F代表PSⅡ的潜在活力,其数值也受到环境胁迫影响,环境胁迫会明显降低该参数值,因此,F/F和F/F被用来判断光合作用光抑制的标准[12]。本试验结果表明,培养结束时pH 7处理组的F/F参数值最高,pH 6、pH 7处理组的F/F有上升趋势,pH 9处理组有明显的下降趋势。F/F参数下降,反映了pH过高和过低对反应中心PSⅡ具有破坏作用,当pH值为9时F/F下降,推测原因pH为9时可能会破坏小球藻光合反应中心PSⅡ,无法进行氨基酸的拼接导致蛋白合成受到限制[13]。pH值为6~7时F/F没有下降,反而有上升趋势,反映了pH值为7时不会对小球藻光合反应中心PSⅡ产生破坏作用。同样,培养结束时,各处理组的F/F均呈上升趋势,以 pH 7处理组F/F最高,pH 9处理组最低,F/F值上升反映小球藻光合反应中心PSⅡ的潜在活力强,光合作用能力较强[14]。培养结束时,pH 7处理组的F/F是初始密度的1.59倍,因此,小球藻进行光合作用的最适pH值为7。欧阳峥嵘等[11]研究表明,淡水小球藻适合在中性环境中生活。
3.1.2 pH对小球藻、和的影响
实际光能转化效率是指在光下PSⅡ反应中部分关闭时藻类光合作用实际原初捕获效率[15],大量研究表明值与环境中胁迫程度呈负相关作用,值会随着环境胁迫程度增加而减少[16-18]。指在光合作用中每吸收一个光量子,所固定CO2分子数或者释放O2的分子数[19]。是指光合作用中,受光激发推动的电子从H2O到辅酶Ⅱ(NADP+)的电子传递速率[20]。通常在藻类光合作用中,和都随着环境胁迫程度增加而减少[21-22]。本研究结果表明,pH 9处理组中的和都降低,其他组没有明显降低或者处于增加趋势,在整个培养结束时,只有pH 9处理组没有增加,明显低于其他组,到试验第10天,pH 9处理组的只有pH 7处理组的71.74%,因此,当pH增加到9时,会对小球藻光合作用的、和有抑制作用。
3.2 pH对小球藻叶绿素含量的影响
叶绿素是植物进行光合作用的主要色素之一,在光合作用和光能吸收中起主要转化作用,因此,小球藻体内的叶绿素含量与植物生长、光合作用有密切关系[23]。本试验结果表明,叶绿素含量均呈增加趋势,pH 7处理组叶绿素增长速率最快,培养结束时达到1 613.05 μg/L,为接种时的2.01倍,pH 9处理组增加最慢,培养结束时为接种时的1.22倍,当pH值为7时叶绿素含量最高,pH值为9时叶绿素产量就会下降。这与李艳红[24]研究铜绿微囊藻时得到结果类似。Saygideger等[25]和陈灿等[26]在其它藻类研究中也得到类似结果。
3.3 pH对小球藻细胞密度的影响
pH是小球藻生长过程中重要的环境因子之一,大量研究报道了pH对小球藻生长、光合作用和代谢产物的影响[27]。藻类最适生长pH值因种类不同而有所差异,高于或者低于最适生长的pH都会抑制藻类生长。如铜绿微囊藻()、水华鱼腥藻()、浮游颤藻()适宜的pH分别为9.0、8.0~9.0和7.0~8.0,斜生栅藻()、绿球藻()、雷氏衣藻()适宜的pH分别为9.0~10.0、7.0~8.0和7.0[28]。小球藻培养过程中pH不稳定,会随着藻类的生长、代谢而不断改变。以前对小球藻生长最适pH的研究大多以起始时或者终止时培养基pH为主[29-30],较少研究将培养过程中固定藻液pH,本研究通过每天用盐酸(HCl)、氢氧化钠(NaOH)调控pH,研究结果表明,在培养结束时,pH 7处理组藻细胞密度最高,为1.13´107cells/mL,pH为6和7时小球藻密度明显高于其他组,当pH固定到9时,小球藻生长效果最差,藻密度只有6.77´106cells/mL。张虎等[29]研究固定小球藻液pH为6~7时,生长速率最快,pH为7~8时生物质产量最高,与本研究结果相符。刘加慧等[31]通过模型优化和验证试验,得出在温度为26.7 ℃、盐度为25.5‰和 pH 为7.3时,小球藻的生长速率达到最大值 0.69,与本试验结果接近。
4 结论
pH通过影响小球藻的光合作用强度来影响小球藻的生长发育。研究结果表明,pH 7处理组的F/F、F/F、、、、和细胞密度均高于其他处理组,用叶绿素荧光技术来确定藻类适宜生长指标可行。
[1] 王英娟,贺敬,李壮,等. 光密度法测定蛋白核小球藻生物量[J]. 西北大学学报(自然科学版),2012,42(1):60-63.
[2] 袁静,刘树深,王丽娟,等. 蛋白核小球藻()微板毒性分析方法优化[J]. 环境科学研究,2011,24(5):553-558.
[3] Mukti N A,Sulaiman S,Saad S M,et al.exhibited antioxidant and antitumour effects against liver cancerandstudies[J]. Sains Malaysiana,2009,38(5):773-784.
[4] Wang X,Zhang X. Separation,antitumor activities,and encapsulation of polypeptide from[J]. Biotechnology Progress,2013,29(3):681–687.
[5] 汪炬,蒲含林,洪岸,等. 蛋白核小球藻提取物的抑瘤作用及对免疫功能的影响[J]. 营养学报,2004,26(2):136-138.
[6] 陈艺煊,刘晓艳,林彤,等. 蛋白核小球藻冻融破壁条件优化及对其抗氧化活性的影响[J]. 食品科技,2016,41(5):75-80.
[7] 杨勋,郝宗娣,张森,等. 营养元素和pH对若夫小球藻生长和油脂积累的影响[J]. 南方水产科学,2013,9(4):33-38.
[8] 宋丽娜,郑晓宇,顾詠洁,等. 磷浓度对海洋小球藻叶绿素荧光及生长的影响[J]. 环境污染与防治,2010,32(8):20-24,50.
[9] 梁英,冯力霞,尹翠玲,等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景[J]. 海洋科学,2007,31(1):71-76.
[10] 王通明,陈伟,潘文杰,等. 有机肥和化肥对烟叶气体交换、叶绿素荧光特性及叶绿体超微结构的影响[J]. 植物营养与肥料学报,2015,21(2):517-526.
[11] 欧阳峥嵘,温小斌,耿亚红,等. 光照强度、温度、pH、盐度对小球藻()光合作用的影响[J]. 武汉植物学研究,2010,28(1):49-55.
[12] 吕士如. 基于藻类叶绿素荧光动力学曲线的水质监测系统的设计[D]. 重庆:重庆大学,2014.
[13] Geider R J,Roche J L,Greene R M,et al. Response of the photosynthetic apparatus of phaeodactylum tricornutum(bacillariophyceae)to nitrate,phosphate,or iron starvation[J]. Journal of Phycology,1993,29(6):755-766.
[14] You Y,Yuan Z L,Zhang X Y,et al. Effect of plant hormoneo on/and/ofleaves[J]. Henan Science,2007,35(19):5698-5701.
[15] Maxwell K,Johnson G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany,2000,51(345):659-668.
[16] 高方胜,王磊,徐坤. 土壤相对含水量对不同茬口番茄叶片PSⅡ光化学活性和光能分配影响[J]. 核农学报,2017,31(5):1005-1013.
[17] 易军,杨国涛,张玲,等. 稻瘟病菌对水稻PSⅡ的影响研究[J]. 云南大学学报(自然科学版),2015,37(3):452-459.
[18] Yan K,Chen N,Qu Y. Tobacco transformed with sweet pepper sensealleviates PSⅡphotoinhibition under high temperature stress[J]. Scientia Agricultura Sinica,2007,40(11):2468-2473.
[19] Li C,Liu K. Analysis of photosynthesis efficiency of maize hybrids with different yield in the later growth stage[J]. Acta Agronomica Sinica,2002,28(3):379-383.
[20] 曹春晖,孙世春,王学魁,等. 锰浓度对米氏凯伦藻叶绿素荧光特性及生长的影响[J]. 生态学报,2010,30(19):5280-5288.
[21] Li T L,Xie Y H,Hong J P,et al. Effects of nitrogen application rate on photosynthetic characteristics, yield, and nitrogen utilization in rainfed winter wheat in southern Shanxi[J]. Acta Agronomica Sinica2013,39(4):704.
[22] 王寿兵,徐紫然,马小雪,等. Cu2+对铜绿微囊藻生长及叶绿素荧光主要参数的影响研究[J]. 中国环境科学,2016,36(12):3759-3765.
[23] 陈刚,龙茜,李谢颖,等. 不同pH值对金鱼藻光合作用及叶绿素荧光特性的影响[J]. 扬州大学学报(农业与生命科学版),2015,36(1):65-71.
[24] 李艳红. 环境因子对铜绿微囊藻生长和光合作用的影响[D]. 南昌:南昌大学,2010.
[25] Saygideger S,Dogan M,Keser G. Effect of lead and pH on lead uptake,chlorophyll and nitrogen content ofL. andL. [J]. International Journal of Agriculture & Biology,2004,6(1):168-172.
[26] 陈灿,龚艳,李研,等. 不同光强下pH对伊乐藻光合机能的影响[J]. 湖南林业科技,2009,36(1):15-17.
[27] 张虎,张桂艳,温小斌,等. pH对小球藻. XQ-200419光合作用、生长和产油的影响[J]. 水生生物学报,2014,38(6):1084-1091.
[28] 许海,刘兆普,袁兰,等. pH对几种淡水藻类生长的影响[J]. 环境科学与技术,2009,32(1):27-30.
[29] Yang X,Hao Z,Zhang S,et al. Effects of trophic elements and pH on growth rate and lipid productivity of[J]. South China Fisheries Science,2013,9(4):33-38.
[30] 王翠,李环,王钦琪,等. pH值对沼液培养的普通小球藻生长及油含量积累的影响[J]. 生物工程学报,2010,26(8):1074-1079.
[31] 刘加慧,杨洪帅,王辉. 温度、盐度和pH对小球藻生长率的联合效应[J]. 水生生物学报,2014(3):446-453.
责任编辑:张爱婷
Effects of pH on chlorophyll fluorescence parameters and growth of
BO Xiang-lan, LIU Xing, CHAI Ying-hui, DOU Yong, GAO Jin-wei, JIA Xu-ying, ZHOU Wen-liCorresponding Author
(Tianjin Key Lab of Aqua-Ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300384, China)
To determine the optimum pH conditions and provide basic information for intensive production of, the effects of different pH values on chlorophyll fluorescence, chlorophyll content and cell density during its culture process have been studied. The results show that when pH is 9 the maximum energy conversion rate(/), the actual photochemical efficiency()and the quantum efficiency()decreased; meanwhile, the potential energy(F/F), relative electronic conversion rate(), chlorophyll content()and the density ofincreasing trend was minimum. When pH is 7, chlorophyll fluorescence are higher than the other groups with the values 1 613.05 µg/L, 1.13×107cells/mL respectively. The chlorophyll content and cell density of pH 9 treatment group were 883.82 µg/L and 6.77´106cells/mL. The optimum growth pH ofis 7, and pH 9 can obviously inhibit the growth of.
; chlorophyll fluorescence; chlorophyll content; cell density; pH
Q945
A
1008-5394(2018)01-0038-06
10.19640/j.cnki.jtau.2018.01.009
2017-09-20
天津市水产产业技术体系创新团队项目(ITTFRS2017005);天津市科技重大专项与工程项目(15ZXBFNC00120);卫星海洋环境动力学国家重点实验室开放基金项目(SOED1419);农业部南海渔业资源开发利用重点实验室开放基金项目(FREU2015-04);天津农学院科学研究计划项目(2013NO8)
薄香兰(1993-),女,硕士在读,主要从事微藻资源化利用和水生态学研究。E-mail:1065817937@qq.com。
周文礼(1969-),男,研究员,博士,主要从事微藻资源化利用与生态学研究。E-mail:saz0908@126.com。
