氮限制下链状亚历山大藻DMSP合成与生理变化的研究❋
2018-04-13商二磊隋正红
商二磊, 隋正红, 刘 源, 米 萍, 阙 州
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
二甲基巯基丙酸内盐 (Dimethylsulfoniopropionate, DMSP) 是一种重要的生源硫化物,也是海洋生态系统中有机硫的重要组成部分[1-2]。海洋藻类、细菌、珊瑚和一些高等植物均能生物合成DMSP[3-8]。一些细菌和藻类产生的裂解酶能将DMSP裂解成二甲基硫(Dimethylsulfide, DMS)[9-11]。DMS是海水中含量丰富的还原态生源硫化物[12],当海水中的DMS达到高度饱和状态时,其通过海气交换进入大气,参与全球的硫循环。在大气中,DMS能氧化成非海盐硫酸盐和甲磺酸,这些氧化产物可参与云凝结核的形成,增加云的覆盖度,进而改变太阳对地球的辐射,最终影响地球的热平衡[13]。海洋中的DMSP有着重要的生态意义,且对硫的生物地球化学循环有着重要的影响[14]。另外,研究发现,DMSP在浮游植物中具有抗氧化、作为甲基供体、渗透压调节、冷冻保护和保持细胞代谢平衡等多种功能[15-18]。
营养条件对海洋浮游植物的生长和新陈代谢过程起着至关重要的作用,也是影响DMSP合成的重要因素之一。目前已经研究的主要包括氮、磷、硅和铁元素对海藻产DMSP的影响,但氮元素的影响更为显著[19]。作为浮游植物生长必须的一种元素,N是生物机体有机大分子如核酸和蛋白质的重要组成元素,其缺乏将限制海洋初级生产力[20]。氮元素浓度影响海藻DMSP的产生,Wilson等通过围隔实验发现,氮元素限制能引起藻细胞DMSP产量显著增加[21]。Keller等研究发现,颗石藻(Emilianianuleyi) 在氮元素充足的条件下,细胞DMSP含量显著下调[22];Kettles等对海链藻(Thalassiosirapseudonana)的研究发现,氮元素的限制能显著增加藻细胞内DMSP含量[23],Bucciarelli等在研究中也发现氮限制能引起海链藻中DMSP产量增加[19]。
甲藻是一类具有鞭毛和甲板的浮游植物,是海洋生态系统中初级生产力的重要贡献者[24]。链状亚历山大藻(Alexandriumcatenella)是引发中国近岸赤潮的种类之一,由其引起的赤潮也广泛分布于世界各海域。链状亚历山大藻能产生麻痹性贝毒,可被贝类积累,通过食物链最终影响人类的健康[25]。
作为一种重要的硫化物,有关DMSP功能的研究主要集中在硅藻上,而甲藻中相关研究却是十分匮乏的。本文报告了氮限制的链状亚历山大藻细胞的生理状态和DMSP产生之间的关系,探究DMSP在链状亚历山大藻中的功能,为进一步揭示DMSP在赤潮生消中的作用奠定基础。另外,甲藻中以甲硫氨酸为起始物合成DMSP过程中相关基因的研究还未见报道,Kocsis和Rhodes等研究发现铜胺氧化酶(Copper amine oxidase)类可能是植物中参与DMSP合成的一个特异的关键酶[26-27]。我们从链状亚历山大藻的转录组(SRX368254)的注释结果中检索到功能注释为铜胺氧化酶的两条unigene基因,分别命名为cad-1(登录号KY930889)和cad-2(登录号KY930890),研究其基因表达与DMSP产量的关系,为甲藻中DMSP合成相关途径的构建提供一定的参考。
1 材料和方法
1.1 材料的培养
链状亚历山大藻,保存于中国海洋大学藻种室。在无菌的f/2培养基中培养,温度(20±1)℃,光暗周期为12 h/12 h,光照强度为30 μmol·m-2·s-1 [28]。将培养至对数期的链状亚历山大藻进行同步化处理[29],随后将处理过的藻细胞以6×106cells/L的密度接种至无菌的f/2培养基和氮限制的f/2培养基(NaNO3的终浓度是正常的f/2培养基的1/20)中,在如上条件下培养,分别于培养后的第1、3、5、7和9天取样,以正常f/2培养基为对照组。
1.2 实验方法
1.2.1 细胞浓度和体积的测定 将鲁哥氏液加到取样藻液中,使其终浓度为2%。吸取样品到Sedgewick-Rafter S52 计数板中(取样前摇匀样品),在Olympus BX53显微镜下计数[30]。用移液器吸取20 μL鲁哥氏液固定的藻液至载玻片上,将载玻片置于Nikon eclipese 80i显微镜下,用NIS-Elements软件随机测量50个细胞的大小,然后根据公式将线性长度转化为藻细胞的体积[31]。
1.2.2 活性氧(ROS)含量的测定 使用活性氧测定试剂盒(南京建成公司)测定细胞中ROS水平。具体步骤如下:收集1×106个藻细胞于干净的EP管中,向其中加入DCFH-DA(2, 7-dichlorofuorescin diacetate),使其终浓度为15 μmol/L,混匀后将其置于37 ℃条件下处理30 min。将EP管在1 000 r/min转速下离心10 min,弃去上清,再用PBS缓冲液重悬藻细胞,重复3次,最后将藻细胞置于荧光酶标仪中检测荧光强度,其中荧光酶标仪的激发波长为485 nm,发射波长为530 nm,以单位细胞的荧光值表示ROS含量[32]。
1.2.3 光合能力的测定 根据Maxwell等的方法[33],用Dual-PAM-100叶绿素荧光仪测定藻细胞的光合能力。通过离心收集约5×106个藻细胞先在室温(20 ℃)下暗适应10 min,打开测量光,由测量光激发细胞叶绿素的本底荧光(Original fluorescence, Fo),加以记录。然后打开饱和脉冲光,荧光快速上升到最大值,获取最大荧光(Maximum fluorescence, Fm),光系统Ⅱ的最大光合作用量子产量反映了植物潜在的最大光合能力,根据公式Fv/Fm= (Fm-Fo)/Fm计算获得。光系统Ⅱ的实际量子产量反映了植物的实际光合能力,根据公式Y(Ⅱ) = (Fm’-F)/Fm’计算得出,其中Fm’是测量光适应状态下的最大荧光。
1.2.4 DMSP浓度的测定 总DMSP的测定是在pH≥13的条件下将DMSP裂解成DMS,通过测定DMS含量间接求得DMSP含量。使用气相色谱法测定DMS含量[34],步骤为:将100 μL的50%的硫酸加入10 mL的藻细胞样品中,对其进行固定,黑暗条件下,室温放置24 h。取处理过的样品2 mL于10 mL样品瓶中,向其中加入200 μL的10 mol·L-1KOH,迅速封闭瓶口,黑暗条件下室温放置24 h后测定。测定过程分为吹扫-冷凝富集和加热解析2个阶段,具体为用40 mL/min的高纯氮气吹扫,吹出的DMS通过含无水CaCl2的干燥管干燥后,在浸于液氮的捕集管中富集3 min,然后将捕集管放入热水浴(>90 ℃)中加热解析,通过载气将DMS气体送入装有火焰光度检测器的GC-2014气相色谱仪(SHIMADZU, 日本)中进行测定分析。根据总DMSP/藻细胞总体积的方式计算细胞DMSP的浓度[35]。
1.2.5 荧光定量PCR 使用RNAiso Plus试剂盒(TaKaRa)提取链状亚历山大藻细胞的总RNA,用DNase I(TaKaRa)消化DNA后,电泳检测RNA的完整性,用Nano Drop 2000检测其浓度和质量,选取质量合格的RNA用反转录试剂盒(TaKaRa)制备cDNA。使用荧光定量PCR技术检测目的基因的表达水平。所用引物见表1,cad-1和cad-2基因荧光定量PCR的扩增引物分别为qp-cad-1S/qp-cad-1A和qp-cad-2S/qp-cad-2A,gapdh和actin为内参基因,扩增引物分别为gapdhS/gapdhA和actinS/actinA。实验前作标准曲线和溶解曲线,防止对荧光定量PCR过程造成干扰。使用SYBR I试剂盒(Roche)在Light Cycler®480ⅡPCR荧光定量仪上进行扩增,扩增体系为20 μL,其中cDNA 1 μL,SYBR I 10 μL,正反引物的终浓度为0.5 μmol/L,剩余体积用无菌ddH2O补充,每个样品设置3个生物学重复和3个技术重复。反应程序为95 ℃ 5 min,1个循环;95 ℃ 10 s,60 ℃ 10 s,72 ℃ 20 s,40个循环。基因的相对表达量用2-ΔΔCT法[36]进行计算。

表1 荧光定量PCR使用的引物信息Table 1 The information of primers used in quantitative real-time PCR
1.2.6 数据分析 本实验中每组处理均设置3个平行样,实验数值以平均值±标准差的形式表示。使用统计分析软件SPSS 21.0对实验数据进行单因素方差分析(One-way ANOVA),显著性差异水平P= 0.05; 使用SPSS21.0软件进行双变量相关性分析(Pearson),显著性差异水平P= 0.05。
2 实验结果
2.1 藻细胞浓度的变化
藻细胞的浓度随时间的变化见图1。对照组中细胞浓度随着培养时间的延长而快速增加,第9天达到最大值为(1.87±0.04×107) cells/L。氮限制组中细胞浓度缓慢增加,于第7天达到最大值为(1.04±0.03×107)cells/L,然后下降,第9天细胞浓度降至(0.92±0.02×107)cells/L。统计学分析发现,从第1~9天,氮限制组细胞浓度均显著性低于对照组(P<0.05)。

(星号表示同一取样点的两组数据之间存在显著差异。Asterisk indicated significant differences between same sampled point.)
图1 对照组和氮限制组中链状亚历山大藻的生长曲线
Fig.1 The growth curve ofA.catenellafor control and nitrogen limitation
2.2 细胞体积的变化
细胞体积的变化见图2。统计学分析发现,在对照组中,其它取样点细胞体积相比第1天无显著变化(P>0.05)。在氮限制组中,相比第1天,细胞体积在第3天无显著变化(P>0.05),第5~9天细胞的体积显著增加(P<0.05)。相比对照组,氮限制组藻细胞体积在第1天和第3天无显著变化(P>0.05),第5~9天均显著增加(P<0.05)。结果表明,氮限制能引起链状亚历山大藻细胞体积的显著增加。

(不同字母表示同一取样点上的两组数据之间存在显著差异,星号表示同一培养基中其它取样点相对第一个取样点之间存在显著差异。Different letters indicated significant differences between control and nitrogen limited group at the same time. Asterisk indicated significant differences between other sampled point and day 1 under same nutrient condition.)
图2 对照组和氮限制组中链状亚历山大藻的细胞体积
Fig.2 Cell volume ofA.catenellafor control and nitrogen limitation
2.3 细胞内活性氧含量的变化
ROS含量变化见图3。统计学分析发现,在对照组中,相比第1天,其它取样点ROS含量无显著变化(P>0.05)。在氮限制组中,相比第1、3天ROS含量无显著变化(P>0.05),从第5~9天,藻细胞的ROS含量均显著增加(P<0.05)。相比对照组,氮限制组中第1、3天细胞的ROS未发生显著变化(P>0.05),从第5~9天,藻细胞中ROS含量均显著增加(P<0.05)。结果表明,氮限制能引起链状亚历山大藻细胞中ROS含量的显著增加。
2.4 光合作用能力的变化
藻细胞Fv/Fm和Y(Ⅱ)的变化情况分别见图4、5。统计学分析发现,在对照组中,相比第1天,其它取样点藻细胞的Fv/Fm无明显变化(P>0.05)。在氮限制组中,相比第1、3天Fv/Fm无显著变化(P>0.05),第5~9天藻细胞的Fv/Fm是显著降低的(P<0.05)。相比对照组,氮限制组细胞的Fv/Fm在第1天到第3天无显著变化(P>0.05),在第5~9天是显著降低的(P<0.05)。对照组和氮限制组的藻细胞的Y(Ⅱ)的变化情况和Fv/Fm是一致的。结果发现,氮限制下链状亚历山大藻的光和作用能力是显著降低的。
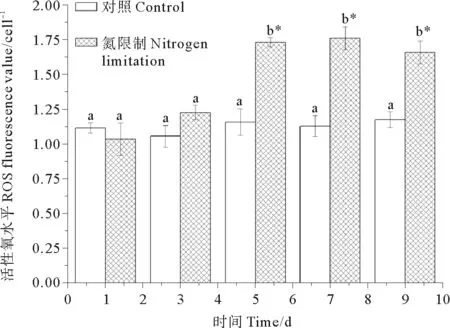
(不同字母表示同一取样点上的两组数据之间存在显著差异,星号表示同一培养基中其它取样点相对第一个取样点之间存在显著差异。Different letters indicated significant differences between control and nitrogen limited group at the same time. Asterisk indicated significant differences between other sampled point and day 1 under same nutrient condition.)
图3 对照组和氮限制组中链状亚历山大藻细胞活性氧含量
Fig.3 ROS levels ofA.catenellafor control and nitrogen limitation

(不同字母表示同一取样点上的两组数据之间存在显著差异,星号表示同一培养基中其它取样点相对第一个取样点之间存在显著差异。Different letters indicated significant differences between control and nitrogen limited group at the same time. Asterisk indicated significant differences between other sampled point and day 1 under same nutrient condition.)
图4 对照组和氮限制组中链状亚历山大藻细胞的Fv/Fm
Fig.4Fv/FmofA.catenellafor control and nitrogen limitation
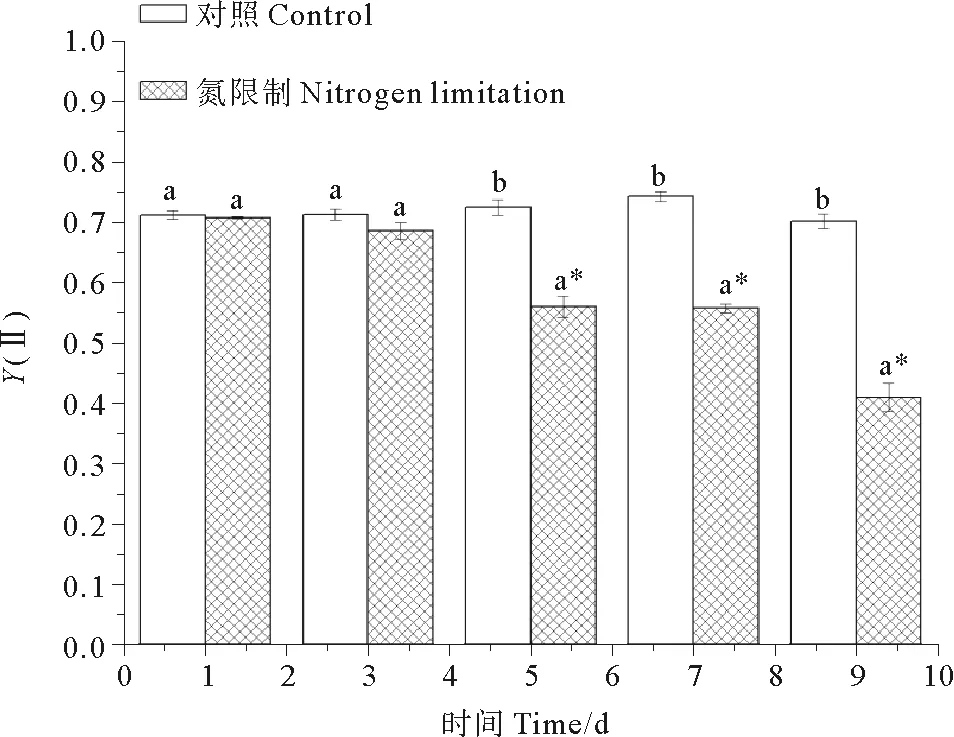
(不同字母表示同一取样点上的两组数据之间存在显著差异,星号表示同一培养基中其它取样点相对第一个取样点之间存在显著差异。Different letters indicated significant differences between control and nitrogen limited group at the same time. Asterisk indicated significant differences between other sampled point and day 1 under same nutrient condition.)
图5 对照组和氮限制组链状亚历山大藻细胞Y(Ⅱ)
Fig.5Y(II) ofA.catenellafor control and nitrogen limitation
2.5 DMSP浓度的变化
藻细胞DMSP浓度的变化见图6。统计学的分析发现,对照组中其它取样点藻细胞DMSP浓度相比第1天无显著变化(P>0.05);在氮限制组中,相比第1天,第3~9天的藻细胞的DMSP浓度均显著增加(P<0.05)。相比对照组,氮限制组中藻细胞DMSP浓度从第3~9天均显著增加(P<0.05),但在第1天较对照组无显著变化(P>0.05)。藻细胞的DMSP浓度和ROS含量的相关性分析结果显示,Pearson相关性系数r= 0.83(P<0.05),这表明二者之间具有强相关性。
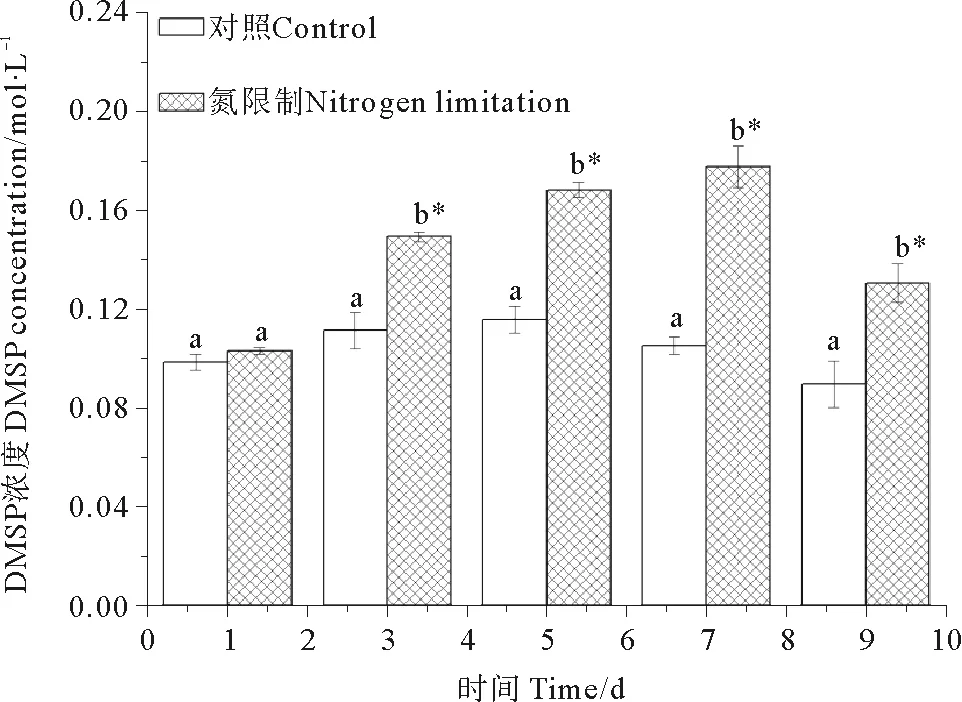
(不同字母表示同一取样点的2组数据间存在显著差异,星号表示同一培养基中其它取样点相对第一个取样点间存在显著差异。Different letters indicated significant differences between control and nitrogen limited group at the same time. Asterisk indicated significant differences between other sampled point and day 1under same nutrient condition.)
图6 对照组和氮限制组中链状亚历山大藻细胞的DMSP浓度
Fig.6 DMSP concerntration ofA.catenellafor control and nitrogen limitation
2.6 基因表达水平的变化
使用荧光定量PCR技术对cad-1和cad-2基因在氮限制的链状亚历山大藻中的相对表达量进行分析,每个取样点上以正常f/2培养基作对照,计算氮限制下基因的相对表达量。结果见图7。相比对照组,氮限制下cad-1基因在第1天时的表达量无显著变化,从第3~7天cad-1基因的表达量均显著上调,分别是对照的5.89、4.63和4.79倍,但在第9天其表达检测不到。相比对照组,氮限制下cad-2基因在第1天的表达量未发生显著变化;在第3、5天分别相比对照组上调了的19.29、19.26倍;第7、9天检测不到其表达。

(星号表示差异显著,三角形表示检测不到基因的表达。Asterisk indicate significant difference, triangle represents the expression of gene can not be monitored.)
图7 氮限制下链状亚历山大藻中基因cad-1和cad-2的相对表达量
Fig.7 Relative expressions of genecad-1andcad-2 ofA.catenellaunder nitrogen limitation
3 讨论
营养盐是影响海洋浮游植物DMSP合成的重要因素[19,37-38]。本文首次在链状亚历山大藻中检测到DMSP产生,发现该藻能产生高浓度的DMSP(浓度约在10-1mol·L-1数量级),是海洋中DMSP的高产藻。研究了氮限制对链状亚历山大藻合成DMSP的影响,结果表明,氮盐限制能显著增加链状亚历山大藻中DMSP 的合成。已有的研究也发现了氮限制能增加海洋中浮游植物DMSP的产量[23,37],如Kettles 等发现,在氮限制的条件下,海链藻(Thalassiosirapseudonana)胞内DMSP浓度显著增加[23],这与本研究的结果是一致的。
Bucciarelli等认为,硅限制引起T.pseudonana藻细胞体积显著增加是由于细胞分裂受到抑制导致的,因为硅元素是硅藻细胞壁的组成成分,硅限制导致胞壁合成受限,进而影响细胞分裂[19]。本研究结果显示,氮限制能引起链状亚历山大藻细胞体积的显著增加,与此同时,细胞数量增长缓慢,且在第9天出现下降,这表明氮限制抑制了细胞的分裂。可见细胞重要元素的缺乏可阻止浮游植物细胞的分裂,导致细胞体积增加。另外,Wang等发现,光合作用的抑制能降低细胞分裂的速度[39],在本实验中,氮限制下藻细胞的光合作用是显著降低的,这是细胞分裂受限的另一个佐证。本研究中,氮限制下藻细胞体积显著增加,藻细胞体积的增加要求其保持胞内渗透压的平衡[32],但是氮限制会导致细胞中含氮渗透压调节物质含量(甜菜碱和脯氨酸)下降,而细胞DMSP浓度在氮限制下是显著升高的。藻体中的DMSP一般以两性离子形式存在,其难以透过细胞膜,能在细胞内积累,在海洋浮游植物中具有渗透压调节功能[40]。因此推测DMSP在链状亚历山大藻中可能具有渗透压调节的作用,有利于保持藻细胞体积增大时的渗透压平衡。这进一步验证了前人有关DMSP具有渗透压调节功能的发现。
作为海洋中重要的生源硫化物,DMSP在浮游植物中具有抗氧化的作用。研究发现,DMSP及其分解产物(包括DMS、DMSO、丙烯酸盐和甲基磺酸)能与活性氧发生反应,在藻细胞中具有抗氧化的功能[17]。本研究的结果显示,氮限制能引起链状亚历山大藻细胞ROS含量显著增加,细胞DMSP浓度在此期间也是显著增加的。马金华等研究发现,链状亚历山大藻在低氮条件下,细胞中的可溶性蛋白含量显著下降,丙二醛(MDA)和H2O2含量显著增加,表明氮限制能引起细胞的氧化压力增加[41]。这与本实验中氮限制引起细胞活性氧含量增加的结果是一致的。统计学分析结果发现,藻细胞DMSP浓度和细胞ROS含量之间是高度相关的,推测DMSP在链状亚历山大藻中具有抗氧化的作用。本部分结果验证了DMSP在海洋浮游植物中具有抗氧化的功能。
氮限制能引起藻细胞活性氧含量的显著增加,是因为:第一,氮限制可导致细胞中富含氮元素的抗氧化酶(如抗坏血酸过氧化物酶)含量减少[42]。第二,氮限制会导致细胞中修复氧化损伤的酶的合成受阻[43]。第三,光合系统中参与光捕获、电子传递和CO2固定的蛋白均富含氮元素[19],氮限制能引起细胞代谢平衡被打破,从而细胞引起细胞活性氧水平的增加[19]。有研究发现,氮限制下细胞中的核酮糖-1,5-二磷酸羧化酶(Rubisco)的浓度是下降的[44],且Rubisco活性与光合作用电子传递能力的比例也是降低的[45]。本实验发现,氮限制下的藻细胞光合作用显著下降,细胞的活性氧水平显著升高,这上述观点是一致的。
Sunda等发现,CO2限制能引起海链藻的氧化压力显著增加,且DMSP含量和抗坏血酸过氧化物酶(APX)的活性均是显著增加的,Sunda等认为细胞中DMSP和APX共同发挥作用,以清除细胞中过量的活性氧,因为二者均能与活性氧发生反应[17]。本实验中,细胞活性氧含量显著增加时,DMSP浓度也是显著增加的;马金华等对链状亚历山大藻研究发现,氮限制能引起藻细胞中还原型谷胱甘肽(GSH)含量下降[41],因为当细胞处于氧化胁迫时,GSH作为抗氧化保护剂被消耗。可见当链状亚历山大藻处于氧化压力时,细胞中的抗氧化物质和DMSP都发挥着清除活性氧的功能,这与Sunda等的发现一致。
值得注意的是,氮限制的藻细胞在第3天DMSP浓度是显著增加的,而活性氧和细胞体积却未发生显著变化。这可能是因为DMSP是一种多功能的有机硫化物,其不仅具有抗氧化、渗透压调节这些功能,还在其它方面发挥作用,如保持细胞代谢平衡和作为甲基供体等,但这需要相关的研究加以证实。
赤潮是一种有害的生态现象,其发生是生物、物理和化学等多种因素共同作用的结果,不同海域的赤潮生物和影响因子也不尽相同,这是赤潮机理复杂的原因所在。本研究发现,链状亚历山大藻是一种能产生DMSP的赤潮甲藻,且DMSP在藻体中可能发挥着抗氧化和渗透压调节等抗逆功能。本研究为赤潮研究提供一个新的视角,因为DMSP作为一种多功能的有机化合物能协助浮游植物应对不良的环境胁迫,以更好的生存。
海洋浮游植物是DMSP的主要生产者,尽管高等植物和大型绿藻中有关DMSP的合成途径已进行了研究[27,46],但甲藻中与DMSP合成的基因研究还未见报道。本研究选取一个可能参与DMSP合成的关键酶——铜胺氧化酶,在氮限制下研究其基因表达与DMSP产量的关系。结果发现,氮限制下基因cad-1的相对表达量在第1天未发生显著变化,第3~7天的相对表达量显著增加,第9天检测不到。相比对照,氮限制下藻细胞DMSP浓度在第1天未发生显著变化,DMSP浓度在第3~9天均显著增加,但是第9天的DMSP浓度相比第7天出现了显著的下降。实验结果表明,第1~7天,氮限制的链状亚历山大藻中基因cad-1表达量和DMSP浓度的变化是一致的,在第9天二者不一致。测定的生理指标表明,氮限制的藻细胞在第9天已处于严重的氧化胁迫之下,cad-1基因在这种胁迫下的转录受到限制导致此时检测不到其表达;氮限制下的藻细胞第9天DMSP浓度仍显著高于对照组,可能是之前产生的DMSP未被过度消耗,因为相比第7天,第9天DMSP浓度已出现显著的降低。从第1~5天,氮限制下基因cad-2的相对表达量与cad-1是一致的,但在第7、9天,cad-2基因的表达也检测不到。实验结果表明,cad-1与cad-2基因可能都参与了链状亚历山大藻中DMSP的合成,且发挥不同的作用,这些都需要进一步的实验证实。
4 结语
本文研究了氮限制下链状亚历山大藻的细胞浓度、体积、活性氧含量、光合作用能力和DMSP含量的变化。实验结果发现,氮限制能引起链状亚历山大藻细胞DMSP浓度的显著增加,氮限制下的藻细胞处于氧化胁迫之下。相关性分析发现,细胞活性氧水平和DMSP浓度之间具有强相关关系,这表明DMSP在细胞中具有抗氧化的作用。另外,DMSP在链状亚历山大藻中可能也发挥着渗透压调节的功能。实验结果进一步验证了前人有关藻细胞中DMSP功能的发现。本文首次探究了DMSP在链状亚历山大藻中的生理功能,为甲藻中深入研究DMSP的功能提供参考;本研究首次在甲藻中探究与DMSP合成相关的基因,为甲藻中DMSP合成相关途径的构建提供一定的参考。
参考文献:
[1] Kiene R P, Linn L J, González J, et al. Dimethylsulfoniopropionate and methanethiol are important precursors of methionine and protein-sulfur in marine bacterioplankton [J]. Applied and Environmental Microbiology, 1999, 65: 4549-4558.
[2] Yoch D C. Dimethylsulfoniopropionate: Its sources, role in the marine food web, and biological degradation to dimethylsulfide [J]. Applied & Environmental Microbiology, 2000, 68: 5804-5815.
[3] Keller M D, Bellows W K, Guillard R R L. Dimethylsulfide Production in Marine Phytoplankton [M]//Saltzman E S, Cooper W J. Biogenic Sulphur in the Environment. Washington D C: American Chemical Society, 1989.
[4] Keller M D, Korjeff-Bellows W. Physiological Aspects of the Production of Dimeyhtlsulfoniopropionate (DMSP) by Marine Phytoplankton [M]//Kirst G O. New York: Biological and Environmental Chemistry of DMSP and Related Sulfonium Compounds, 1996: 131-142.
[5] Broadbent A D, Jones G B, Jones R J. DMSP in corals and benthic algae from the Great Barrier Reef Estuarine [J]. Coastal and Shelf Science, 2002, 55: 547-555.
[6] Mulholland M M, Otte M L. The effects of nitrogen supply and salinity on DMSP, glycine betaine and proline concentrations in leaves ofSpartinaanglica[J]. Aquatic Botany, 2002, 72: 193-200.
[7] Broadbent A D, Jones G B. DMS and DMSP in mucus ropes, coral mucus, surface films and sediment pore waters from coral reefs in the Great Barrier Reef [J]. Marine and Freshwater Research, 2004, 55: 849-855.
[8] Todd J, Curson A, Chan Y, et al. Dimethylsulphoniopropionate biosynthesis in marine bacteria and identification of the key gene in this process [J]. Nature Microbiology, 2017, 2: 17009.
[9] Cantoni Gá, Anderson D G. Enzymatic cleavage of dimethylpropiothetin byPolysiphonialanosa[J]. Journal of Biological Chemistry, 1956, 222: 171-177.
[10] Ledyard K M, Dacey J W. Dimethylsulfide production from dimethylsulfoniopropionate by a marine bacterium [J]. Marine Ecology-Progress Series, 1994, 110: 95-95.
[11] Steinke M, Wolfe G V, Kirst G O. Partial characterisation of dimethylsulfoniopropionate (DMSP) lyase isozymes in 6 strains ofEmilianiahuxleyi[J]. Marine Ecology Progress Series, 1998, 175: 215-225.
[12] 杨桂朋, 景伟文, 陆小兰. 海洋中DMSP的研究进展 [J]. 中国海洋大学学报(自然科学版), 2004, 34: 854-860.
YANG Gui-peng, JING Wei-wen, LU Xiao-lan. Recent progress in the study of oceanic dimethylsulfoniopropionate [J]. Periodical of Ocean University of China, 2004, 34(5): 854-860.
[13] Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate [J]. Nature, 1987, 326: 655-661.
[14] Simó R. Production of atmospheric sulfur by oceanic plankton: biogeochemical, ecological and evolutionary links [J]. Trends in Ecology & Evolution, 2001, 16: 287-294.
[15] Ishida Y. Physiological Studies on Evolution of Dimethyl Sulfide from Unicellular Marine Algae [D]. Kyoto University, 1969.
[16] Kirst G O, Thiel C, Wolff H, et al. Dimethylsulfoniopropionate (DMSP) in icealgae and its possible biological role [J]. Marine Chemistry, 1991, 35: 381-388.
[17] Sunda W, Kieber D, Kiene R, Huntsman S. An antioxidant function for DMSP and DMS in marine algae [J]. Nature, 2002, 418: 317-320.
[18] Berdalet E, Llaveria G, Simó R. Modulation of dimethylsulfoniopropionate (DMSP) concentration in anAlexandriumminutum(Dinophyceae) culture by small-scale turbulence: A link to toxin production [J]. Harmful Algae, 2011, 11: 88-95.
[19] Bucciarelli E, Sunda W G. Influence of CO2, nitrate, phosphate, and silicate limitation on intracellular dimethylsulfoniopropionate in batch cultures of the coastal diatomThalassiosirapseudonana[J]. Limnology & Oceanography, 2003, 48: 2256-2265.
[20] Anderson D M, Glibert P M, Burkholder J M. Harmful algal blooms and eutrophication: Nutrient sources, composition, and consequences [J]. Estuaries & Coasts, 2002, 25: 704-726.
[21] Wilson W H, Turner S, Mann N H. Population dynamics of phytoplankton and viruses in a phosphate-limited mesocosm and their Effect on DMSP and DMS production [J]. Estuarine Coastal & Shelf Science, 1998, 46: 49-59.
[22] Keller M D, Kiene R P, Matrai P A, et al. Production of glycine betaine and dimethylsulfoniopropionate in marine phytoplankton. II. N-limited chemostat cultures [J]. Marine Biology, 1999, 135: 249-257.
[23] Kettles N L, Kopriva S, Malin G. Insights into the regulation of DMSP synthesis in the diatomThalassiosirapseudonanathrough APR activity, proteomics and gene expression analyses on cells acclimating to changes in salinity, light and nitrogen [J]. PLoS One, 2014, 9(4): e94795.
[24] Sournia A. Red tide and toxic marine phytoplankton of the world ocean: An inquiry into biodiversity [J]. Harmful Marine Algal Blooms, 1995(1): 103-112.
[25] Anderson D M. Turning back the harmful red tide [J]. Nature, 1997, 388: 513-514.
[26] Rhodes D, Gage D A, Cooper A, et al. S-Methylmethionine conversion to dimethylsulfoniopropionate: Evidence for an unusual transamination reaction [J]. Plant Physiology, 1997, 115: 1541-1548.
[27] Kocsis M G, Hanson A D. Biochemical evidence for two novel enzymes in the biosynthesis of 3-dimethylsulfoniopropionate inSpartinaalterniflora[J]. Plant Physiology, 2000, 123: 1153-1161.
[28] Guillard R R. Culture of phytoplankton for feeding marine invertebrates [C]. Walter L Smith, Matoira H Chanley. Culture of Marine Invertebrate Animals. Plenum: New York Press, 1975: 29-60.
[29] Galleron C. Synchronization of the marine dinoflagellateAmphidiniumcarteriin dense cultures [J]. Journal of Phycology, 1976, 12: 69-73.
[30] Haaber J, Middelboe M. Viral lysis of Phaeocystis pouchetii: Implications for algal population dynamics and heterotrophic C, N and P cycling [J]. Isme Journal, 2009, 3: 430-441.
[31] Menden-Deuer S, Lessard E J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton [J]. Limnology & Oceanography, 2000, 45: 569-579.
[32] Mclenon A L, Ditullio G R. Effects of increased temperature on dimethylsulfoniopropionate (DMSP) concentration and methionine synthase activity inSymbiodiniummicroadriaticum[J]. Biogeochemistry, 2012, 110: 17-29.
[33] Maxwell K, Johnson G N. Chlorophyll fluorescence—a practical guide [J]. Journal of Experimental Botany, 2000, 51: 659-668.
[34] Zhang H H, Yang G P, Zhu T. Distribution and cycling of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the sea-surface microlayer of the Yellow Sea, China, in spring [J]. Continental Shelf Research, 2008, 28: 2417-2427.
[35] Bucciarelli E, Ridame C, Sunda W G, et al. Increased intracellular concentrations of DMSP and DMSO in iron‐limited oceanic phytoplanktonThalassiosiraoceanicaandTrichodesmiumerythraeum[J]. Limnology & Oceanography, 2013, 58: 1667-1679.
[36] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔ C Tmethod [J]. Methods, 2001, 25: 402-408.
[37] Sunda W G, Hardison R, Kiene R P, et al. The effect of nitrogen limitation on cellular DMSP and DMS release in marine phytoplankton: climate feedback implications [J]. Aquatic Sciences, 2007, 69: 341-351.
[38] Kinsey J D, Kieber D J, Neale P J. Effects of iron limitation and UV radiation onPhaeocystisantarcticagrowth and dimethylsulfoniopropionate, dimethylsulfoxide and acrylate concentrations [J]. Environmental Chemistry, 2015, 13(2): 195-211.
[39] Wang L H, Liu Y H, Ju Y M, et al. Cell cycle propagation is driven by light-dark stimulation in a cultured symbiotic dinoflagellate isolated from corals [J]. Coral Reefs, 2008, 27: 823-835.
[40] Vairavamurthy A, Andreae M O, Iverson R L. Biosynthesis of dimethylsulfide and dimethylpropiothetin by Hymenomonas carterae in relation to sulfur source and salinity variations [J]. Limnology & Oceanography, 1985, 30: 59-70.
[41] 马金华, 孟希, 张淑, 等. 链状亚历山大藻赤潮衰亡的生理调控[J]. 生态学报, 2013, 33: 3978-3986.
Ma J H, Meng X, Zhang S, et al. Physiological regulation related to the decline ofAlexandriumcatenella[J]. Acta Ecologica Sinica, 2013, 33(13): 3978-3986.
[42] Logan B A, Demmig-Adams B, Rosenstiel T N, et al. Effect of nitrogen limitation on foliar antioxidants in relationship to other metabolic characteristics [J]. Planta, 1999, 209: 213-220.
[43] Elena L, Neale P J, Banaszak A T. Increased sensitivity to ultraviolet radiation in nitrogen-limited dinoflagellates: Photoprotection and repair [J]. Limnology & Oceanography, 2002, 47: 86-94.
[44] Berges J A, Falkowski P G. Physiological stress and cell death in marine phytoplankton: Induction of proteases in response to nitrogen or light limitation [J]. Limnology & Oceanography, 1998, 43: 129-135.
[45] Evans J R, Terashima I. Effects of nitrogen nutrition on electron transport components and photosynthesis in spinach [J]. Functional Plant Biology, 1987, 14: 59-68.
[46] Gage D A, Rhodes D, Nolte K D, et al. A new route for synthesis of dimethylsulphoniopropionate in marine algae [J]. Nature, 1997, 387: 891-894.
