溶解氧含量对人工湿地去除污染物效果的影响❋
2018-04-13王宁宁赵阳国孙文丽田伟君
王宁宁, 赵阳国,2❋❋, 孙文丽, 白 洁,2, 田伟君,2
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学环境与生态教育部重点实验室,山东 青岛 266100)
湖泊、河渠等景观水体是城市生态系统的重要组成部分。近年来,随着城市化水平的提高,大量的生产废水和生活污水污染负荷不断增大,严重影响了水环境质量。氮磷污染是河流、湖泊等水体富营养化的主要因子之一,因此如何高效去除污水中的氮、磷污染已成为水处理领域的研究热点之一。
人工湿地作为一种水处理的新技术,近20多年来,在全球范围内,特别是在欧美国家被广泛应用于处理各种类型的废水,如生活污水、工业废水、农业退水、酸性矿水和垃圾渗滤液等。人工湿地具有氮去除效果好、耐冲击、负荷能力强、投资低、能耗低、维护管理方便和生态环境友好[1]等优点,因此非常适合水环境富营养化的防治。但是人工湿地氮去除有许多限制因素,例如溶解氧(Dissolved Oxygen, DO)、pH、温度、微生物、基质以及植物等[2],尤其是湿地内部溶解氧浓度普遍不高,已成为人工湿地污水处理技术的一个重要限制因素。
有研究表明,由于自然复氧不利引起的溶解氧不足(小于2 mg/L)是导致人工湿地出水水质恶化的主要原因。自然跌水是一种有效的人工湿地充氧方式,其充氧效果可用氧亏比根据水温、水质以及充氧形式等外部条件参数进行估算[3]。王小晓等[4]用自然跌水方式进行无动力增氧来处理农村生活污水,结果表明:随着湿地系统中DO值提高, COD、总磷(TP)、总氮(TN)和氨氮(NH3-N)的去除率显著上升。还有学者设计了序批式自动增氧型人工湿地,提高水体溶解氧含量,能够明显提升系统对污染物的去除效果[5]。
本文以辽河口芦苇湿地为背景,模拟湿地生长环境,通过水泵对模拟湿地系统中的污水进行回流,并采用跌水方式,即把回流水管的末端架高,使回流出水高于水面,水流进入水体会产生扰动并起到复氧作用,调节跌水高度和污水回流速度,逐渐提高水体中的溶解氧浓度,采用周期运行模式,定期检测出水水质,从而探究溶解氧对人工模拟湿地系统去除污染水体中污染物的影响。
1 材料和方法
1.1 人工湿地模拟装置
湿地模拟系统由有机玻璃制成(见图1)。模拟系统包括2个长方体水槽,水槽长80 cm,宽20 cm,高40 cm,2个水槽顶部分隔为3个水道,分别长120 cm,宽20 cm,高10 cm,水道首尾相连,便于污水回流。两侧水槽土壤高度27 cm,采用LED灯对系统中植物的生长补充光照,光照总强度为5 000~7 000 Lux,温度控制在18~30℃。本研究主要目的为探讨辽河口湿地对污染物的去除规律,因此人工湿地栽植了辽河口最具代表性的植物芦苇,采用根茎扦插栽植方式,密度约为160棵/m2。

图1 人工湿地模拟系统Fig.1 Artificial wetland simulator system
1.2 实验设计
研究采用5组平行装置,按批式方式处理微污染水。由于该装置主要模拟辽河口芦苇湿地生态系统对污染物的去除规律,因此进水水质也参考辽河口湿地水体进行人工配制。根据杨继松等[6]对辽河口湿地水环境质量的综合评判,辽河口湿地采样点水质级别多为Ⅴ类,水环境质量较差。为此,本研究采用人工配制劣Ⅴ类水作为人工湿地进水,在自来水中通过添加乙酸钠(CH3COONa)、氯化铵(NH4Cl)、硝酸钠(NaNO3)和磷酸二氢钾(KH2PO4)模拟污水中COD、氨氮、总氮和总磷等污染物质,具体水质见表1。进水的pH维持在7.5~8.0。
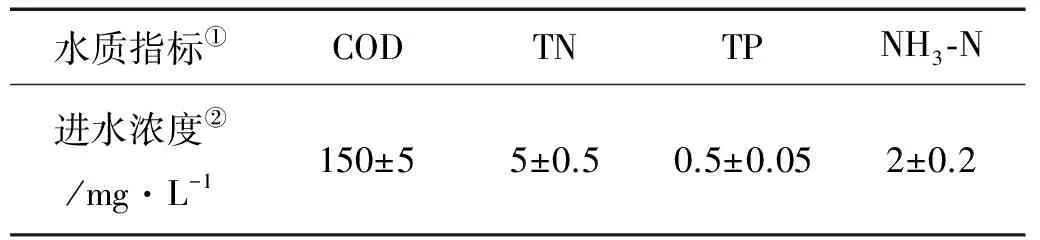
表1 人工湿地污水处理系统进水水质指标Table 1 Influent quality index of constructed wetland wastewater treatment system
Note: ①Water quality index;②Influent concentration
采用自然跌水方式,通过回流泵将出口处污水回流至进水处,并且使水流自由落体进入系统,一方面能够产生富氧作用,另一方面也起到了推流的作用。在本研究中,采用溶氧仪(哈希HQ30d)直接插入水体中测定溶解氧的方法,来确定跌水复氧效果。5组平行装置中,1组(C0)不进行跌水复氧,水体中溶解氧含量为对照,即为复氧前溶氧含量,DO浓度一般为0.5~1.2 mg/L;另外4组(C1~C4)分别通过回流泵,以自然跌水方式进行复氧。控制回流泵流速为18 L/h,通过反复调整出水口高度,同时测定溶解氧浓度,发现出水口的高度分别为5、8、15和20 cm时,能够使人工湿地系统内水体氧含量保持在2、4、6和8 mg/L左右并保持相对稳定。5组装置批式处理周期设计为3 d,在处理过程中,分别按时间序列每12 h取一次水样检测水质指标变化。
在运行周期结束时,采集湿地表层土壤(0~5 cm)用于微生物群落分析,该区域土壤与水体联系最为密切,对水中污染物的去除具有重要影响。
1.3 水质测定方法
通过测定进出水中的污染物指标浓度变化,分析系统对水体的净化作用。水体中COD用重铬酸钾法测定,NH3-N用纳氏试剂分光光度法测定,TN用过硫酸钾氧化-紫外分光光度法测定,TP用钼锑抗分光光度法测定。
1.4 微生物群落分析
样品TE1组包括TE1.1、TE1.2、TE1.3和TE1.4,分别对应实验组溶解氧为8、6、4和2 mg/L时的表层土壤,TE2组对应未进行复氧的表层土壤,HJ3组对应在展开实验之前刚填入模拟系统中的初始环境土壤。
对于微生物群落的组成分析,用高效土壤DNA提取试剂盒(Mobio,美国)提取土壤中的总DNA。提取完成后取5 μL DNA样品进行琼脂糖凝胶电泳,定性检测DNA纯度和质量。参考文献[7]的方法,以微生物总DNA为模板,采用16S rDNA通用引物515F(5'-GTGCCAGCAGCCGCGGTAA-3')和806R(5'-GGACTACCAGGGTATCTAAT-3')进行PCR扩增分析,PCR产物采用 Illumina公司Miseq平台进行高通量测序(委托北京诺禾致源完成)。测得的序列通过拼接及筛选后,以相似性97%为标准获得操作分类单元(OTU),OTU通过RDP数据库(http://rdp.cme.msu. edu/)中的Classifer程序进行检索分类,按文献[7]的方法分析微生物群落的Shannon多样性指数、种类组成、相对丰度,对群落的差异进行分析。
2 结果与讨论
2.1 人工湿地对COD的去除效果
污水中的有机物包括颗粒性有机物和溶解性有机物。颗粒性有机物会通过湿地系统的沉淀、过滤而被截留下来;溶性有机物则会通过植物根系、土壤颗粒的吸附和生物代谢降解作用被去除,但是可溶性的有机物的去除效率慢,并且在好氧、缺氧及厌氧条件下的去除方式各不相同。由图2可以看出,所有处理中,COD浓度均随时间呈现出明显的下降趋势。随着DO值的不断增大,系统出水中的COD浓度越来越低,说明更高的溶解氧含量能够促进COD的去除。经过测定,对照组C0的COD去除率为27.61%,通过自然跌水后,DO分别达到2、4、6和8 mg/L时,COD的最大去除率分别为31.23%、44.86%、69.32%和85.56%,即在相同初始条件下,当水体中DO值在8 mg/L时,系统出水中COD浓度最低,去除效果更好。
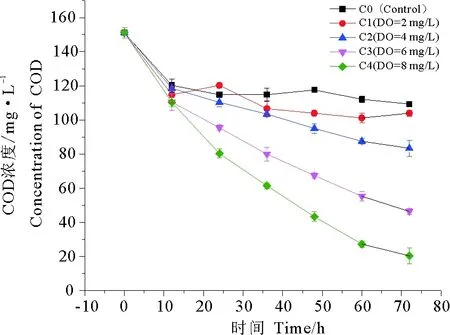
图2 不同氧浓度条件下COD的去除效果Fig.2 Removal rate of COD under different oxygen concentration
有研究表明,植物生长过程中,光合作用产量的10%~20%被转移到根部[8],刺激根区微生物活性,加速有毒有害物质的转化以及COD等有机物污染物的降解。而本研究表明,溶解氧对COD去除的影响远大于植物对COD的影响,可能与植物的覆盖率低、光合作用强度较弱等因素有关。
2.2 人工湿地对氮的去除效果
人工湿地对水中各种形态的氮具有良好的去除效果,其对氮的去除机制包括基质的吸附、过滤、沉淀以及氮的挥发、植物的吸收和湿地中微生物硝化与反硝化作用[9]。湿地植物在人工湿地系统中对含氮污染物的去除起到了重要的作用。研究表明[10-16],人工湿地中栽种植物的脱氮效果显著高于未栽种植物的,栽种植物后湿地脱氮效率提高了17%~65%。分析原因在于栽种植物后土壤中细菌数量比未栽种的高1~2个数量级[17]。还有研究表明,湿地系统去除的氮元素中近90%是依靠植物根系和填料表面微生物作用去除的[18-19]。微生物硝化和反硝化作用是主要的、长期有效的脱氮机制起主导作用[20-21]。微生物硝化作用被认为是人工湿地脱氮的限制步骤[22-23]。由图3(a)可以看出,当DO=8 mg/L时,氨氮最大去除率为94.70%,对照组的去除率为51.05%。在相同的时间段内,DO值越大,出水氨氮浓度越低,说明湿地系统在溶解氧含量较高时对氨氮有较好的去除效果。氨态氮的去除主要通过系统中的硝化细菌经过硝化作用转变成硝态氮,再经过反硝化作用变成氮气而被去除,而硝化过程需要在好养条件下进行,反硝化过程需要在厌氧条件下进行,因此氧气充足有利于氨态氮的去除,但是会抑制硝态氮的反硝化去除。

图3 不同氧浓度条件下氨氮和总氮的去除效果Fig.3 Removal rate of nitrogen under different oxygen concentration
由图3(b)可以看出,DO值为2和4 mg/L的实验组与对照组的总氮去除率分别为8.32%和9.09%,差异较小且效果不好。当DO值达到6和8 mg/L时,对应去除率分别为66.39%和91.00%,总氮浓度迅速降低,效果明显。在实验初始阶段,总氮浓度出现增加现象,可能是该阶段硝化细菌生长旺盛,氨氮通过硝化作用转化生成大量硝态氮,但反硝化作用受到抑制,进而出现硝态氮积累。然而,随着溶解氧的提升,总氮的去除率不降反升,反硝化作用并未受到明显抑制。可能的原因主要有:(1)溶解氧提升促进了微生物的大量繁殖,快速消耗大量溶解氧,短时间内形成局部的缺氧环境,反硝化作用加强,总氮去除明显;(2)存在好氧反硝化现象[24,25]。系统中可能存在好氧反硝化细菌,在氧含量较高时能够促进好氧反硝化细菌对硝态氮的转化,加快总氮的去除。
2.3 人工湿地对磷的去除效果
人工湿地系统对磷的去除主要通过微生物的同化或植物的吸收作用、聚磷菌的摄取作用与基质的物理化学作用[26]。崔丽娟等[27]研究表明,不同构建类型的人工湿地对TP的去除效果优于对TN的去除效果。由图4可以看出,随着溶解氧浓度的提高,总磷去除率也越高。对照组总磷去除率为16.27%,实验组从C1~C4总磷去除率分别为47.16%、60.96%、68.48%、80.13%,即当溶解氧浓度为8 mg/L时,总磷去除效果最好。在氧气充足的条件下,一方面聚磷菌在充分利用基质的同时,从废水中摄取大量溶解态的正磷酸盐,从而完成聚磷的过程,而聚磷菌则可通过沉淀进入土壤;另一方面,好氧条件有利于土壤中Fe2+氧化成Fe3+,而Fe3+更易与磷酸盐结合形成难溶的磷酸铁沉淀。
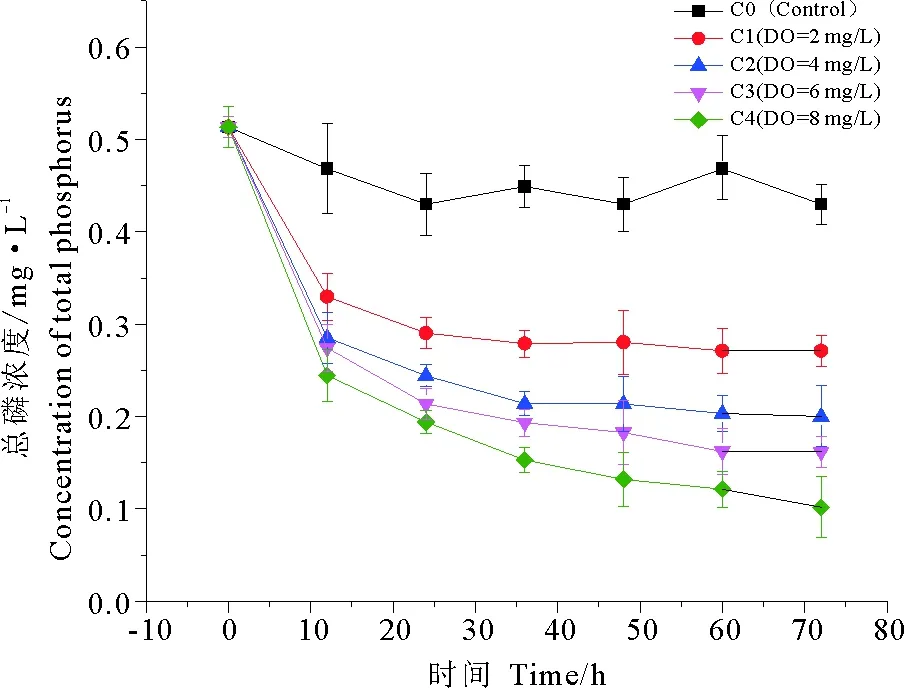
图4 不同氧浓度条件下总磷去除效果
被吸附或沉积的磷元素仍然存在于湿地系统中,在溶解氧浓度较低时,聚磷菌释放磷酸盐,释放出的磷酸盐将被芦苇植被直接吸收,最后对芦苇进行收割,并对磷进行彻底去除。
基于以上分析,可见较高的氧浓度对水体中COD、氮和磷的去除具有很好的促进作用。因此,可以在辽河口湿地中通过太阳能水泵将地势较低区域中汇集的水输送至地势较高点,通过创造跌水条件及提高水动力循环过程强化复氧效果。
2.4 微生物群落组成变化
对6个微生物样品进行高通量测序分析,样品TE1.1~TE1.4分别获得95 156、97 291、95 817和82 607条有效序列,对照样品TE2获得了87 418条有效序列,初始环境样品HJ3获得了80 417条有效序列,覆盖度均达到90%以上。不同样品序列稀释曲线结果如图5。
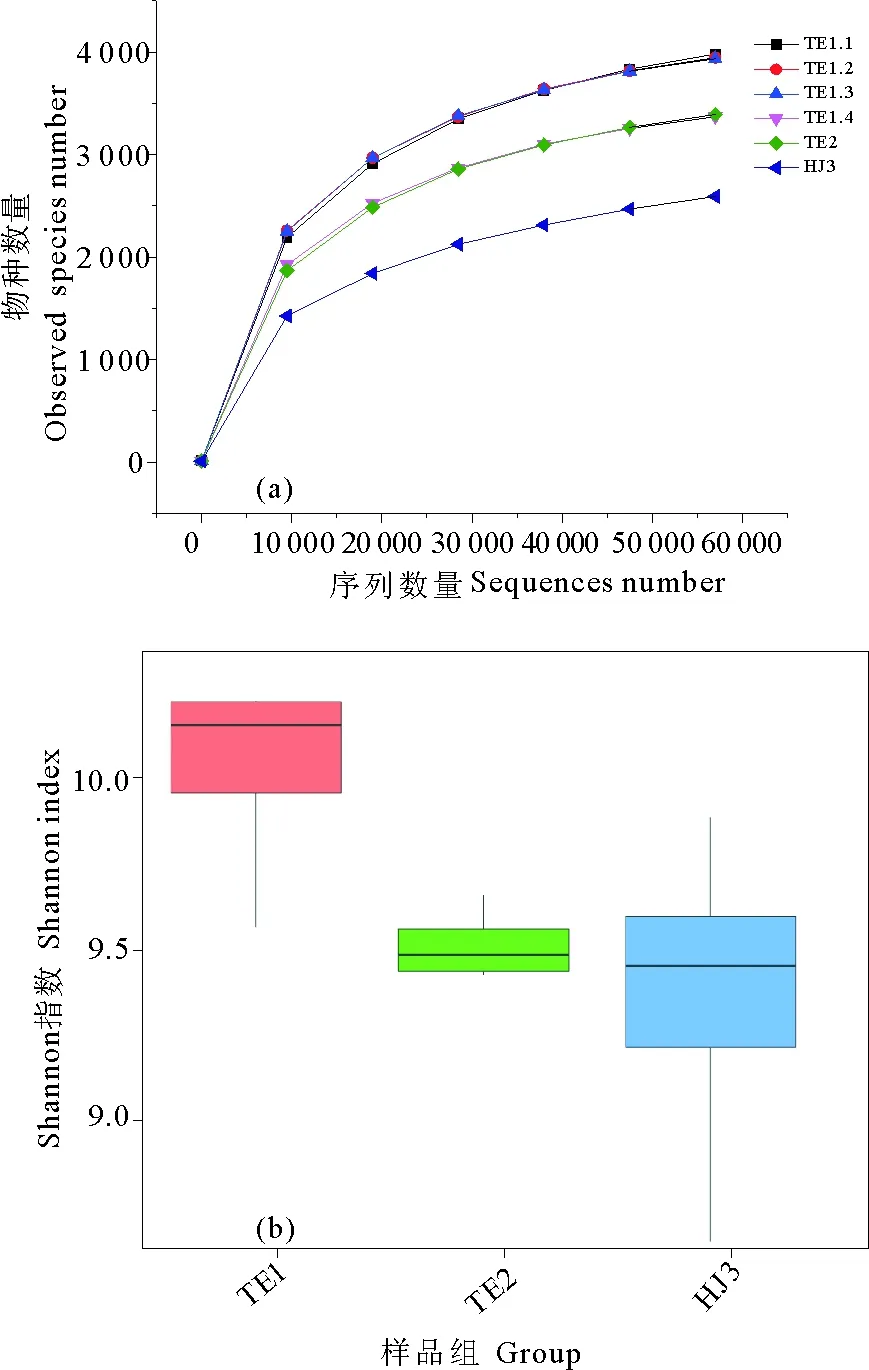
图5 不同样品微生物群落高通量序列的稀释曲线(a)与shannon指数箱形图(b)
根据图5(a)可以看出,在溶解氧浓度较高的样品中微生物种类较多,对照组微生物种类普遍较低,在初始环境中的样品中微生物种类相对更低,受环境因素影响较大,说明人工湿地系统中芦苇的生长促进了不同微生物的生长,提高了系统中微生物的丰富度。相对于溶解氧较高的实验组,在溶解氧浓度为2 mg/L时微生物种类非常低。有研究表明,好氧环境中往往含有更多种类的微生物,更高的微生物群落多样性;而厌氧环境中微生物种类则要低的多[28],这主要是由环境条件和微生物的特性来决定的。厌氧微生物的营养生态位相对较窄,能够代谢的营养物质比较有限,而且往往需要更苛刻的环境条件,这就造成在许多条件下厌氧微生物无法生存,进而导致其种类在该环境中的下降;相反,好氧微生物能够利用的营养物质相当宽泛,而且部分好氧微生物可以进行兼性的厌氧呼吸,这就形成了在某些生境中好氧微生物种类更为丰富的特征。在增加水循环改变溶解氧条件的实验组中微生物种类最高,其次是对照组,初始土壤中微生物种类相对最低,也同样说明人工湿地系统能够提高微生物种类,并且溶解氧条件对微生物生长有很大影响。
由微生物群落多样性Shannon指数图5(b)可知,经过自然跌水进行复氧的实验组微生物多样性最高,Shannon指数为10左右,而对照组TE2和原始环境HJ3多样性指数在9.5左右。好氧条件下微生物群落繁殖快,生长旺盛,群落种类增多。相对于原始环境中的微生物群落状态,湿地系统也有利于微生物的繁殖,能够提高物种多样性。
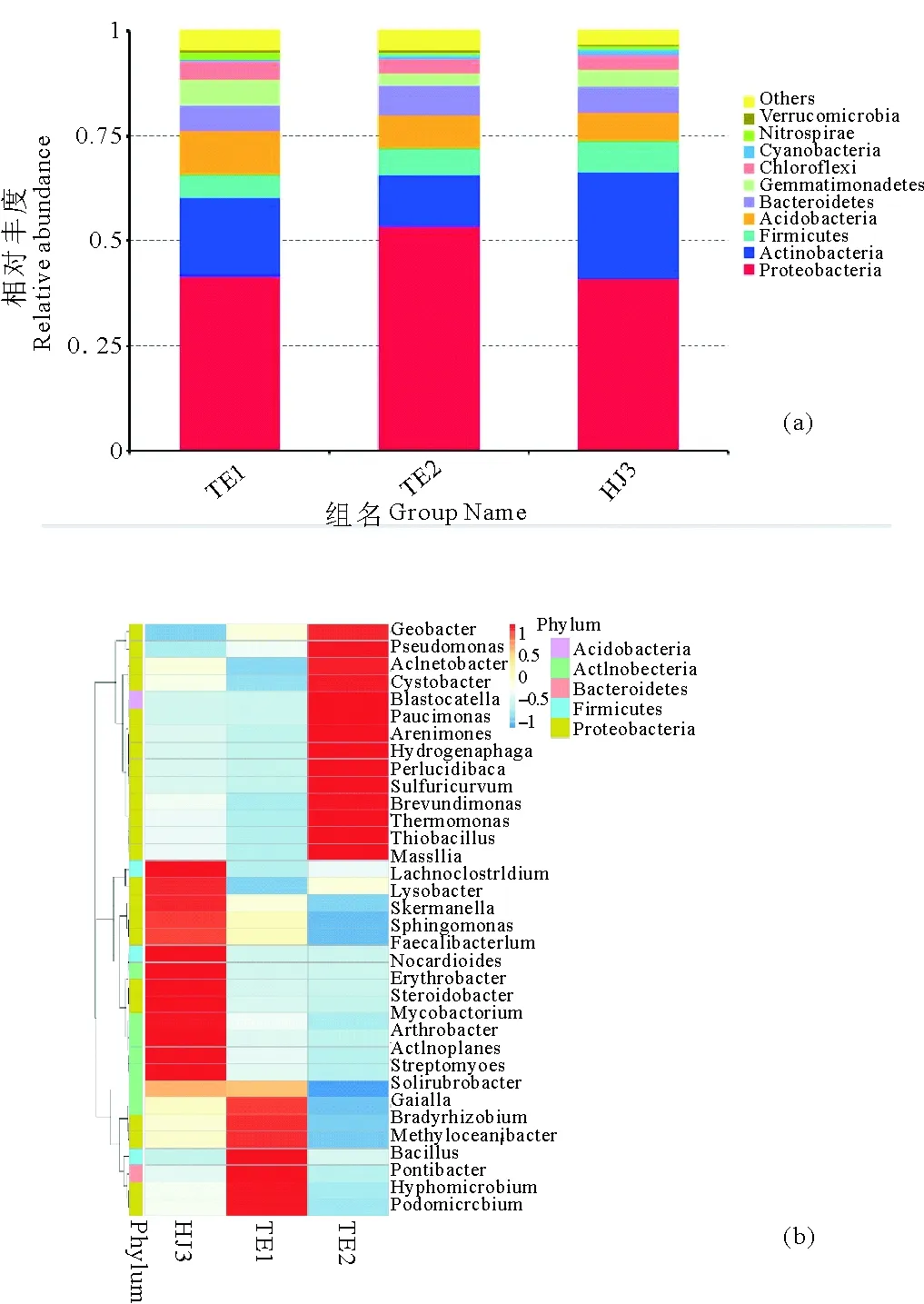
图6 不同组别在门水平上的物种相对丰度柱形图(a)和物种丰度聚类图(b)
由图6(a)可以看出,所有样品中变形菌门(Proteobacteria)相对丰度最高,占41.1%~53.7%,其次是放线菌门(Actinobacteria),占12.0%~25.4%,酸杆菌门(Aci-dobacteria)占6.8%~10.6%,拟杆菌门(Bacteroidetes)占6.0%~7.2%,厚壁菌门(Firmicutes)占5.4%~7.4%。这5个门为微生物群落中的绝对优势类群。随着溶解氧浓度的提高,变形菌门、放线菌门、酸杆菌门的微生物种类有所下降,而拟杆菌门和厚壁菌门的微生物种类增多,表明水相中的溶解氧含量对土壤中微生物群落结构有较大影响。
对丰度较高的微生物门进行更细致的划分,在属水平的聚类图如图6(b)。在初始环境样品HJ3中,虽然优势菌属类别较多,但是由图5可以看出微生物种类较少。变形菌门(Proteobacteria)和厚壁菌门(Firmicut-es)微生物属种丰度最高,其中鞘氨醇单胞菌属(Aphingobium)丰度较高,该菌属对于环境中的污染物特别是多环芳烃的降解有很大作用[29]。在进行复氧的实验组TE1样品中,生丝微菌属(Hyphomicrobium)丰度非常高,该菌属在有氧时能以铵盐和硝酸盐为有效氮源,厌氧条件下则能以硝酸盐作为氮源生长,具有反硝化作用,有利于系统中氮的去除[30]。
在对照组TE2样品中,假单胞菌属(Pseudomonas)丰度比较高。该菌属中的荧光假单胞菌是植物根际最普遍的微生物类群,具有分布广,数量多,营养需要简单,繁殖快,竞争力强的特点,而且许多菌株能产生几种活性物质,抗多种植物病害[31]。不同的环境条件下微生物类群差异较大,且对环境污染治理作用较大,微生物利用最有利于自身生长的物质和条件,达到最优的效果。
3 结论
通过水泵对模拟湿地系统中的污水进行回流,并采用跌水方式,提高水体中的溶解氧浓度,探究了溶解氧对污染物去除的影响,主要结论如下:
(1)溶解氧浓度越高越有利于提高微生物活性,有利于污染物质的去除。在DO值达到8 mg/L时,COD的去除率达到86.56%,与对照相比提高了2.14倍;氨氮的去除率达到94.70%;总氮的去除率达到91.00%;总磷的去除率达到80.13%。
(2)系统中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)是优势菌群,并且溶解氧浓度对系统中微生物群落结构有一定影响,随着溶解氧浓度的提升,微生物种类相对提高。
参考文献:
[1] Vymazal J. The use of sub-surface constructed wetlands for wastewater treatment in the Czech Republic: 10 years experience[J]. Ecological Engineering, 2002, 18(5): 633-646.
[2] Solano M L, Soriano P, Ciria M P. Constructed wetlands as a sustainable solution for wastewater treatment in small villages[J]. Biosystems Engineering, 2004, 87(1): 109-118.
[3] 肖海文, 邓荣森, 翟俊, 等. 溶解氧对人工湿地处理受污染城市河流水体效果的影响[J]. 环境科学, 2006, 27(12): 2426-2431.
Xiao H W, Deng R S, Zhai J, et al. Effect of DO distribution on contaminated urban stream water treatment performance in constructed wetland[J]. Environmental Science, 2006, 27(12): 2426-2431.
[4] 王小晓, 龚珞军, 韩炜, 等. 自然复氧人工湿地处理农村污水动力学研究[J]. 环境科学与技术, 2014, 37(2): 143-148.
Wang X X, Gong L J, Han W, et al. Dynamics study on two-stage constructed wetland treatment with natural reaeration to treat rural sewage[J]. Environmental Science & Technology, 2014, 37(2): 143-148.
[5] 朱联东, 李兆华, 熊欣, 等. 序批式自动增氧型人工湿地运行效能研究[J]. 污染防治技术, 2009, 22(6): 10-13.
Zhu L D, Zhao-Hua L I, Xiong X, et al. Study on removal efficiency of constructed wetland with sequencing batch self-aeration[J]. Pollution Control Technology, 2009, 22(6): 10-13.
[6] 杨继松, 陈红亮, 吴昊, 等. 辽河口湿地水质模糊综合评判研究[J]. 沈阳大学学报: 自然科学版, 2012, 24(3): 5-8.
Yang J S, Chen H L, Wu H, et al. Water quality assessment of Liaohe River estuarine wetland based on fuzzy comprehensive evaluation method[J]. Journal of Shenyang University (Natural Science), 2012, 24(3): 5-8.
[7] Qin J, Li R, Raes J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65.
[8] Dunbabin J S, Pokorny J, Bowmer K H. Rhizosphere oxygenation by Typha domingensis Pers. in miniature artificial wetland filters used for metal removal from wastewaters[J]. Aquatic Botany, 1988, 29(4): 303-317.
[9] Schaafsma J A, Baldwin A H, Streb C A. An evaluation of a constructed wetland to treat wastewater from a dairy farm in Maryland, USA[J]. Ecological Engineering, 1999, 14(1): 199-206.
[10] Gagnon V, Maltais-Landry G, Puigagut J, et al. Treatment of hydroponics wastewater using constructed wetlands in winter conditions[J]. Water Air & Soil Pollution, 2010, 212(1-4): 483-490.
[11] Zhu H, Yan B, Xu Y, et al. Removal of nitrogen and COD in horizontal subsurface flow constructed wetlands under different influent C/N ratios[J]. Ecological Engineering, 2014, 63: 58-63.
[12] Salvato M, Borin M, Doni S, et al. Wetland plants, micro-organisms and enzymatic activities interrelations in treating N polluted water[J]. Ecological Engineering, 2012, 47: 36-43.
[13] Cheng X Y, Wang M, Zhang C F, et al. Relationships between plant photosynthesis, radial oxygen loss and nutrient removal in constructed wetland microcosms[J]. Biochemical Systematics and Ecology, 2014, 54: 299-306.
[14] 凌祯, 杨具瑞, 于国荣, 等. 不同植物与水力负荷对人工湿地脱氮除磷的影响[J]. 中国环境科学, 2011, 31(11): 1815-1820.
Ling Z, Yang J R, Yu G R, et al. Influence of different plants and hydraulic loading on the nitrogen and phosphorus removal of constructed wetlands[J]. China Environmental Science, 2011, 31(11): 1815-1820.
[15] 吴海明, 张建, 李伟江, 等. 人工湿地植物泌氧与污染物降解耗氧关系研究[J]. 环境工程学报, 2010, 4(9): 1973-1977.
Wu H M, Zhang J, Li W J, et al. Relationship between oxygen release from plants in constructed wetland and oxygen demand for pollutant degradation[J]. Chinese Journal of Environmental Engineering, 2010, 4(9): 1973-1977.
[16] Wu H, Zhang J, Wei R, et al. Nitrogen transformations and balance in constructed wetlands for slightly polluted river water treatment using different macrophytes[J]. Environmental Science and Pollution Research, 2013, 20(1): 443-451.
[17] Gagnon V, Chazarenc F, Comeau Y, et al. Influence of macrophyte species on microbial density and activity in constructed wetlands[J]. Water Science and Technology, 2007, 56(3): 249-254.
[18] Stottmeister U, Wieβner A, Kuschk P, et al. Effects of plants and microorganisms in constructed wetlands for wastewater treatment[J]. Biotechnology Advances, 2003, 22(1): 93-117.
[19] 张迎颖, 丁为民, 陈秀娟, 等. 复合垂直流人工湿地的脱氮机理及影响因素分析[J]. 环境工程, 2009, 27(5): 36-39.
Zhang Y Y, Ding W M, Chen X J, et al. Analysis of nitrogen removal mechanism and influence factors in integrated vertical flow constructed wetland[J]. Environmental Engineering, 2009, 27(5): 36-39.
[20] Lin Y F, Jing S R, Wang T W, et al. Effects of macrophytes and external carbon sources on nitrate removal from groundwater in constructed wetlands[J]. Environmental Pollution, 2002, 119(3): 413-420.
[21] Tanner C C, Kadlec R H, Gibbs M M, et al. Nitrogen processing gradients in subsurface-flow treatment wetlands-influence of wastewater characteristics[J]. Ecological Engineering, 2002, 18(4): 499-520.
[22] 郡路, 王世和, 锥维国, 等. 运行条件下潜流型人工湿地溶氧状态研究[J]. 环境科学, 2006, 27(10): 2009-2013.
Yan L, Wang S H, Luo W G, et al. Study on the oxygen condition in subsurface flow wetlands in operation[J]. Environmental Science, 2006, 27(10): 2009-2013.
[23] 何连生, 刘鸿亮, 席北斗, 等. 人工湿地氮转化与氧关系研究[J]. 环境科学, 2006, 27(6): 1083-1087.
He L S, Liu H L, Xi B D, et al. Relationship between the nitrogen removal and oxygen demand in constructed wetlands[J]. Environmental Science, 2006, 27(6): 1083-1087.
[24] 赵丹, 于德爽, 李津, 等. 菌株 ZD8 的分离鉴定及其异养硝化和缺氧/好氧反硝化特性研究[J]. 环境科学学报, 2013, 33(11): 3007-3016.
Zhao D, Yu D S, Li J, et al. Isolation and identification of a bacterial strain ZD8 and its characteristics of heterotrophic nitrification and anoxic/oxic denitrification[J]. Acta Scientiae Circumstantiae, 2013, 33(11): 3007-3016.
[25] Robertson L A, Van Niel E D W J, Torremans R A M, et al. Simultaneous nitrification and denitrification in aerobic chemostat cultures ofThiosphaerapantotropha[J]. Applied and Environmental Microbiology, 1988, 54(11): 2812-2818.
[26] Yang X, Li C, Wan L, et al. Study on constructed wetland for treatment agricultural runoff[J]. Chinese Agricultural Science Bulletin, 2010, 26(15): 349-352.
[27] Cui L, Zhang M, Wei L I, et al. Research on the effects of constructed wetlands for eutrophication waterbodies[J]. Ecology & Environmental Sciences, 2010, 19(9): 2142-2148.
[28] Gao C, Wang A, Wu W M, et al. Enrichment of anodic biofilm inoculated with anaerobic or aerobic sludge in single chambered air-cathode microbial fuel cells[J]. Bioresource Technology, 2014, 167: 124-132.
[29] 苟敏, 曲媛媛, 杨桦, 等. 鞘氨醇单胞菌降解芳香化合物的新型微生物资源[J]. 应用与环境生物学报, 2008, 14(2): 276-282.
Gou M, Qu Y Y, Yang H, et al.Sphingomonassp.: A novel microbial resource for biodegradation of aromatic compounds[J]. Chinese Journal of Applied and Environmental Biology, 2008, 14(2): 276-282.
[30] 陈一平, 范成英, 郑坚, 等. 生丝微菌属的一个新亚种[J]. 微生物学报, 1992, 32(3): 161-166.
Chen Y P, Fan C Y, Zheng J, et al. A new subspecies of the genusHyphomicrobium[J]. Acta Microbiologica Sinica, 1992, 32(3): 161-166.
[31] 张伟琼, 聂明, 肖明. 荧光假单胞菌生防机理的研究进展[J]. 生物学杂志, 2007, 24(3): 9-11.
Zhang W Q, Nie M, Xiao M. Advances in biocontrol mechanism ofPseudomonasfluorescens[J]. Journal of Biology, 2007, 24(3): 9-11.
